高镁锂比盐湖卤水降镁研究
2022-03-04李海朝张丽娟祝永强
辛 娟,李海朝,张丽娟,祝永强
(青海民族大学,青海省应用物理化学重点实验室,青海西宁 810007)
氯化物型盐湖老卤中存在钠、镁、钾、锂等无机盐,是一种极其宝贵的自然资源。我国苦卤的利用率是20%左右,大量苦卤作为废料处理,集中存放或者随意排放,不仅造成环境污染,资源浪费;而且镁盐不被综合利用,会影响其它盐类开发利用,如氯化物型钾镁盐矿床,老卤镁含量高,大多数以MgCl2·6H2O形式存在,锂含量低以及高镁锂比等因素,严重限制锂盐工业发展;在生产钾肥过程中,每产出1 t钾肥副产40 m3的MgCl2卤水产生[2],而MgCl2又在水中容易溶解,粘度大[2],就会形成造成降低钾盐品位的“镁害”;李海朝等[3]人研究发现MgCl2在卤水中的存在也会对卤水成矿时间有很大影响;因此如何高效综合利用氯化物型盐湖老卤中的镁资源,是一个值得探讨和研究的课题。
镁盐产品主要有Mg(OH)2、MgO、MgCO3·H2O等无机产品,其中MgCO3·3H2O具有密度小、强度大、高弹性模量和绝缘性良好等特性,在高分子材料的增强、绝热、防火、颜料改性等[4]方面的应用突出。近些年,任宏瑞[5]、王素平[6]、张士航[7]、吴建松[8]、祁洪波[9]、赵斌[10]等人分别以NaOH、Na2CO3、NaHCO3、NH3·H2O、MgSO4等物质为沉淀剂,制备三水碳酸镁、氢氧化镁、碱式碳酸镁等,以及对这些物质进行了热分解、形貌、及晶须生长条件等方面的研究很完美;所以文章将在借鉴前人的基础上,考虑降镁过程中是否会对锂离子造成影响,所以在室温下以Na2CO3为沉淀剂,实现模拟大自然盐湖卤水自然沉淀,可以降低卤水镁和镁锂比,对改善锂的生产工艺具有一定意义。
1 实验部分
1.1 原料、试剂和仪器
原料。模拟氯化物型盐湖卤水,金属离子Mg2+、Na+、K+、Li+质量浓度分别25 g/mL、3 g/mL、1.5 g/mL、1.8 g/mL、0.2 g/mL。
试剂:实验所用试剂均为分析纯,氯化钠(NaCl 天津恒山化工科技有限公司)、氯化镁(MgCl·6H2O 无锡市亚泰联合化工有限公司)、氯化钾(KCl 无锡市亚泰联合化工有限公司)、碳酸钠(Na2CO3天津市风船化学试剂科技有限公司),氯化锂(LiCl 天津市科密欧化学试剂有限公司),试验用水均为去离子水。
仪器。TG/DTA6000 综合热分析仪(Netasch-449c)、ICP等离子体发射光谱仪(iCAP 6000 SERIES 北京京科瑞达科技有公司)、X射线衍射仪(*VItimaIV理学 北京冠远科技有限公司)、循环水真空泵(SHB-Ш 河南艾瑞德仪器有限公司)、恒温鼓风干燥器(DHG-9075A 上海一科学仪器有限公司恒)、电子天平(JA-2003 青岛明博环保科技有限公司)、单通道移液枪(F1-ClipTip 河南艾瑞德仪器有限公司)。
1.2 实验方法
在室温下,分别称取一定量的MgCl·6H2O、NaCl、KCl、LiCl依次加入烧杯中溶解,用玻璃杯转移到100 mL容量瓶中定容,静置几分钟后,倒入250 mL烧杯中,依次称取不同质量的Na2CO3缓缓加入,用玻璃杯搅拌1 min~2 min,待反应完全后,用循环水真空泵抽滤、蒸馏水洗涤3次~4次后,将滤饼放置于80 ℃恒温鼓风干燥器烘干后称量并进行表征,将其滤液样进行化学分析。
2 结果与分析
2.1 不同NaCO3加入量对降镁的效果
ICP-MS全称是电感耦合等离子体质谱仪,一种将ICP技术和质谱结合在一起的分析仪器。可以分析元素周期表中所有金属元素,同时可以分析绝大部分非金属元素,例如As、Se、P、S、Si、Te等,检出限低于1 μg/kg,如果配合使用氢化物发生器,这些非金属的检出限可以改善10倍以上。被广泛应用于半导体、地质、环境以及食品检测等行业中。文章将取抽滤后滤液的上清液,稀释5 000倍,用ICP等离子体发射光谱仪(ICAP MS)来测定其中镁离子的含量,即母液中镁离子的剩余含量如图1。
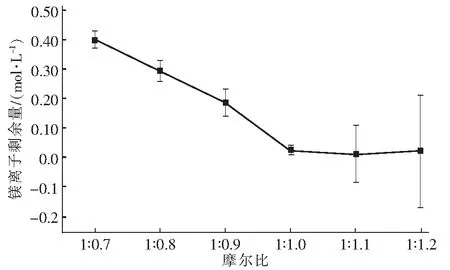
图1 不同摩尔比下母液中镁离子的剩余量Fig.1 Residual content of magnesium ion in mother liquor
从图1不同摩尔比下母液中镁离子剩余量中可以发现,镁离子摩尔浓度从初始值1.23 mol/L降低到0.013 mol/L,在摩尔比低于1 ∶1.0时,镁离子呈直线下降,符合方程式:MgCl2+NaCO3→MgCO3↓+2NaCl,而当到达1 ∶1.10这个转折点,没有直线下降,但镁离子量仍在继续减少,在图中1 ∶1.1时,镁离子剩余量处在最低位置,不能表明是剩余量最小值,而是变化不大,说明该反应并不完全,应是可逆反应,所以在1 ∶1.1时,镁离子剩余量不是最小值。
2.2 反应物配比对产物组成的影响
X射线衍射仪(*VItimaIV理学)分析物相组成,Cu Kα辐射,管电压40 kV,管电流40 mA,扫描速度10°/min,扫描范围5°~80°。在反应温度为室温、MgCl2浓度为1.23 mol/L条件下,MgCl2与NaCO3摩尔比分别为1 ∶0.7、1 ∶0.8、1 ∶0.9、1 ∶1.0、1 ∶1.1、1 ∶1.2,所得到产物XRD图谱如图2。
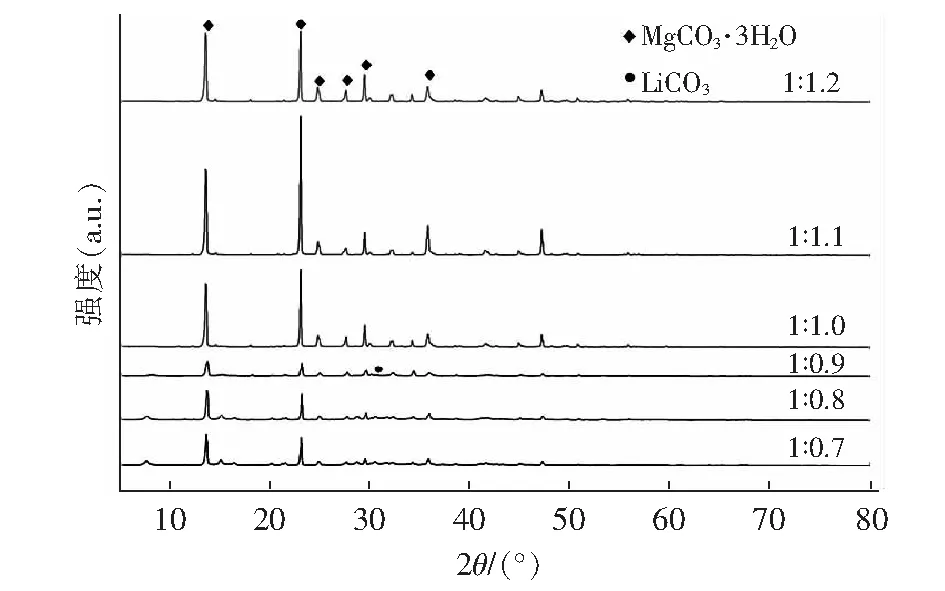
图2 不同摩尔比下生成产物的XRD图谱Fig.2 XRD patterns of the products generated at different molar ratios
根据JADE.6软件的标准卡片PDF#70-1433,在图2中发现属于MgCO3·3H2O的特征衍射峰晶面(-101)、(200)、(004)、(021),因此可以断定固相主要成分为MgCO3·3H2O,且随着摩尔比的增加,产物的结晶度越好,表明产品质量越好。同时发现当摩尔比为1 ∶1.1时,它的结晶度最好,但是当摩尔比<1 ∶1.0时,XRD图谱会看到沉淀产物中会有锂离子出现,而摩尔比>1 ∶1.0时,未出现锂离子,造成这个现象的原因,可能是由于在摩尔比<1 ∶1.0时,三水碳酸镁结晶度不高,产物呈絮状,晶型表面粗糙,可能存在孔道结构,沉淀时会夹带含有锂离子的溶液;而摩尔比在≥1 ∶1.0时,晶体结晶度高,晶型表面光滑,孔道结构消失,且碳酸锂释放并溶于水,因此在产物中碳酸锂会消失。然后借助Jade 6 软件中RIR值,计算得到产物中锂离子的质量百分比来验证XRD物相的正确性,即产物中锂离子的质量百分比见图3。
从图3可以发现,随着摩尔比的增加,在摩尔比<1 ∶1.0时,产物中出现锂离子,而摩尔比≥1 ∶1.0时,质量百分比为0;这个可能的原因是:当摩尔比<1 ∶1.0时,产物MgCO3·3H2O,呈絮状,或者存在孔道结构,沉淀时包夹含有锂离子的溶液一起沉淀,而到摩尔比1 ∶1.0时,产物晶型表面光滑,沉淀时未包夹溶液沉淀,因此产物没有检测到锂离子,百分比接近零,上述结论与XRD图谱结果一致。
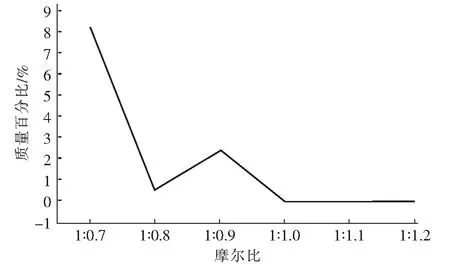
图3 产物中锂离子的质量百分比Fig.3 The mass percentage of lithium ions in the product
3 结论
中国盐湖镁资源丰富,如果直接排放到原来盐田,会导致盐田成矿时间延长、增加镁锂比的数值,影响锂资源的生产,而且也会给环境带来负担,由Na2CO3作为沉淀剂,可以达到降镁的目的,但是当摩尔比低于1 ∶1.0时,会夹带含有锂离子的溶液一起沉淀,因此需要控制镁离子与碳酸根离子比例在1 ∶1.0~1 ∶1.2之间,就不会出现夹带锂离子的情况,当超过摩尔比1 ∶1.2时,估计会出现锂离子夹带情况,没有实际意义,所以镁离子与碳酸根离子比例在1 ∶1.0~1 ∶1.2之间,降镁不会影响卤水中锂离子含量,可以实现降镁、降低卤水中大量镁的存在对卤水蒸发效率的影响,以及降低盐湖镁锂比,这对锂资源的利用具有潜在意义。
