BFA钙盐复合融雪材料的制备研究
2022-03-04韩永萍李义强曹玉海赵月霞黄占斌
韩永萍,李义强,曹玉海,张 璐,赵月霞,黄占斌
(1.北京联合大学生物工程学院 生物质废弃物资源化利用北京市重点实验室,北京 100023;2.北京市首发天人生态景观有限公司,北京 102600;3.北京矿业大学(北京)化学与环境工程学院,北京 100083)
融雪剂已经成为目前快速除雪、保障城市雪天交通的必须手段。以氯化钠为代表的传统氯盐型融雪剂具有融雪效果好、价格低廉等优势。实践表明,环境中大量残存的氯盐不仅使混凝土和沥青路面产生冻融破坏,缩短立交桥设计使用寿命,而且还促使土壤盐碱化,引起绿化植物盐害或死亡[1-2]。由工农业生产废弃物开发的CMA(醋酸钙镁)有机融雪剂,因原料处理程序繁杂且来源有限,每吨产品近万元的价格限制了其大范围使用[3]。因此,急需研制一种高效、价格适宜、环境友好型融雪材料。
腐殖酸是一种以多元醌和多元酚为芳香核芯的弱酸性高聚物,结构中富含与融雪性能相关的-COOH和-OH等亲水基团[4]。大宗生化腐植酸(BFA)产品一般由植物秸秆发酵获得,除基本结构外,还存在糖、醇及氨基酸、核苷酸等物质,多作为肥料或植物生长调节剂使用[5]。从植物营养来看,BFA是一种理想的有机融雪剂原料。为获得理想的融雪性能,BFA需通过一定程度氧化降解,在减小分子量的同时增加结构中的活性基团,再与一些环境友好的无机盐复配,进行简单的分子结构修饰。
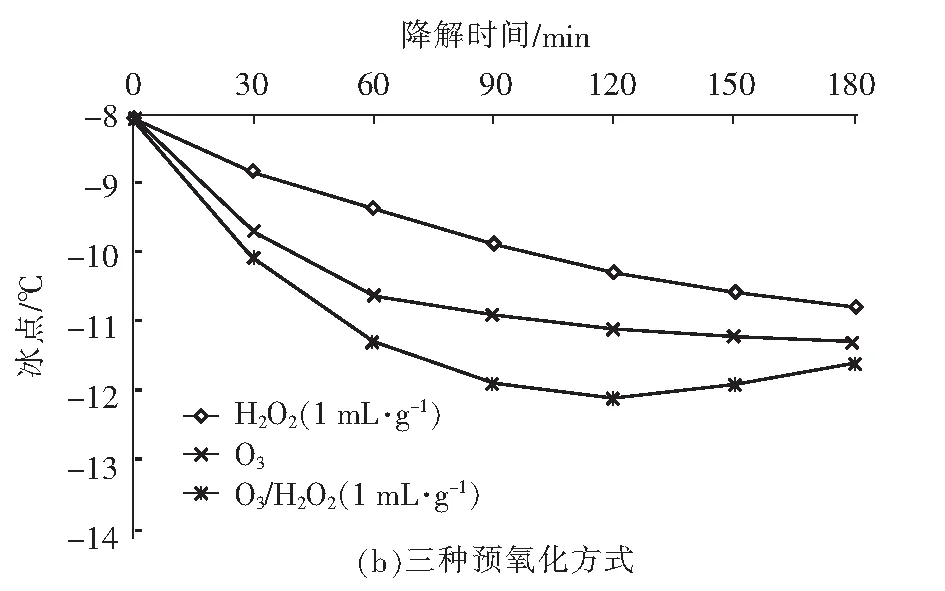
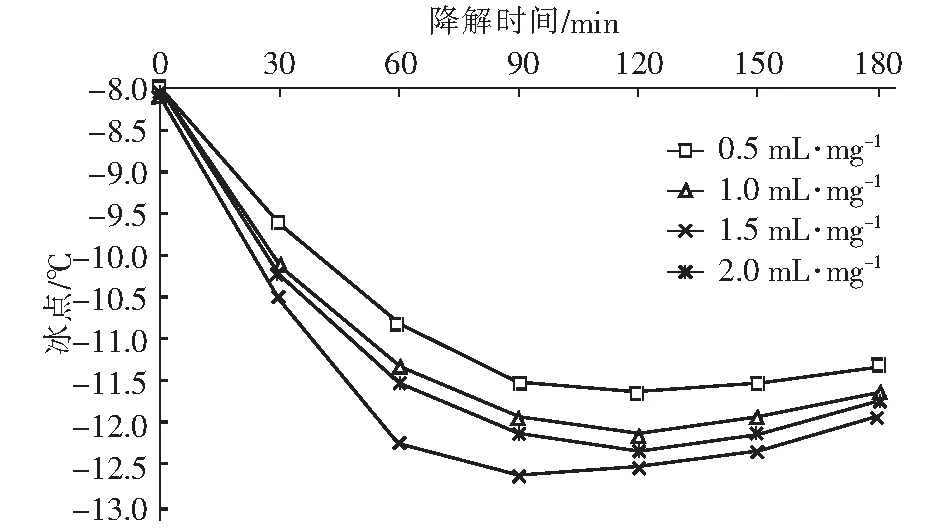
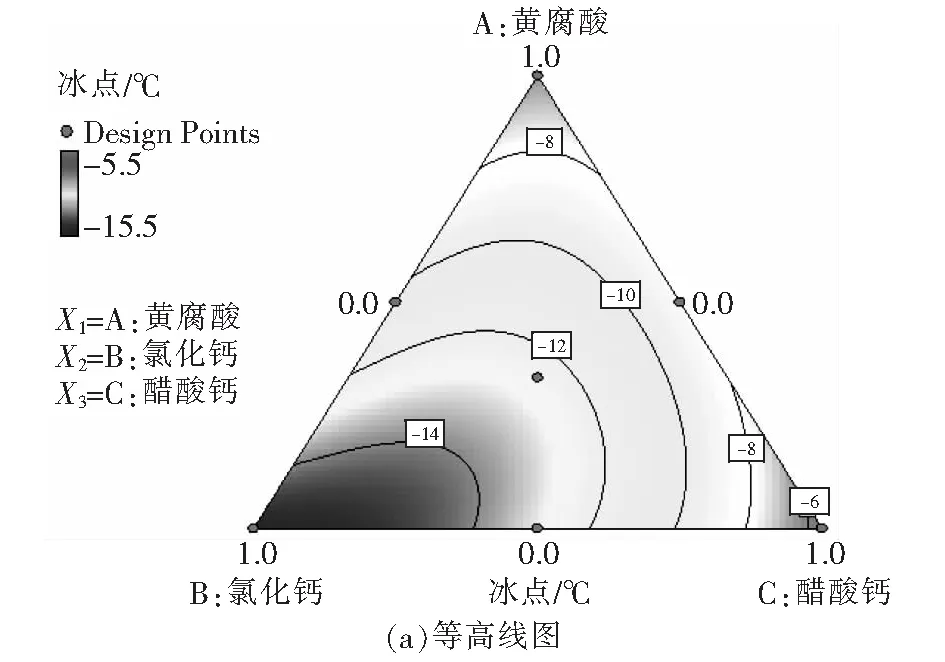
在众多氧化技术中,H2O2和O3因氧化能力强且反应不带入新的杂质而备受关注。Li 等[6]研究发现,O3主要攻击腐殖酸分子结构中的不饱和键,生成酮和酯等不稳定中间产物,再进一步转化成较稳定的有机酸。Wu等[7]研究发现,H2O2可明显促进O3对水中2-甲基异茨醇的氧化降解,与单一O3相比,去除率由38.7%提高到89.2%。蒋艾[8]通过比较H2O2、O3和O3/H2O2对不同取代基团的23种芳香族化合物降解效果得出,三者氧化能力依次为H2O2 课题组前期采用氧化性相对较弱的H2O2对BFA进行预氧化降解,之后与有益改善土壤环境的醋酸钙和氯化钙复配,取得了较理想的融雪性能[9]。但H2O2使用量大且降解时间长。为此,研究尝试采用氧化性较强的O3/H2O2对BFA进行预氧化,以提高BFA结构中含氧酸性基团(疑似降低冰点的活性结构),并基于混料单纯重心设计法优化BFA钙盐复合融雪材料中各原料比例,为获得低成本、环境友好型的BFA基复合融雪材料奠定基础。 BFA由江西省萍乡市乐乐腐殖酸厂提供;醋酸钙、无水氯化钙、双氧水、氢氧化钠、冰醋酸等以上试剂均为分析纯,由天津市福晨化学试剂厂提供。 HCR-240发动机冷却液冰点测定仪、ZO-151小型臭氧发生器、JMD2004型低温恒温反应槽、T-214型分析天平、pHS-3C精密pH计等。 1.3.1 BFA钙盐复合融雪材料的制备 首先称取6 g BFA溶解于100 mL蒸馏水中,用浓度为1 mol/L的氢氧化钠或冰醋酸溶液调节pH值,升温至设定温度,加入设定量H2O2。同时,将稳定运行5 min臭氧发生器产生的臭氧接入反应液,经碘量法测定,发生器产生的O3浓度为60 mg/L,通过转子流量计调整O3流量,开始氧化降解。反应结束后,加入0.5 mol/L Na2S2O3溶液5 mL终止氧化反应,按质量比BAF ∶醋酸钙 ∶氯化钙=1 ∶1 ∶1加入醋酸钙和氯化钙,恒温搅拌1 h。取出复合溶液置于0 ℃±1 ℃低温恒温箱中,0.5 h后测定冰点。 1.3.2 BFA钙盐复合融雪材料的原料配比优化 以BFA、氯化钙及醋酸钙加入质量为考察因素x1、x2和x3,经O3/H2O2在最佳氧化工艺降解后BFA制备的钙盐复合溶液冰点为响应指标y,采用单纯重心设计方法,优化BFA、氯化钙及醋酸钙配比。其中18≥xi≥0且x1+x2+x3=18 g,各考察因素经归一化处理后为X1、X2和X3,X1+X2+X3=1[10]。实验数据采用Design-Expert8.0.6软件进行统计分析。 1.3.3 冰点测定 按照《发动机冷却液的冰点测定》(SH/T 0090—91)测定。 为了考察不同预氧化方法对BFA钙盐复合融雪材料的性能影响,此研究在室温、体系初始pH值为7.0条件下,分别采用30%的H2O2(H2O2与BFA用量比为1 mL/g、1.5 mL/g和3 mL/g)、O3(流量为0.9 L/min)及O3/H2O2(H2O2与BFA的用量比为1 mL/g,O3流量为0.9 L/min)对BFA氧化180 min,降解后BFA制备的钙盐复合溶液冰点变化见图1。 图1 预氧化对降解后BFA制备的钙盐复合物冰点影响Fig.1 Effect of pre oxidation on freezing point of calcium salt complex prepared by degraded BFA 从图1可以看出,三种预氧化方式得到的降解后BFA钙盐复合溶液冰点均达到或接近北京市融雪剂地方性标准(DB11T 161-2012)中,Ⅰ型融雪剂冰点为-10 ℃~-15 ℃的要求。 根据图1(a),采用单一H2O2预氧化降解BFA时,制备的BFA钙盐复合溶液冰点随着降解时间延长而持续下降,且降解前120 min冰点下降较迅速,之后变平缓。此外,H2O2用量越大,制备的BFA钙盐复合溶液冰点越低。但相比1 mL/g H2O2/BFA用量,1.5 mL/g和3 mL/g H2O2/BFA制备的复合溶液冰点相差较小,降解180 min后两者比较接近,约为-11.3 ℃。而此时1 mL/g H2O2/BFA制备的复合溶液冰点也达到了-10.5 ℃左右。 由图1(b)可看出,三种预氧化方式得到的复合溶液冰点随运行时间变化相差较大。其中O3/H2O2降解BFA制备的复合溶液冰点明显低于相同用量的单一O3和H2O2,降解120 min后冰点超过了-12 ℃。与单一H2O2预氧化相比,采用O3及O3/H2O2预氧化,降解前60 min制备的复合溶液冰点下降更迅速,超过60 min后,O3预氧化制备的复合溶液冰点趋于恒定,而O3/H2O2预氧化BFA 120 min后制备的复合溶液冰点开始回升。 具体反应如下: (1) (2) (3) (4) H2O2与O3的总反应为: 2O3+H2O2→2·OH+3O2 (5) H2O2氧化性能低于O3及·OH,体系中又缺乏O3的气流搅拌作用,在浓度较高的BFA溶液中受传质阻力影响较大,氧化反应速率较低,制备的复合溶液冰点持续下降时间较长。而O3选择性攻击C=C、C≡C等不饱和键、破坏BFA中的芳环结构;·OH的氧化反应速率为108~1010[8],存在时间短且氧化性极强,可通过与不饱和键发生环化加成反应将部分BFA成分分解成醛、酮或羧酸等羰基化合物。因此,单一O3和O3/H2O2体系可以通过O3直接氧化以及·OH间接破坏BFA中的芳环结构,来提高结构中含氧酸性基团含量,从而导致复合溶液冰点在较短的降解时间内迅速下降。 又因O3对饱和的脂肪烃作用较弱[12],当体系中BFA降解到一定程度后,再持续加入O3,复合溶液冰点下降微弱。而·OH无选择性,H2O2在溶液中存在时间较长,持续加入的O3可与体系中残余的H2O2继续生成·OH,从而导致体系中一些小分子有机物被彻底矿化成CO2和H2O,致使O3/H2O2降解后期制备的复合溶液冰点回升。 对比图中(a)和(b)还可发现,BFA经加入量为1 mL/g H2O2/BFA的O3/H2O2预氧化90 min后制备的钙盐复合溶液冰点,与加入量3 mL/g的单一H2O2氧化处理120 min相当。因此,采用O3/H2O2预氧化BFA,不仅能获得较好的融雪性能,而且可以大幅度减少H2O2用量和加快预氧化反应进程。 H2O2/O3氧化降解有机物的主要影响因素O3流量、物料与H2O2用量比、反应时间、反应体系初始pH值及温度。其中体系温度升高,反应速率和扩散速率都将增大,但同时也将引起H2O2与O3在溶液中的溶解度下降。此外,高温易引起H2O2分解。为此,研究直接选用室温对BFA进行预氧化。 2.2.1 H2O2加入量考察 在室温、pH值为7.0的条件下,O3流量为0.9 L/min对BFA进行预氧化,不同H2O2用量对O3/H2O2预氧化后BFA制备的钙盐复合溶液冰点影响随氧化时间变化见图2。 图2 H2O2加入量对O3/H2O2预氧化后BFA钙盐复合溶液的冰点影响Fig.2 Effect of H2O2 addition on freezing point of BFA calcium salt composite solution after O3/H2O2 preoxidation 从图2可以看出,O3/H2O2降解BFA 初期制备的钙盐复合溶液冰点下降迅速。90 min时制备的复合溶液冰点大小依次为0.5 mL/mgH2O2/BFA体系>1.0 mL/mg H2O2/BFA体系>2.0 mL/mg H2O2/BFA体系>1.5 mL/mg H2O2/BFA体系。这是因为在一定浓度范围内,体系中H2O2量越大,引发自身和O3分解产生·OH的量越大,BFA降解越迅速,表现为复合溶液冰点下降速率越快。但体系中过量的·OH不仅自身会发生淬灭,还可能被H2O2捕获,引起自由基淬灭失活(详细见式(6)和式(7))[13],·OH和过量的H2O2彼此消耗,没能充分发挥氧化作用,从而导致1.5 mL/mg H2O2/BFA降解制备的复合液冰点下降程度高于2.0 mL/mg H2O2/BFA体系。 4·OH→2H2O+O2↑ (6) H2O2+2·OH→2H2O+O2↑ (7) 降解超过90 min后,不同H2O2用量O3/H2O2预氧化BFA制备的复合液冰点均随反应时间延长出现了升高现象,说明体系中BFA降解产生的有机小分子出现了不同程度矿化。其中0.5 mL/mg H2O2/BFA体系冰点变化最平缓,1.5 mL/mg H2O2O3/BFA体系冰点升高最为显著。分析认为,当H2O2加入量较低时,体系中的H2O2因与O3反应被快速消耗殆尽,后续加入O3生成·OH的量较少,体系中有机小分子矿化程度较低。而H2O2加入量增大后,降解后期体系内仍残留有一定量H2O2、且有机小分子积累较多,矿化严重。 因此,从经济性及融雪性能两方面考虑,O3/H2O2预氧化降解BFA选用H2O2加入量为1.0 mL/mg H2O2/BFA,反应时间控制在90 min之内。 2.2.2 O3流量考察 在室温、pH值为7.0的条件下,H2O2与BFA用量比为1 mL/g,氧化降解时间90 min,加入O3流量对降解后BFA制备的钙盐复合溶液冰点影响见图3。 图3 O3流量对降解后BFA钙盐复合溶液冰点的影响Fig.3 Effect of O3 flow rate on freezing point of BFA calcium salt composite solution after degradation 由图3可以看出,O3/H2O2降解BFA制备的钙盐复合溶液冰点随着O3流量的增大经历了先降低后升高的变化。根据H2O2引发O3分解产生·OH反应式(5),在一定范围内O3流量增大,体系中O3含量越高,·OH产生量越多,越有利于BFA氧化降解。但体系中·OH过量会导致BFA降解产生的部分有机小分子继续矿化成CO2和H2O。另外,O3流量过大,反应体系的气流搅拌过强,也会降低O3的溶解度。这都可能导致制备的复合溶液冰点回升。 由试验结果初步确定,采用0.9 L/min O3流量、1.0 mL/mg H2O2/BFA的O3/H2O2预氧化降解BFA比较理想。 2.2.3 体系初始pH值考察 室温,H2O2与BFA用量比1 mL/g,O3流量0.9 L/min,氧化降解时间90 min,体系初始pH值对降解后BFA制备的钙盐复合溶液冰点影响见图4。 图4 初始pH值对预氧化后BFA钙盐复合溶液冰点的影响Fig.4 Effect of initial pH value on freezing point of BFA calcium salt composite solution after pre-oxidation 试验结果确定,采用O3/H2O2预氧化BFA制备钙盐复合融雪材料的最适初始pH值为8.0。 采用单纯形重心设计法优化BFA钙盐复合融雪材料中的原料配比,试验结果如表2。 表2 单纯重心设计试验结果Tab.2 Test results of simple center of gravity design 表2中试验数据经Design-Expert8.0.6软件处理得回归方程: y=-6.5X1-15.5X2-5.5X3+2X1X2-10X1X3-10X2X3-36X1X2X3 (8) 进一步绘制等高线图及响应曲面图见图5。 图5 BFA钙盐复合融雪材料中原料配比的等高线图及响应曲面图Fig.5 Contour diagram and response surface diagram of raw material ratio in BFA calcium salt composite snow melting material 根据图5(a)中等高线图可以直观地了解BFA、氯化钙及醋酸钙三者用量及其交互作用对降解后BFA制备的钙盐复合液冰点影响。图5(a)中等高线为椭圆形,说明各因素间的交互作用比较强,三者用量配比对复合液冰点影响显著,且复合液冰点受氯化钙含量影响最大,并随其增加而降低。对应的响应曲面(图5(b))呈马蹄形,说明在试验因素的取值区间范围内存在极值。 考虑到融雪材料中存在大量Cl-将造成环境破坏,而醋酸钙原料成本较高,从环保性和经济性两方面考虑,将氯化钙含量X2和醋酸钙含量X3取值范围控制在0.4以内。经Design-Expert8.0.6软件处理,在该取值范围内可获得的复合溶液最低冰点预测值为-12.96 ℃,此时BFA、氯化钙及醋酸钙三种原料的质量比约为3 ∶4 ∶3。 基于BFA的O3/H2O2最佳预氧化工艺及最佳原料配比制备BFA钙盐复合融雪材料,重复三次,降解后制备的BFA钙盐复合溶液冰点分别为-13.47 ℃、-13.14 ℃和-12.92 ℃,RSD为1.49%。RSD<2.0%,说明制备工艺比较稳定。三次制备的复合溶液平均冰点值为-13.18 ℃,与预测值的相对偏差为1.68%,说明回归方程得到的预测值与实际值基本相符。 文章针对BFA钙盐复合融雪材料制备中BFA预氧化及原料配比进行了系统研究。结果发现,相比使用单一H2O2,采用O3/H2O2预氧化处理BFA制备的钙盐复合溶液,不仅获得较好的融雪化冰性能,而且可以大幅度减少H2O2用量和加快反应进程。其预氧化最佳工艺为O3流量0.9 L/min、H2O2与BFA用量比1.0 mL/mg、系统初始pH值8.0,反应时间90 min,降解后BFA制备的钙盐复合融雪材料冰点接近-13 ℃。 通过单纯形重心设计法优化BFA钙盐复合融雪材料的原料配比时发现,三种原料用量对降解后BFA制备钙盐复合液冰点影响显著,其中氯化钙用量越大,冰点越低。结合环保性和经济性两方面考虑,最终确定BFA、氯化钙及醋酸钙三种原料的质量比为3 ∶4 ∶3。 基于BFA的O3/H2O2最佳预氧化工艺及最佳原料配比制备BFA钙盐复合融雪材料,冰点值超过了-13 ℃,且制备工艺稳定,融雪性能上达到北京市融雪剂地方性标准Ⅰ型融雪剂要求。1 试验材料与方法
1.1 主要原料及试剂
1.2 主要仪器
1.3 试验方法
2 试验结果与讨论
2.1 不同预氧化方法对BFA钙盐复合融雪材料的融雪性能影响研究

2.2 BFA的H2O2/O3预氧化工艺研究



2.3 制备BFA钙盐复合融雪材料的原料配比研究


3 结论
