龙眼乙烯合成途径基因鉴定及响应ACC处理的分析
2022-03-04赖春旺周小娟陈燕刘梦雨薛晓东肖学宸林文忠赖钟雄林玉玲
赖春旺,周小娟,陈燕,刘梦雨,薛晓东,肖学宸,林文忠,赖钟雄,林玉玲
龙眼乙烯合成途径基因鉴定及响应ACC处理的分析
赖春旺1,周小娟2,陈燕1,刘梦雨1,薛晓东1,肖学宸1,林文忠3,赖钟雄1,林玉玲1*
1福建农林大学园艺植物生物工程研究所,福州 350002;2江西省赣州市农业农村局,江西赣州 341000;3泉州市农业科学研究所,福建泉州 362000
【目的】S-腺苷甲硫氨酸合成酶(SAMS)、1-氨基环丙烷-1-羧酸合成酶(ACS)和1-氨基环丙烷-1-羧酸氧化酶(ACO)是植物合成乙烯的3个关键酶,从全基因组水平鉴定龙眼SAMS、ACS和ACO(DlSAMS、DlACS和DlACO)基因家族,并进行生物信息学、体细胞胚早期不同阶段及不同浓度1-氨基环丙烷-1-羧酸(ACC)和不同处理时间下龙眼胚性愈伤组织的表达模式分析,为进一步研究和利用DlSAMS、DlACS和DlACO基因家族奠定基础。【方法】从拟南芥数据库(TAIR)下载SAMS、ACS和ACO家族蛋白质序列作为参考序列,TBtools、NCBI Blast等工具搜索龙眼基因组数据库,鉴定DlSAMS、DlACS和DlACO基因家族。使用ExPASy、PrediSi、TMHMM Server 2.0、NetPhos 3.1 Server、Plant-PLoc、MEME、PlantCARE、STRING、TBtools等软件和在线工具预测DlSAMS、DlACS和DlACO家族成员蛋白质基本理化性质、保守基序(Motif)与互作关系,定位染色体,分析基因共线性与选择压力、基因结构及启动子顺式作用元件;Clustal W和MEGA-X软件对龙眼、拟南芥、番茄、水稻和玉米的SAMS、ACS和ACO家族成员蛋白质序列分别进行多序列比对、构建系统进化树;根据龙眼转录组数据库的FPKM值,应用TBtools软件绘制DlSAMS、DlACS和DlACO家族成员在体细胞胚早期不同阶段的表达热图;采用qRT-PCR法分析不同浓度ACC和不同处理时间下龙眼胚性愈伤组织DlSAMS、DlACS和DlACO家族成员的表达情况。【结果】龙眼第三代基因组中分别鉴定获得SAMS、ACS和ACO家族成员4个、11个和4个,在家族成员数量上与拟南芥、番茄等物种差异不大。DlSAMS家族成员最保守,所有成员的Motif相同;DlACS和DlACO家族成员也含有较多保守的Motif。3个家族共19个成员分布在11条染色体上,有6对共线性基因,与拟南芥有30对共线性基因,均受纯化选择作用。3个家族的成员均含有大量光、激素和逆境响应元件。家族成员内部的蛋白互作关系较弱,但家族成员之间互作关系非常紧密。多物种系统进化关系表明,SAMS、ACS和ACO家族均可分为3个亚家族,DlSAMS家族成员仅分布在SAMS-Ⅰ和SAMS-Ⅱ中,SAMS-Ⅲ可能为单子叶植物所特有;DlACS和DlACO家族成员在3个亚族中均有分布,且分布较为均匀;DlSAMS、DlACS和DlACO均与番茄和拟南芥的SAMS、ACS和ACO亲缘关系较近。对转录组FPKM值的分析表明,DlSAMS家族的所有成员以及在体细胞胚早期的3个阶段均高表达,可能在体细胞胚发生过程发挥着重要作用;和在球形胚阶段高表达,可能与球形胚的形成密切相关。在胚性愈伤组织继代培养基中添加不同浓度的ACC能显著影响龙眼胚性愈伤组织的增殖量及DlSAMS、DlACS和DlACO家族成员的表达。培养20 d时,主要表现为基因的上调表达,且ACC浓度越高,上调越明显;在25—35 d则主要表现为基因的下调表达。但是在20 d时,0.01 mmol∙L-1ACC处理的基因主要表现为下调表达,这可能是导致其增殖量显著大于对照的原因。【结论】龙眼第三代基因组中分别有SAMS、ACS和ACO家族成员4个、11个和4个,在进化过程中的保守性均较高,且包含大量激素和逆境响应元件;3个家族成员对龙眼体细胞胚胎的发生起重要调控作用,0.01 mmol∙L-1ACC处理可能通过调控DlSAMS、DlACS和DlACO家族成员的表达促进龙眼胚性愈伤组织增殖。
龙眼;SAMS;ACS;ACO;基因家族;表达分析
0 引言
【研究意义】龙眼(Lour.)在我国有悠久的栽培史,具有很高的食用和药用价值[1],但是巨大的果核严重影响其可食率。乙烯(ethylene,ETH)在植物种子形成过程中扮演着重要角色[2]。S-腺苷甲硫氨酸合成酶(s-adenosylmethionine synthetase,SAMS)、1-氨基环丙烷-1-羧酸合成酶(1-aminocyclopropane-1-carboxylic acid synthetase,ACS)和1-氨基环丙烷-1-羧酸氧化酶(1- aminocyclopropane-1-carboxylic acid oxidase,ACO)是植物合成ETH的3大关键酶,从全基因组水平鉴定龙眼SAMS、ACS和ACO(DlSAMS、DlACS和DlACO)基因家族,并进行生物信息学、体细胞胚早期不同阶段及不同浓度1-氨基环丙烷-1-羧酸(1- aminocyclopropane-1-carboxylic acid,ACC)和不同处理时间下龙眼胚性愈伤组织阶段(embryonic callus stage,EC)的表达模式分析,可进一步探究SAMS、ACS和ACO家族基因在植物生长发育过程中的作用。【前人研究进展】在植物体内,ETH的生物合成过程为:甲硫氨酸(methionine,Met)在SAMS的作用下合成S-腺苷甲硫氨酸(s- adenosylmethionine,SAM),SAM被ACS羧化成ACC,最后ACC被ACO氧化生成ETH。植物体中SAM除了参与ETH的生物合成外,还参与烟酰胺和多胺、蛋氨酸代谢途径、转甲基化、转硫途径[3->4]、木质素等生物合成途径[5]和对环境胁迫的响应[6]。SAM还是核酸、蛋白质、磷脂和小分子甲基化时主要的甲基基团供体[7]。ACS被看作ETH生物合成途径的关键酶和限速酶。近年来,番茄()中有9个被报道[8-9]。在拟南芥中也包括众多的同工酶基因[10]。ACO是高等植物中ETH生物合成途径的最后1个酶[9]。KLEE等[8]从番茄中分离出,发现通过调控的表达可以改变番茄果实的成熟时期。佟少明等[11]过表达葡萄中分离的缩短了转基因番茄的营养生长期。在龙眼中,李惠华等[12-13]克隆了ACS和ACO家族的1个成员,并发现其在龙眼体细胞胚胎不同阶段差异表达,提示和在体胚发生进程中发挥重要作用。【本研究切入点】目前,SAMS、ACS和ACO家族成员在拟南芥[14-15]、番茄[16]、葡萄[11]、南瓜[17]等多种物种中被鉴定,并发现其功能具有多样性。但是关于DlSAMS、DlACS和DlACO家族的全基因组鉴定却未见报道。龙眼第3代基因组数据库与转录组数据库的建立[18-19]为研究DlSAMS、DlACS和DlACO家族的功能及相互作用关系奠定了坚实基础。【拟解决的关键问题】本研究拟应用生物信息学方法鉴定DlSAMS、DlACS和DlACO基因家族,分析DlSAMS、DlACS和DlACO家族成员在EC、不完全胚性紧实结构阶段(incomplete compact proembryogenic cultures stage,ICpEC)和球形胚阶段(globular embryo stage,GE)的表达热图;并利用实时荧光定量PCR技术(real-time fluorescence quantitative PCR,qRT-PCR)分析不同浓度ACC和不同处理时间下龙眼EC DlSAMS、DlACS和DlACO家族成员的表达情况。
1 材料与方法
试验于2019—2020年在福建农林大学园艺植物生物工程研究所进行。
1.1 材料
试验材料为‘红核子’龙眼(Lour. Honghezi)诱导的胚性愈伤组织(EC),参照赖钟雄等[20]的培养方法获得。在龙眼EC继代培养基“MS+2, 4-D 1.0 mg∙L-1+蔗糖20 g∙L-1+琼脂7 g∙L-1”中分别添加0.01、0.1和0.5 mmol∙L-1的ACC,以在继代培养基中添加等体积的蒸馏水为对照,接种于培养皿的3个位置,呈三角形,总接种量为0.1 g。分别在20、25、30和35 d取样,液氮速冻后于-80℃超低温冰箱保存。每种培养基接种20个培养皿,试验进行3次重复。
1.2 DlSAMS、DlACS和DlACO家族成员的鉴定及命名
龙眼第3代高质量基因组数据存储于福建农林大学园艺植物生物工程研究所(数据待发表),以拟南芥SAMS、ACS和ACO家族的蛋白质序列为参考序列,与龙眼基因组数据在TBtools软件进行同源比对,再经NCBI Blast去除重复序列,结合Web CD-Search Tool(https://www.ncbi.nlm. nih.gov/Structure/bwrpsb/ bwrpsb.cgi)对蛋白质保守结构域和基因功能进行预测,再利用DNAMAN 6.0对候选序列的编码序列(coding sequence,CDS)和氨基酸序列进行多序列比对,根据它们是否具有相应的保守结构域、完整的开放阅读框以及序列之间的Identity,最终确定龙眼全基因组范围内SAMS、ACS和ACO基因家族成员的数量。参考拟南芥SAMS、ACS和ACO家族成员的命名对DlSAMS、DlACS和DlACO家族成员进行命名。
1.3 DlSAMS、DlACS和DlACO家族成员的理化性质及结构分析
对DlSAMS、DlACS和DlACO家族蛋白质进行理化性质分析。利用ExPASy(https://www.expasy.org/)对蛋白质等电点(isoelectric point,PI)、分子量(molecular weight,MW)、氨基酸数目(number of amino acids,AA)、不稳定性指数(Instability index,II)、脂肪指数(Aliphatic index,AI)和亲水性(Hydropathicity)进行分析;对蛋白质信号肽、跨膜结构域、磷酸化位点数目和亚细胞定位的预测分别采用PrediSi(https:// www.predisi.de/)、TMHMM Server2.0(https://www.cbs. dtu.dk/ services/TMHMM/)、NetPhos3.1Server(http:// www.cbs.dtu.dk/services/NetPhos/)和Plant-PLoc(http:// www.csbio.sjtu.edu.cn/bioinf/plant/)进行分析,利用MEME(https://meme-suite.org/meme/tools/meme)对DlSAMS、DlACS和DlACO家族蛋白质进行保守基序Motif分析,利用PlantCARE(http://bioinformatics.psb. ugent.be/webtools/plantcare/html/)对DlSAMS、DlACS和DlACO家族成员的启动子进行顺式作用元件分析,启动子范围为基因5′端上游的2 000 bp。TBtools软件对基因结构、蛋白质保守结构域和保守Motif进行可视化。
1.4 DlSAMS、DlACS和DlACO家族蛋白质互作网络预测分析
对DlSAMS、DlACS和DlACO家族蛋白质互作关系的预测在STRING(https://string-db.org)上进行,以拟南芥为参考,要求交互评分选择High confidence(0.700),探究其相互作用。
1.5 DlSAMS、DlACS和DlACO家族共线性与选择压力分析
使用MCScanX软件分析DlSAMS、DlACS和DlACO家族共线性,标出具有共线性的基因,利用TBtools软件进行可视化;并对共线性基因的同义替换(synonymous site,Ka)、非同义替换(nonsynonymous site,Ks)进行计算,推测SAMS、ACS和ACO家族成员在进化过程中的自然选择压力。
1.6 DlSAMS、DlACS和DlACO家族成员进化树的构建
拟南芥()蛋白质序列下载于TAIR(http://arabidopsis.org),番茄()、玉米(L.)和水稻(L.)的蛋白质序列均下载于NCBI(https://www.ncbi. nlm.nih.gov/)。通过ClustalW对SAMS、ACS和ACO家族成员分别进行多序列比对,采用MEGA-X软件构建Booststrap为1 000次的系统进化树。iTOL(https://itol.embl.de/)对系统进化树进行美化。
1.7 DlSAMS、DlACS和DlACO家族成员在体细胞胚早期不同阶段的表达分析
从龙眼转录组数据库中获取DlSAMS、DlACS和DlACO家族成员在体细胞胚早期不同阶段3个生物学重复的FPKM值,利用TBtools软件绘制热图。选取在3个阶段表达模式不一致的成员用于分析ACC处理下的表达情况。最终在DlSAMS家族选取、和,DlACS家族选取和,DlACO家族选取。
1.8 ACC处理对龙眼EC生长量及ETH释放量的影响分析
分别在20、25、30和35 d进行取样,各处理的生长量采用分析天平测定,ETH释放量采用ETH气体检测系统ETD-300(Sensor Sense,荷兰)测定,取各处理样品1.0 g,采用“积累测定(stop and flow)”的方法,积累时间60 min,测定时间15 min,气体流速3.00 L∙h-1。
1.9 ACC处理下DlSAMS、DlACS和DlACO家族成员表达情况分析
采用TransZol Up(Transgen)提取上述龙眼材料总RNA,再使用PrimeScript™ IV 1st Strand cDNA Synthesis Mix试剂盒(TaKaRa)进行逆转录合成cDNA,稀释10倍后用于qRT-PCR。使用DNAMAN软件设计qRT-PCR引物(表1),qRT-PCR反应体系及方法参考Hieff®qPCR SYBR®Green Master Mix试剂盒(Yeasen),于Roche Light Cycler 480 qRT-PCR仪中检测不同时间及不同浓度ACC处理下DlSAMS、DlACS和DlACO家族成员的表达情况。qRT-PCR程序为:95℃预变性30 s,95℃变性10 s,60℃退火30 s,72℃延伸15 s,40个循环。以(EU330204)为内参基因[21],采用2-△△Ct法计算基因相对表达量。
2 结果
2.1 DlSAMS、DlACS和DlACO家族的成员鉴定及蛋白质理化性质的分析
在龙眼基因组水平分别筛选出SAMS、ACS和ACO家族成员4个、11个和4个。对DlSAMS、DlACS和DlACO家族蛋白质的理化性质分析见表2。
SAMS、ACS和ACO都是多基因家族。DlSAMS家族成员氨基酸数量在389—393 AA,蛋白质分子量在42.63—43.17 kD;平均PI为5.72,属于弱酸性蛋白质;平均脂肪指数80.95,不稳定性指数在23.05—28.73,gravy值均为负数,即属于稳定的亲水性蛋白质;该家族成员均定位在叶绿体上,不含信号肽和跨膜结构域;平均磷酸化位点数为34.5,以苏氨酸磷酸化位点为主,约占总磷酸化位点的50%,其次是丝氨酸磷酸化位点,络氨酸磷酸化位点数最少。

表1 qRT-PCR引物序列及目的片段长度
对DlACS家族蛋白质理化性质的分析表明,该家族成员的氨基酸数量在378—628 AA,除DlACS12C外,该家族蛋白质在氨基酸数量上均大于DlSAMS家族,平均序列长度为486.3 AA,蛋白质分子量在41.75—69.74 kD;PI在4.95—9.31、平均PI为7.04,其中PI≥8的蛋白质有DlACS8A和DlACS12B,PI≤6的蛋白质有DlACS6B和DlACS12C;不稳定性指数在42.26—58.90,属于不稳定性蛋白质;平均脂肪指数为84.77;除DlACS12C外,其余蛋白质的gravy值均为负数,具有亲水性;只有DlACS10和DlACS12A含有1个跨膜结构域,其余蛋白质均不含跨膜结构域;所有成员均不含信号肽,分布在叶绿体、细胞核和质膜中,其中DlACS8B和DlACS9定位在细胞核中,DlACS6B和DlACS12C定位在质膜,其余成员定位在叶绿体中。磷酸化位点数在26—86,均值为47.32,其中丝氨酸磷酸化位点数最多,占总位点数的52%以上,其次是苏氨酸磷酸化位点,络氨酸磷酸化位点最少。
对DlACO家族理化性质的研究表明,该家族蛋白质是本研究3个家族中蛋白质序列最短的1个,平均序列长度仅为314.39 AA,蛋白质分子量在34.94—36.16 kD;PI在4.98—6.17,表明该家族蛋白质与SAMS家族一样,也属于弱酸性蛋白质;从不稳定指数看,除了DlACO1,其他蛋白质均为稳定蛋白质;平均脂肪指数为82.93;gravy值均为负值,为亲水性蛋白质;该家族成员均没有信号肽和跨膜结构域,其中DlACO1和DlACO4A定位在细胞质中,DlACO4B和DlACO5定位在叶绿体中;平均磷酸化位点数为21.5,以丝氨酸磷酸化位点为主。
2.2 DlSAMS、DlACS和DlACO家族成员染色体定位、共线性及选择压力分析
染色体定位分析发现DlSAMS、DlACS和DlACO家族19个成员共定位在11条染色体上(图1)。DlSAMS家族的4个成员分别定位在Chr1、Chr5、Chr12和Chr14号染色体上。DlACS家族成员定位在7条染色体上,其中Chr1、Chr3、Chr5和Chr6号染色体上分别有1个成员,Chr7和Chr9号染色体上分别有2个成员,Chr15号染色体上定位的成员最多,有3个。DlACO家族的4个成员分别定位在Chr1、Chr6、Chr10和Chr13号染色体上。从染色体定位中发现,DlACS家族中的与,与分别定位在Chr7和Chr15号染色体的连续位置,可能是基因的串联重复。
为探究DlSAMS、DlACS和DlACO家族成员的共线性情况及在进化过程中的自然选择压力形式,对家族成员进行共线性分析,并对基因Ka、Ks的比率进行计算。共线性分析结果显示(图1、2):龙眼种内共有6对基因具有共线性关系。其中DlSAMS家族2对,分别为×(Ka/Ks=0.02)和×(Ka/Ks=0.02);DlACS家族中有3对,分别为×(Ka/Ks=0.10)、×9(Ka/Ks=0.10)和×(Ka/Ks=0.17);DlACO家族中1对,为×(Ka/Ks=0.09)。而与拟南芥具有30对共线性基因,其中DlSAMS家族有5对,DlACS家族中有18对,DlACO家族中有7对。所有共线性基因的Ka与Ks比值均小于1,表明DlSAMS、DlACS和DlACO家族的同源基因在进化过程中主要受纯化选择作用。
表2 DlSAMS、DlACS和DlACO家族蛋白质理化性质
Table 2 Protein physicochemical properties of DlSAMS, DlACS and DlACO families
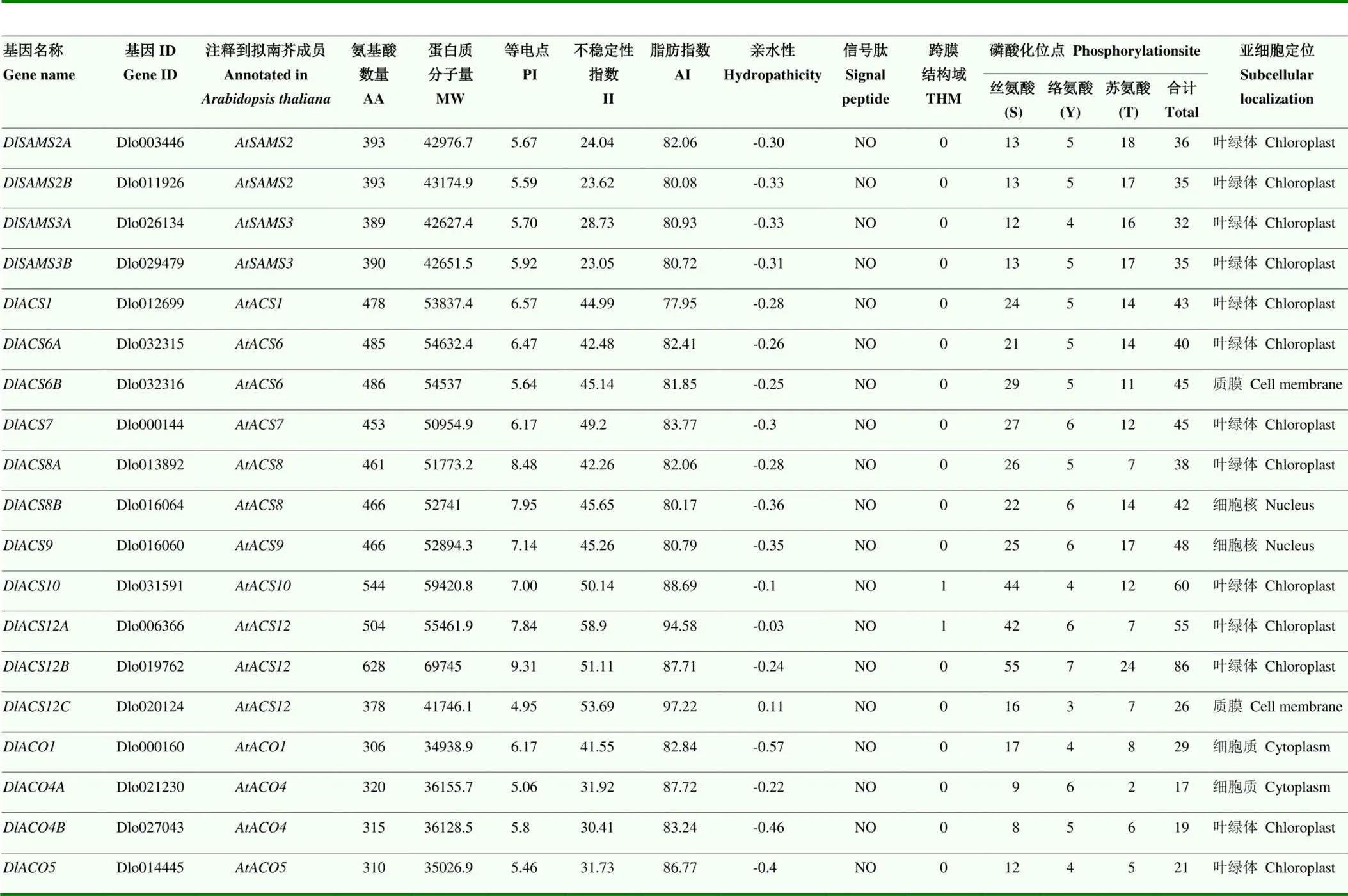
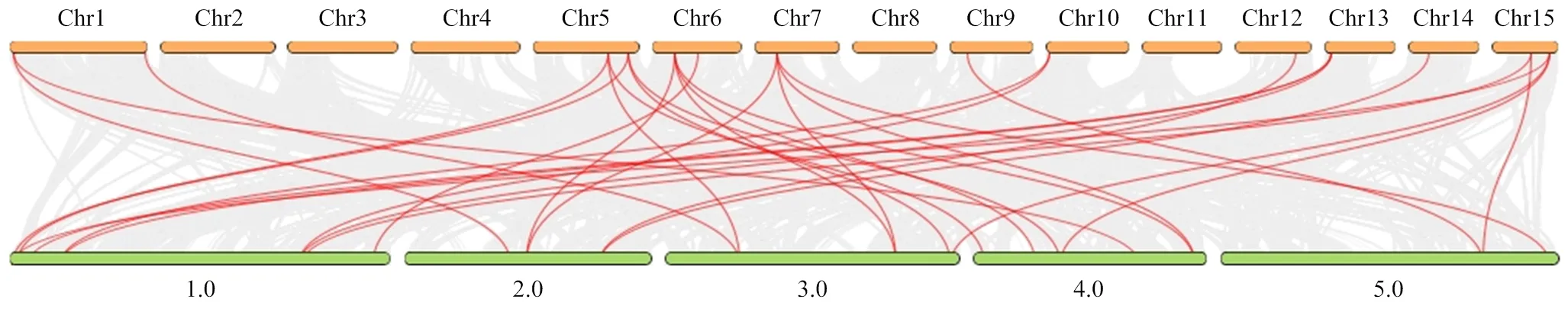
图2 拟南芥和龙眼SAMS、ACS和ACO基因共线性分析
2.3 DlSAMS、DlACS和DlACO基因结构和蛋白质保守Motif分析
为进一步了解DlSAMS、DlACS和DlACO基因结构和功能特征,对家族成员的保守Motif进行分析(图3-A)。DlSAMS家族最保守,所有成员含有相同的Motif,包括:Motif 7、8、9、10、12、13、15、17、26、27和36。DlACO家族成员都具有Motif 8、14、18、20、23和35,有3个成员有Motif 28,也较为保守,拥有Motif 29、38、44和45的仅一两个成员。DlACS家族中Motif 1、2、3、4、7和11最为保守,所有成员均含有;Motif 5、6、16、21、25和30较为保守,有9—10个成员拥有。DlSAMS和DlACS家族都具有Motif 7,DlSAMS和DlACO家族都具有Motif 8。家族成员中的Motif可用于辅助亚家族分类,如Motif 19、22、38、40、41和42仅属于ACS-Ⅰ;Motif 31、33、34和37属于ACS-Ⅱ;Motif 24、32和45仅属于ACS-Ⅲ。
对3个家族成员进行内含子、外显子数目和位置的分析(图3-B)。DlSAMS家族中只有具有完整的基因结构,其余3个成员仅含有1个CDS。DlACS家族中、、、和具有完整的基因结构,只有3′端的UTR,其余5个成员仅含有CDS。DlACS成员含有3—5个CDS,以含4个CDS为主。DlACO家族中、和拥有完整的基因结构,只有3个CDS。
利用NCBI在线工具Web CD-Search Tool对蛋白质保守结构域进行分析(图3-C),DlSAMS、DlACS和DlACO家族所有成员均只含有1个保守结构域。DlSAMS家族为PLN02243;DlACS家族含有2种类型的结构域:PLN02607(仅DlACS7)和PLN02450(其他10个成员);DlACO家族成员也具有两类保守结构域:PLN02430(DlACO1)和PLN02299(其他3个成员)。

A:保守Motif分布;B:基因结构;C:蛋白质保守结构域A: Conservative motif distribution; B: Gene structure; C: Protein conservative domain
2.4 DlSAMS、DlACS和DlACO成员启动子顺式作用元件分析
启动子顺式作用元件对基因的表达有重要的调控作用。对DlSAMS、DlACS和DlACO家族成员启动子顺式作用元件的分析见图4。DlSAMS家族成员响应的元件有19种,3个成员响应的元件有ABA、anaerobic、MeJA和zein metabolism;2个成员响应的元件包括auxin、drought、low-temperature、meristem expression、SA、protein和MYBHv1结合位点,还含有GA、alpha-amylase、ATBP-1、cell cycle、defense and stress的作用元件。DlACS家族中除alpha-amylase和endosperm negative元件没有成员响应外,其余元件均有成员响应。该家族所有成员均响应drought元件;ABA、anaerobic和MeJA元件在DlACS家族也有较多成员响应,仅含有响应auxin的元件,还含有类黄酮生产的元件。DlACO家族的4个成员中仅有16种响应元件,ABA、anaerobic、auxin和SA元件有3个成员响应,drought和zein metabolism元件有2个成员响应。
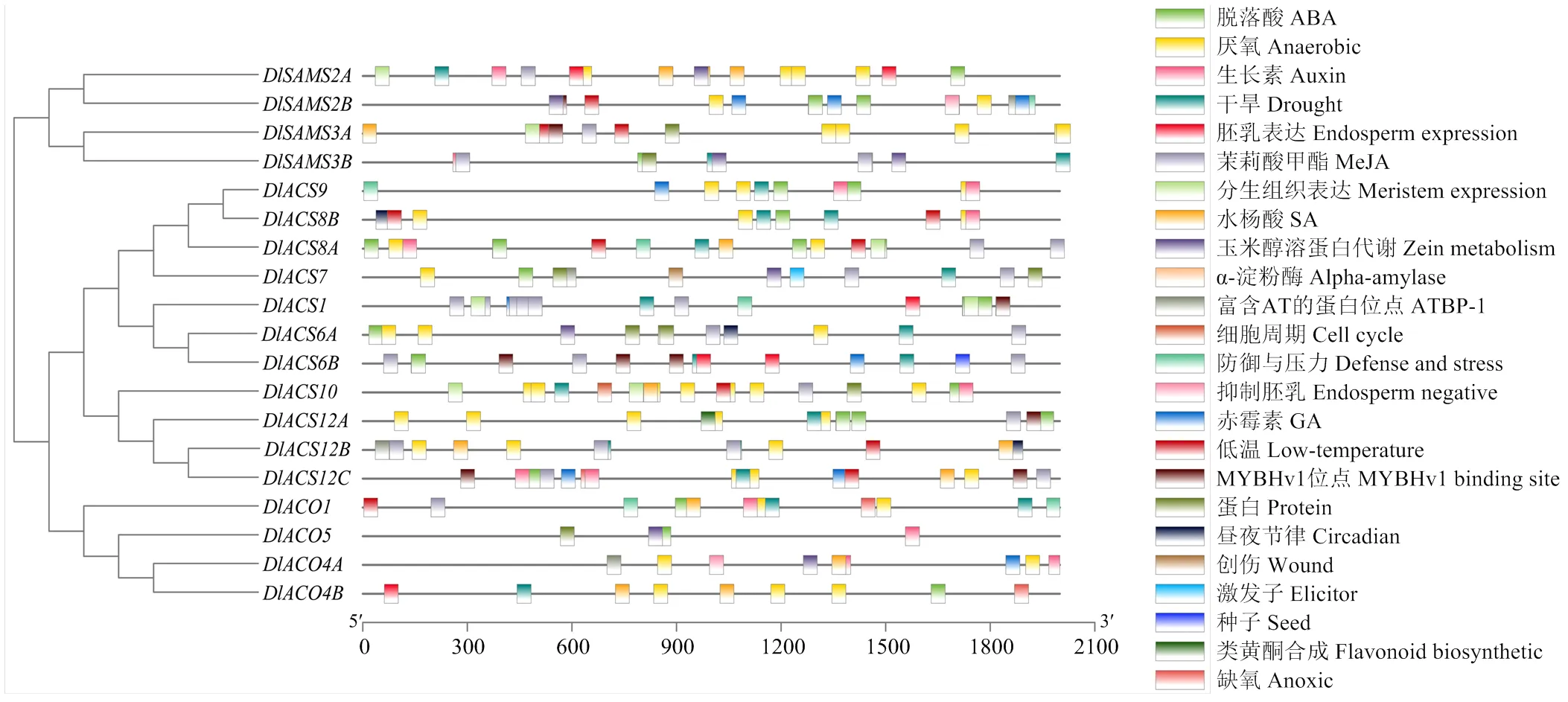
图4 DlSAMS、DlACS和DlACO家族顺式作用元件的分布
DlSAMS、DlACS和DlACO家族成员存在大量光响应元件(占总元件数的28.13%—80%),以及多种激素和逆境胁迫的响应元件。相同家族不同成员拥有作用元件的种类和数目有所不同,反映了成员间功能的多样性。
2.5 DlSAMS、DlACS和DlACO家族成员蛋白质互作网络分析
为了解DlSAMS、DlACS和DlACO家族蛋白质的互作关系,将DlSAMS、DlACS和DlACO家族成员的蛋白质序列分别输入STRING在线工具,选用模式植物拟南芥进行蛋白质互作预测(图5-A—C)。SAMS和ACO家族内的成员不存在蛋白质互作关系。ACS家族成员的蛋白质互作关系也不强,ACS7和ACS8均只与ACS4互作;ACS1、ACS2和ACS6两两互作;ACS4和ACS6也存在互作。但是3个家族蛋白质之间存在复杂的互作关系(图5-D),其中ACS家族与ACO家族之间的互作关系最多,有50对;ACS家族与SAMS家族之间的互作关系次之,有38对;SAMS家族蛋白质与ACO家族蛋白质的互作关系最少,仅3对。存在10对及以上互作关系的蛋白质占总蛋白质数的65%,存在9对互作关系的蛋白质占总蛋白质数的25%,与ACS10互作的蛋白质最少,但也有3个。以上结果充分证明SAMS、ACS和ACO三个家族蛋白质成员之间存在紧密的互作关系。
2.6 DlSAMS、DlACS和DlACO家族系统进化树分析
为进一步分析DlSAMS、DlACS和DlACO家族成员的系统进化关系,构建了龙眼、拟南芥、番茄、水稻和玉米的SAMS、ACS和ACO家族系统进化树(图6)。SAMS、ACS和ACO家族均可分成3个亚家族。SAMS家族系统进化树由19条序列组成,其中龙眼、拟南芥、番茄和玉米均为4条,水稻3条。龙眼、拟南芥和番茄的12个成员均只出现在SAMS-Ⅰ和SAMS-Ⅱ,且分布均匀;SAMS-Ⅲ可能为单子叶植物所特有,仅包含水稻和玉米的SAMS家族成员。ACS家族系统进化树由39条序列组成,龙眼、拟南芥、番茄均为11条,水稻4条,玉米2条。ACS-Ⅰ由9个成员组成,ACS-Ⅱ由14个成员组成,相对来说ACS-Ⅲ成员数最多,为16个。拟南芥ACS家族成员主要分布在ACS-Ⅲ中,番茄的ACS家族成员主要分布在ACS-Ⅱ和ACS-Ⅲ中,DlACS家族成员在3个亚家族中的分布较为均匀。ACO家族系统进化树由21条序列组成,龙眼4条,拟南芥5条,番茄6条,以及水稻和玉米各3条。ACO-Ⅰ和ACO-Ⅱ均包含5个成员,ACO-Ⅲ由11个成员组成。龙眼、拟南芥和番茄ACO家族成员均主要分布在ACO-Ⅲ中。DlSAMS、DlACS和DlACO均与番茄和拟南芥SAMS、ACS和ACO的亲缘关系较近。
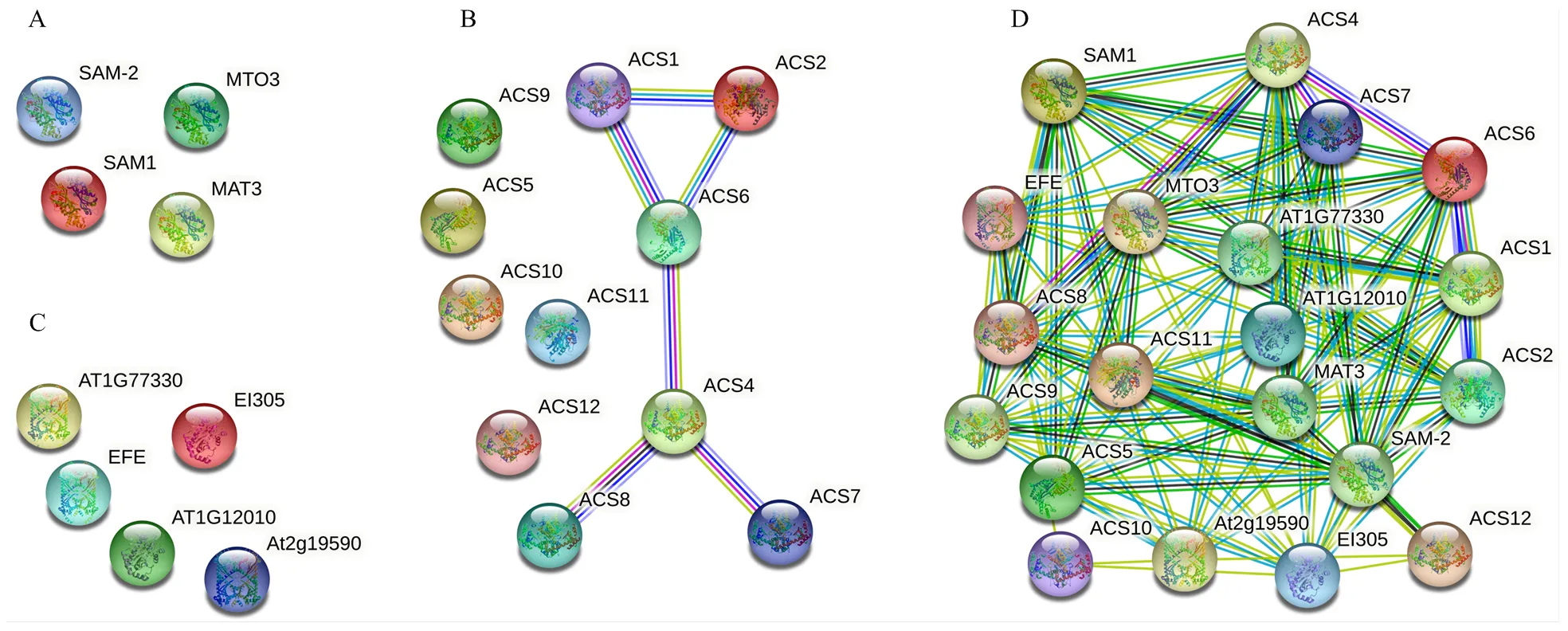
A:SAMS蛋白质互作,B:ACS蛋白质互作,C:ACO蛋白质互作,D:SAMS、ACS、ACO蛋白质互作
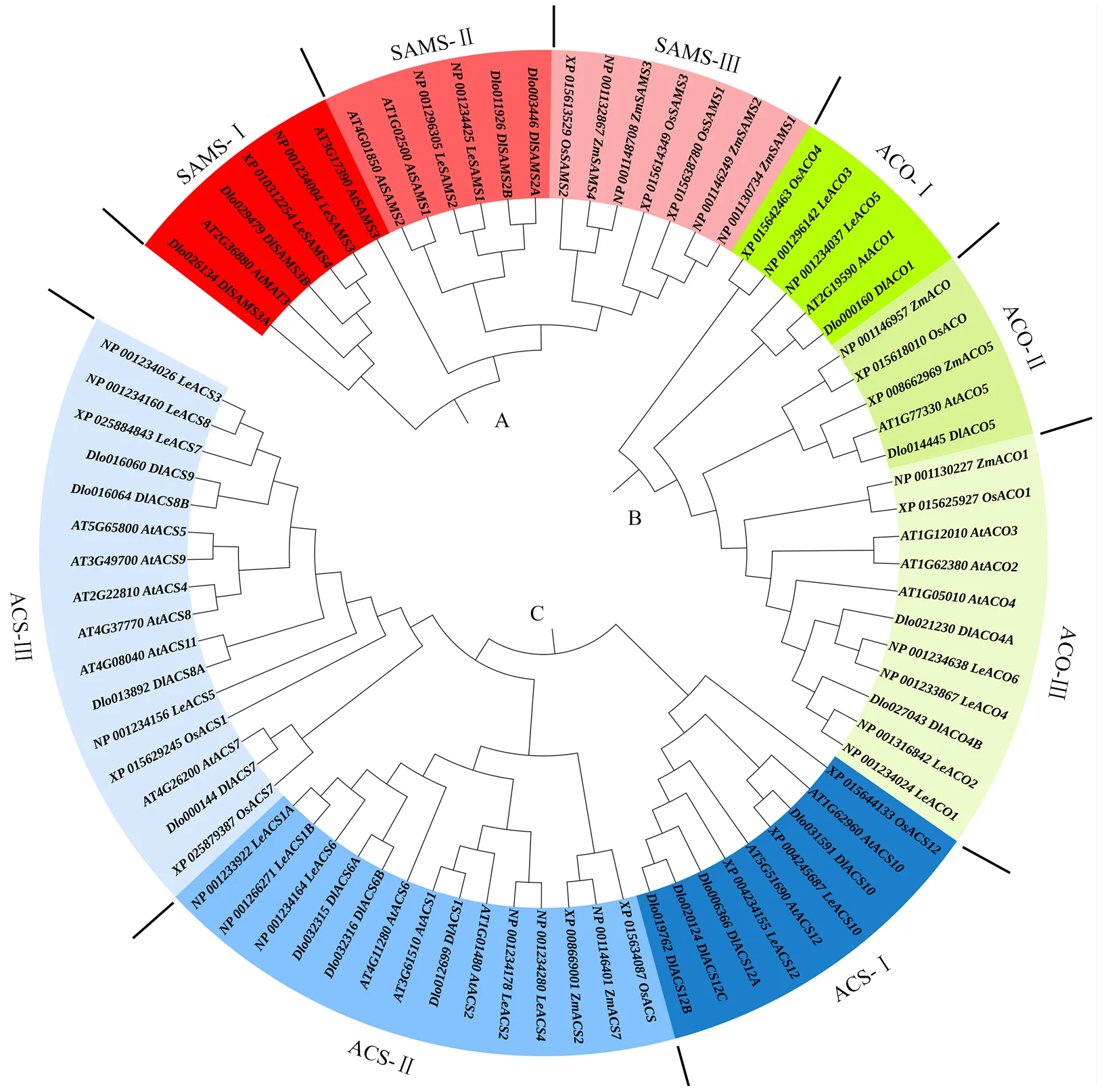
图6 ETH合成途径基因进化树
2.7 DlSAMS、DlACS和DlACO家族在体细胞胚早期不同阶段的表达分析
从龙眼转录组数据库中提取DlSAMS、DlACS和DlACO家族成员在体细胞胚早期不同阶段(EC、ICpEC、GE)的FPKM值并绘制热图(图7),以分析它们在龙眼体细胞胚早期形态建成中的作用。结果表明DlSAMS家族成员在3个阶段均有很高的表达量,其中和的表达模式相同,表达量为GE>EC>ICpEC,而和的表达模式相反,前者是表达量逐渐降低,后者为表达量逐渐升高。DlACS家族在这3个家族中成员数最多,但表达量较高的仅7个成员。的表达量在3个阶段逐渐升高,GE阶段的表达量是EC阶段的22倍,也比ICpEC阶段高数倍;9、和表达量在前两个阶段变化不大,在GE阶段显著提高,尤其是;表达量在体细胞胚早期逐渐降低;表达量在前两个阶段差异不大,但是在GE阶段明显降低;和均表现为ICpEC阶段表达量较另两个阶段高。DlACO家族的4个成员中仅的表达量(GE>EC>ICpEC)在3个阶段都很高,和在3个阶段均检测出,但表达量都很低,而未检测出表达。
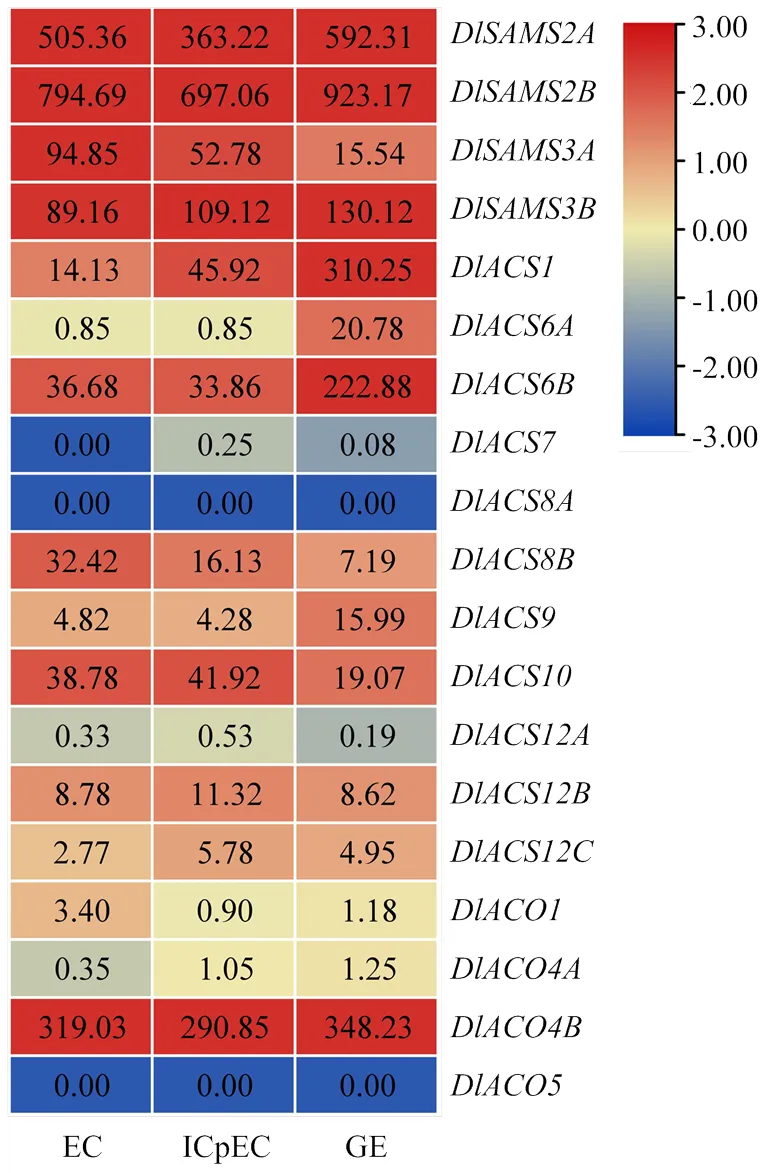
图7 DlSAMS、DlACS和DlACO家族基因在体细胞胚早期不同阶段表达量
DlSAMS、DlACS和DlACO家族成员中,除在EC阶段、和在体细胞胚早期的3个阶段未检测出表达外,其他成员均有表达。DlSAMS家族和DlACO家族总体呈现先下降后升高的表达趋势,即GE阶段表达量最高、EC阶段次之,ICpEC阶段表达量相对较低;而DlACS家族表达量呈现逐步升高的趋势。其中有21.05%的成员在体细胞胚发育早期的3个阶段均高表达,42.11%的成员在1个或2个阶段高表达或较高表达,36.84%的成员在体细胞胚发生早期不表达或表达量较低。也有成员如、、和在GE阶段的表达量是前两个阶段的数倍到数10倍,表现出阶段特异性。
2.8 ACC处理下龙眼EC生长量及ETH释放量分析
在龙眼EC继代过程中分别加入不同浓度的ACC,以添加等体积蒸馏水为对照,不同培养时间下龙眼EC生长量及ETH释放量的变化见图8。低浓度的ACC在前期(20 d)促进龙眼EC的生长;高浓度的ACC在后期(35 d)促进龙眼EC的生长。对照处理(CK)在25 d时生长量已基本达到最大值。ACC的添加推迟了最大生长量的到达时间,0.01和0.1 mmol∙L-1ACC处理在30 d时的生长量达到最大值;0.5 mmol∙L-1ACC在35 d时的生长量达到最大值。
龙眼EC的ETH释放量呈倒“V”形,25 d时释放量最大。在继代培养基中添加ACC整体上增加了ETH的释放,而且ACC的浓度越高,ETH的释放量越大。在20 d时,0.5 mmol∙L-1ACC处理下的ETH释放量是CK的14.2倍。但是添加0.01 mmol∙L-1的ACC在20—35 d的ETH释放量都比较低,在25和30 d时低于CK,这可能是导致该处理生长量增加的原因。
2.9 ACC处理下DlSAMS、DlACS和DlACO家族成员表达情况分析
在未添加ACC的继代培养基中,不同培养时间下龙眼、、、、和的表达趋势主要呈“N”型,其中、和在25 d时表达量最高;和在35 d时表达量最高;在20和25 d时的表达量差异不大。
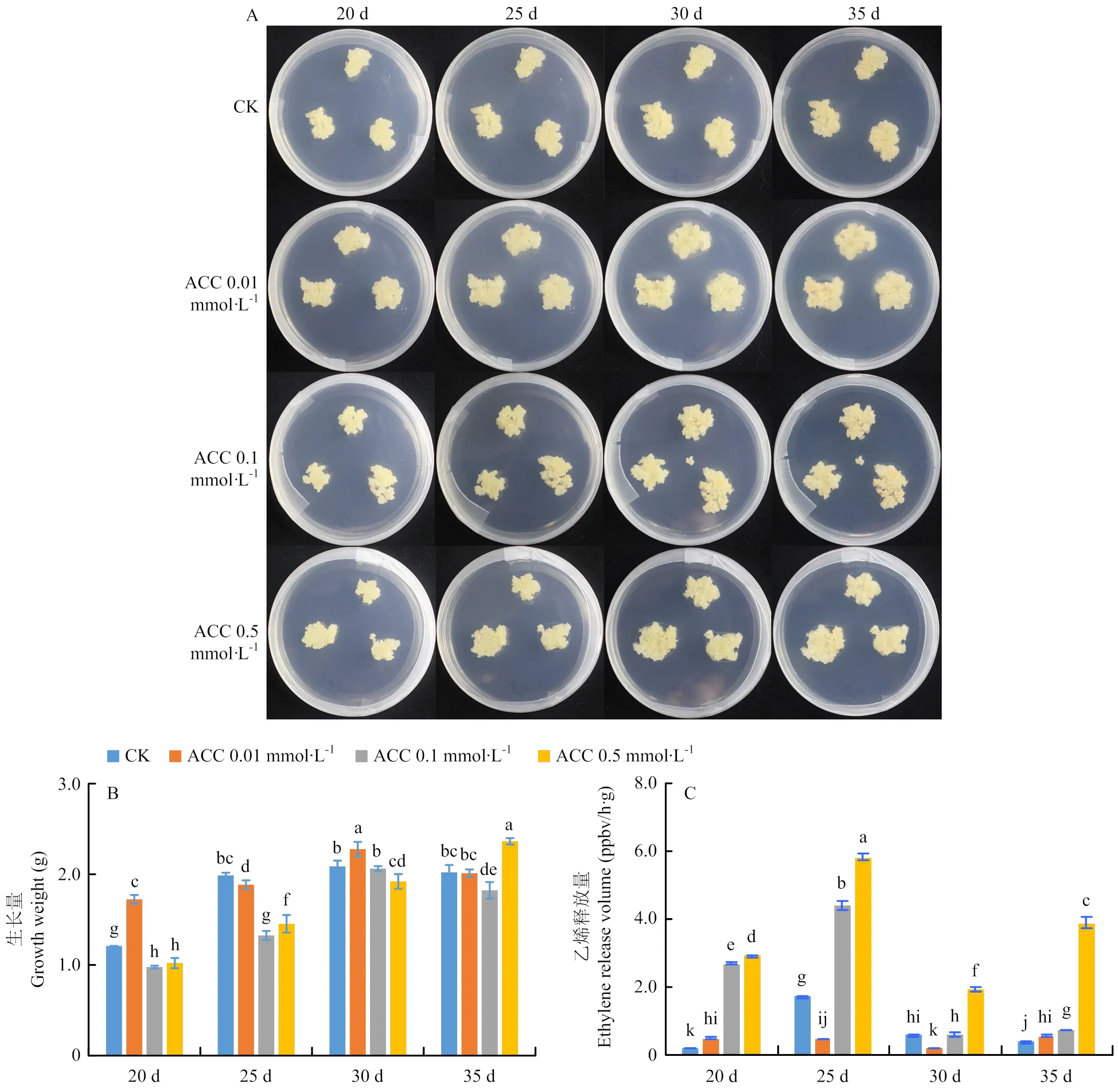
A:生长状况;B:生长量;C:ETH释放情况。不同小写字母代表处理间差异显著(P<0.05)。下同
ACC的加入直接影响DlSAMS、DlACS和DlACO家族成员的表达。继代20 d时,添加不同浓度的ACC提高了、、和的表达量,且ACC浓度越高,表达量越大;但是不同浓度的ACC处理均降低了的表达量;的表达量在20 d时表现为为0.5 mmol∙L-1>CK>0.01 mmol∙L-1>0.1 mmol∙L-1,呈“V”型。在继代25、30和35 d时,ACC的加入整体上降低了基因的表达量。继代25 d时,表达量随ACC浓度的增加而提高;和表达量随ACC浓度的增加而降低;和表达量呈“V”型,在0.1 mmol∙L-1ACC时表达量最低;而表达量则呈倒“V”型,在0.1 mmol∙L-1ACC时表达量最高,但也仅是CK表达量的29.61%。在继代30 d时,和表达量随ACC浓度的增加而提高;表达量随ACC浓度的增加而降低;和表达量呈“V”型,在0.1 mmol∙L-1ACC时表达量最低;而表达量则呈倒“V”型,在0.1 mmol∙L-1ACC时表达量最高,为CK表达量的52.24%。继代35 d时,、和表达量随ACC浓度的增加而降低;、和表达量则呈倒“V”型,在0.1 mmol∙L-1ACC时表达量最高,但是均小于CK的表达量(图9)。
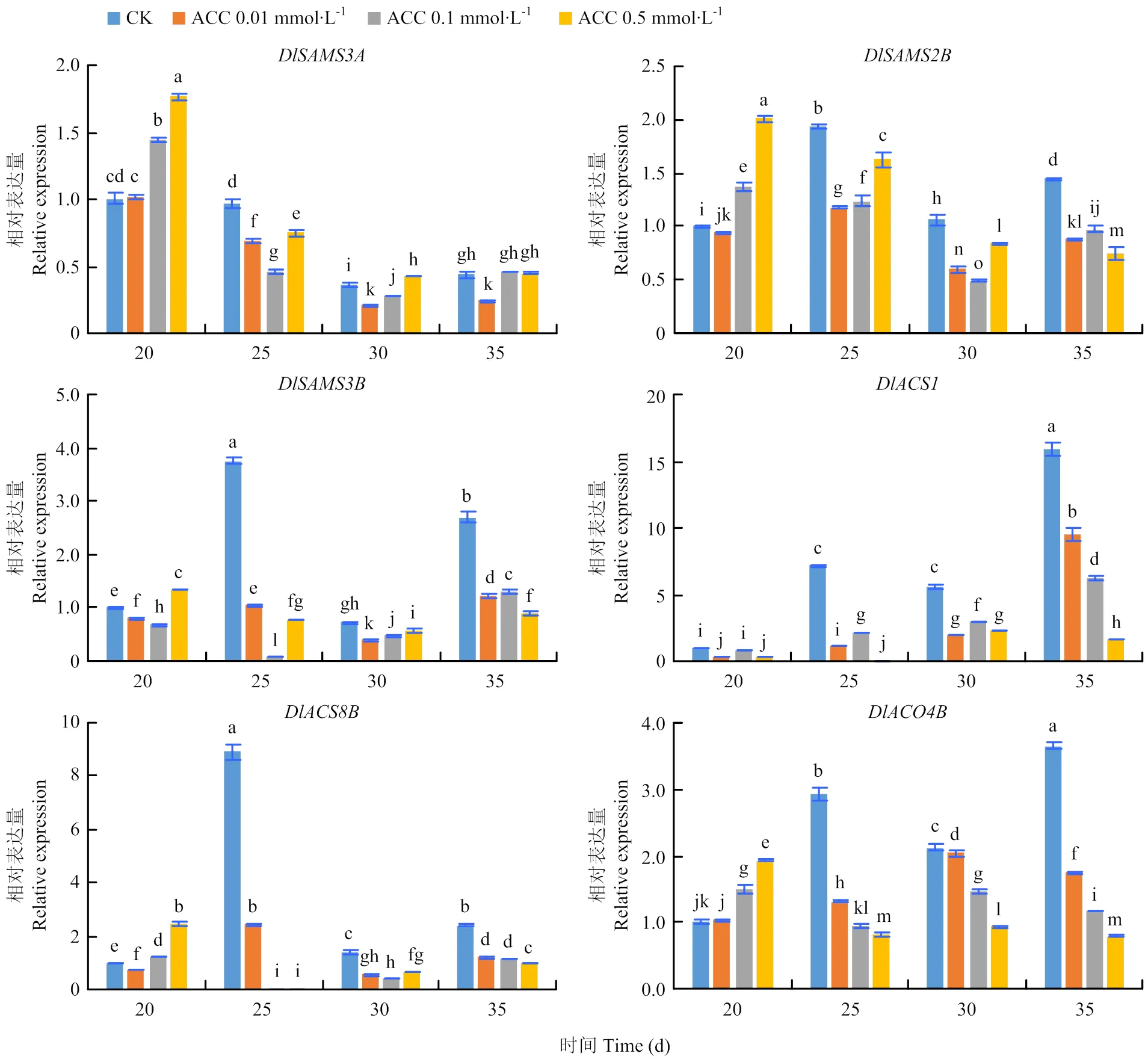
图9 不同ACC浓度、不同时间下DlSAMS、DlACS和DlACO家族成员相对表达情况
3 讨论
3.1 DlSAMS、DlACS和DlACO家族成员结构及进化分析
SAMS家族成员目前已在拟南芥[5]、番茄[6]和蝴蝶兰[22]等植物中得到鉴定。PARVIZ等[6]对10种植物的SAMS家族成员的研究表明,该家族成员多数为3—5个,在氨基酸序列长度、等电点、gravy值等理化性质方面差异不大,所有成员还含有多个相同的保守Motif,单子叶植物的SAMS全部位于一个亚族,相对于双子叶植物较保守。本研究中DlSAMS家族有4个成员,与其他物种在成员数量上差异不大,理化性质和基因结构上都较为相似,系统进化分析表明DlSAMS家族成员也只分布在由双子叶植物SAMS成员组成的SAMS-Ⅰ和SAMS-Ⅱ,与前人的研究结果相吻合。较低的“不稳定性指数”和较高的“脂肪族指数”还赋予DlSAMS家族蛋白质较强的热稳定性和较长的半衰期[23]。ACS和ACO家族也在多个物种中得到鉴定[9,24]。ACS和ACO家族成员均只含有1个保守结构域,不同亚族成员的保守结构域基本一致,体现出相同家族成员结构的稳定性[17]。ACS家族的成员相对较多,在拟南芥和番茄中均为11个。DlACS家族也为11个,在数量上与拟南芥和番茄一致。不同物种的ACS成员在进化树3个亚族中的分布情况有所不同,如拟南芥的ACS成员有一半以上分布在ACS-Ⅲ,而DlACS成员在3个亚族中分布较为均匀;在ACS-Ⅲ亚族中,龙眼缺少了与拟南芥、和相对应的基因,可能是龙眼在进化过程中丢失了部分该亚族的基因。拟南芥中ACO家族有5个成员,番茄为6个,水稻和玉米均为3个,DlACO家族有4个成员,在数量上与其他物种差异不大。不同物种的ACO成员在进化树3个亚族中的分布规律基本一致,即主要分布在ACO-Ⅲ。
3.2 DlSAMS、DlACS和DlACO家族成员的功能具有多样性
SAMS家族成员在植物繁殖进程中发挥重要的作用,如在花粉中高表达的促进了花粉管生长,抑制其表达则会对花粉管造成损伤,减少种子的形成[4]。DlSAMS家族成员可能也具有促进花粉管生长的功能。SAMS成员在不同组织部位的表达模式不同,如在番茄果实和根组织中特异表达,而在番茄叶片中特异表达[6]。DlSAMS家族成员在不同器官中可能也存在差异表达的情况。外源性油菜素甾醇(brassinosteroid,BR)和脱落酸(abscisic acid,ABA)处理还会显著降低番茄的表达[6]。预计BR和ABA处理也可能会负调控DlSAMS的表达。
DlACS和DlACO家族成员多是通过调控ETH的合成来发挥功能。如和在番茄幼果期ETH生物合成的系统1起作用[25],和与其在相邻的分支上,预计它们也可能在龙眼果实成熟前ETH合成的系统1起作用;参与成熟番茄果实ETH生物合成的系统2,则参与过渡期ETH的生物合成[25]。与和也处在相邻的分支上,预计它们在功能上也可能有相似性。表达降低会导致ETH合成减少,进而延缓番茄果实的成熟[8],与在同一分支上,预计抑制的表达也可能有延缓龙眼果实成熟的作用。ETH打破种子休眠的作用机制包括ETH自身的作用和通过调控ABA和GA的含量[2-27],响应环境因子的间接调控作用[28]。ETH能响应涝害、干旱和高盐等非生物胁迫[16],这些胁迫损伤通过提高ETH合成基因的表达量来增加逆境ETH合成速率[29]。ETH还能对拟南芥的抗冷作用进行负调控[30]。在对DlSAMS、DlACS和DlACO家族启动子顺式作用元件的分析中发现,有大量成员具有响应MeJA、ABA、GA、厌氧、干旱、低温以及防御与压力的元件,充分印证了ETH具有响应其他植物激素和环境因子的功能。大量的磷酸化位点还表明它们在信号转导、蛋白质-蛋白质相互作用和植物代谢中起着关键作用[31-32]。
DlACS和DlACO成员还能通过调控ETH的合成影响植物体细胞胚的发育。对圣栎(L.)的研究表明,在EC、未成熟体细胞胚及次生胚发育过程中ETH的含量较高,而在体细胞胚成熟、萌发阶段ETH量相对较低[33]。且有研究表明ETH合成和响应基因在EC中明显上调,为ETH促进体细胞胚发生提供了分子水平的证据[34]。但是LU等[35]对欧洲赤松(L.)的研究结果与之相反。可能是在体细胞胚发生过程中,不同的植物对ETH的需求量有所不同。龙眼未成熟体细胞胚中、及ETH受体基因的表达量总体上高于成熟体细胞胚[12-13,36],DlSAMS、DlACS和DlACO家族基因也多在球形胚阶段高表达,因此,在龙眼体细胞胚发生过程中,ETH的变化规律可能更支持前者的观点。龙眼体细胞胚在发育过程中还会受到乙烯响应因子的调控[37]。ETH合成基因过表达会使ETH在胚珠中过度积累,导致胚珠早衰,诱导植物形成无籽果实[2]。
3.3 ACC参与调控龙眼EC生长及DlSAMS、DlACS和DlACO家族成员表达
低浓度的ACC能增加胡萝卜体细胞胚的数量,而高浓度则会起抑制作用[38]。培养20 d时,0.01 mmol∙L-1ACC处理下龙眼EC的生长量显著高于CK,而0.1和0.5 mmol∙L-1ACC处理下龙眼EC的生长量则显著低于CK,与前人的研究结果相吻合。ACC作为ACS的产物以及ACO的底物[15],能直接调控ETH的生物合成。外源ACC处理能通过调控拟南芥的表达,影响拟南芥根系的向重力性[14]。1.0 μmol∙L-1的ACC处理能促进低氮条件下和的表达,提高乙烯含量,进而调控玉米幼苗的氮素供给过程并影响其形态建成[39]。本研究中,ACC处理整体上增加了ETH的释放及DlSAMS、DlACS和DlACO家族成员的表达,且ACC浓度越高,ETH的释放量及基因的上调表达也越大,与前人的研究结果吻合。但是也有不同之处,0.01 mmol∙L-1的ACC处理在20—35 d对基因的表达均起下调作用,对应ETH释放量也低于对照。25—35 d时,ACC处理也主要表现为下调DlSAMS、DlACS和DlACO家族基因的表达。从各处理EC的生长情况分析,CK的生长量在25 d时已基本达到最大值,而后细胞开始衰老、活性降低。这可能是导致CK在后期表达量显著高于ACC处理,而ETH释放量却更低的原因。随着培养时间的延长和愈伤组织的吸收,培养基内ACC的含量逐渐降低,这可能是导致高浓度ACC(0.1和0.5 mmol∙L-1)处理下的龙眼EC在后期生长量快速增加的原因。即ACC的添加可能在一定程度上延缓龙眼EC的衰老。今后的研究可以从培养基中ACC含量的变化情况、不同培养时间龙眼EC的活性及内源激素的变化情况等方面入手,进一步探明ACC调控EC生长及SAMS、ACS和ACO家族成员表达的作用机理。
4 结论
在龙眼全基因组范围内分别筛选获得SAMS、ACS和ACO基因家族成员4个、11个和4个,其在进化过程中保守性均较高,且包含大量激素和逆境响应元件;3个家族成员对龙眼体细胞胚胎的发生起重要调控作用,0.01 mmol∙L-1ACC处理可能通过调控DlSAMS、DlACS和DlACO家族基因的表达促进龙眼胚性愈伤组织增殖。本研究结果为进一步探究SAMS、ACS和ACO家族基因在植物生长发育过程中的作用提供了有效的数据基础。
[1] 张晓卫, 曹蔚, 王玉琨, 王四旺. 龙眼的化学成分及药理作用研究进展. 西北药学杂志, 2012, 27(5): 493-496.
ZHANG X W, CAO W, WANG Y K, WANG S W. Study of the progress on chemical constituents and pharmacological activities of Longan. Northwest Pharmaceutical Journal, 2012, 27(5): 493-496. (in Chinese)
[2] WANG H B, ZHANG H Q, LIANG F F, CONG L, SONG L Y, LI X Y, ZHAI R, YANG C Q, WANG Z G, MA F W, XU L F. PbEIL1 acts upstream ofto regulate ovule senescence in seedless pear. Horticulture Research, 2021, 8(1): 59.
[3] SAUTER M, MOFFATT B, SAECHAO M C, HELL R, WIRTZ M. Methionine salvage and S-adenosylmethionine: Essential links between sulfur, ethylene and polyamine biosynthesis. The Biochemical Journal, 2013, 451(2): 145-154.
[4] CHEN Y, ZOU T, MCCORMICK S. S-adenosylmethionine synthetase 3 is important for pollen tube growth. Plant Physiology, 2016, 172(1): 244-253.
[5] SHEN B, LI C J, TARCZYNSKI M C. High free-methionine and decreased lignin content result from a mutation in theS-adenosyl-L-methionine synthetase 3 gene. The Plant Journal, 2002, 29(3): 371-380.
[6] HEIDARI P, MAZLOOMI F, NUSSBAUMER T, BARCACCIA G. Insights into the SAM synthetase gene family and its roles in tomato seedlings under abiotic stresses and hormone treatments. Plants, 2020, 9: 586.
[7] BAUERLE M R, SCHWALM E L, BOOKER S J. Mechanistic Diversity of radical s-adenosylmethionine (SAM)-dependent methylation. Journal of Biological Chemistry,2015, 290(7): 3995-4002.
[8] KLEE H J, GIOVANNONI J J. Genetics and control of tomato fruit ripening and quality attributes. Annual Review of Genetics, 2011, 45: 41-59.
[9] 孙申申. ‘云香’水仙ACS基因和ACO基因的克隆分析及遗传转化[D]. 福州: 福建农林大学, 2018.
SUN S S. Molecular cloning, expression analysis and its transformation of ACS gene and ACO gene fromCV Yunxiang. [D]. Fuzhou: Fujian Agriculture and Forestry University, 2018. (in Chinese)
[10] TSUCHISAKA A, THEOLOGIS A. Unique and overlapping expression patterns among the1-amino-cyclopropane-1-carboxylate synthase gene family members. Plant Physiology, 2004, 136(2): 2982-3000.
[11] 佟少明, 席海秀, 艾可筠, 侯和胜. 葡萄的表达及在拟南芥和番茄中的遗传转化. 园艺学报, 2016, 43(12): 2315-2324.
TONG S M, XI H X, AI K J, HOU H S. Expression ofgene in grape and genetic transformation inand tomato. Acta Horticulturae Sinica, 2016, 43(12): 2315-2324. (in Chinese)
[12] 李惠华, 赖钟雄, 苏明华, 林玉玲. 龙眼胚性愈伤组织ACC合成酶基因()的克隆及表达分析. 热带作物学报, 2011, 32(5): 854-860.
LI H H, LAI Z X, SU M H, LIN Y L. Cloning and expression ofgene from embryogenic callus in. Chinese Journal of Tropical Crops, 2011, 32(5): 854-860. (in Chinese)
[13] 李惠华, 赖钟雄, 林玉玲, 苏明华. 龙眼胚性愈伤组织ACC氧化酶基因的克隆及其在龙眼体胚发生过程中的表达分析. 中国农业科学, 2010, 43(18): 3798-3808.
LI H H, LAI Z X, LIN Y L, SU M H. Cloning of ACO gene from embryogenic calli of kongan (lour.)and its expression during kongan somatic embryogenesis. Scientia Agricultura Sinica, 2010, 43(18): 3798-3808. (in Chinese)
[14] HUANG S J, CHANG C L, WANG P H, TSAI M C, HSU P H, CHANG I F. A type III ACC synthase,, is involved in root gravitropism in. Journal of Experimental Botany, 2013, 64(14): 4343-4360.
[15] ZHANG B G, LIU H F, DING X H, QIU J J, ZHANG M, CHU Z H.plays a crucial role in the early biosynthesis of ethylene elicited by Cu2+ions. Journal of Cell Science, 2018, 131(2): jcs.202424.
[16] YIM W J, KIM K Y, LEE Y W, SUNDARAM S P, LEE Y, SA T M. Real time expression of ACC oxidase and PR-protein genes mediated byspp. in tomato plants challenged withpv.. Journal of Plant Physiology, 2014, 171(12): 1064-1075.
[17] 邹冰雪. 印度南瓜基因家族的克隆与表达分析[D]. 哈尔滨: 东北农业大学, 2018.
ZOU B X. Cloning and expression analysis ofgene family in[D]. Harbin: Northeast Agricultural University, 2018. (in Chinese)
[18] 赖钟雄, 陈振光. 龙眼胚性愈伤组织的高频率体细胞胚胎发生. 福建农业大学学报, 1997(3): 271-276.
LAI Z X, CHEN Z G. Somatic embryogenesis of high frequency from longan embryogenic calli. Journal of Fujian Agricultural University, 1997(3): 271-276. (in Chinese)
[19] LIN Y L, MIN J M, LAI R L, WU Z Y, CHEN Y K, YU L L, CHENG C Z, JIN Y C, TIAN Q L, LIU Q F, LIU W H, ZHANG C G, LIN L X, HU Y, ZHANG D M, THU M, ZHANG Z H, LIU S C, ZHONG C S, FANG X D, WANG J, YANG H M, VARSHNEY R K, YIN Y, LAI Z X. Genome-wide sequencing of longan (Lour.) provides insights into molecular basis of its polyphenol-rich characteristics. GigaScience, 2017, 6(5): 1-14.
[20] 赖钟雄, 潘良镇, 陈振光. 龙眼胚性细胞系的建立与保持. 福建农业大学学报, 1997(2): 33-40.
LAI Z X, PAN L Z, CHEN Z G. Establishment and maintenance of longan embryogenic cell lines. Journal of Fujian Agricultural University, 1997(2): 33-40. (in Chinese)
[21] 林玉玲. 龙眼体胚发生过程中SOD基因家族的克隆及表达调控研究[D]. 福州: 福建农林大学, 2011.
LIN Y L. Studies on cloning, expression and regulation of SOD gene family duling somatic embryogenesis inLour [D]. Fuzhou: Fujian Agriculture and Forestry University, 2011. (in Chinese)
[22] 袁秀云, 雷志华, 梁芳, 蒋素华, 许申平, 王默霏, 崔波. 蝴蝶兰S-腺苷甲硫氨酸合成酶基因的克隆及低温下的表达分析. 植物生理学报, 2015, 51(5): 754-762.
YUAN X Y, LEI Z H, LIANG F, JIANG S H, XU S P, WANG M F, CUI B. Cloning of a s-adenosylmethionine synthetase gene fromand its expression under low temperature. Plant Physiology Joumal, 2015, 51(5): 754-762. (in Chinese)
[23] HEIDARI P, AHMADIZADEH M, IZANLO F, NUSSBAUMER T. In silico study of the CESA and CSL gene family inand: Focus on post-translation modifications. Plant Gene, 2019, 19: 100189.
[24] YUAN H, YUE P T, BU H D, HAN D G, WANG A. Genome-wide analysis ofandgenes in pear ().Cellular & Developmental Biology-Plant, 2020, 56(2): 193-199.
[25] 孙申申, 温秀萍, 杨菲颖, 李梦思, 李欢, 李科, 陈晓静. ‘云香’水仙ACC合成酶基因NtACS1的克隆及遗传转化. 西北植物学报, 2017, 37(2): 250-257.
SUN S S, WEN X P, YANG F Y, LI M S, LI H, LI K, CHEN X J. Molecular cloning and its transformation of ACC synthaseGene fromvar. ‘Yunxiang’. Acta Botanica Boreali-Occidentalia Sinica, 2017, 37(2): 250-257. (in Chinese)
[26] CORBINEAU F, XIA Q, BAILLY C, EL-MAAROUF-BOUTEAU H. Ethylene, a key factor in the regulation of seed dormancy. Frontiers in Plant Science, 2014, 5: 539.
[27] 宋松泉, 刘军, 徐恒恒, 张琪, 黄荟, 伍贤进. 乙烯的生物合成与信号及其对种子萌发和休眠的调控. 作物学报, 2019, 45(7): 969-981.
SONG S Q, LIU J, XU H H, ZHANG Q, HUANG H, WU X J. Biosynthesis and signaling of ethylene and their regulation on seed germination and dormancy. Acta Agronomica Sinica, 2019, 45(7): 969-981. (in Chinese)
[28] EL-MAAROUF-BOUTEAU H, SAJJAD Y, BAZIN J, LANGLADE N, CRISTESCU S M, BALZERGUE S, BAUDOUIN E, BAILLY C. Reactive oxygen species, abscisic acid and ethylene interact to regulate sunflower seed germination. Plant, Cell & Environment, 2015, 38(2): 364-374.
[29] BHOWMIK P K, MATSUI T. Ethylene biosynthetic genes in ‘Moso’ bamboo shoot in response to wounding. Postharvest Biology and Technology, 2005, 38(2): 188-194.
[30] SHI Y T, TIAN S W, HOU L Y, HUANG X Z, ZHANG X Y, GUO H W, YANG S H. Ethylene signaling negatively regulates freezing tolerance by repressing expression ofand Type-AGenes in. The Plant Cell, 2012, 24(6): 2578-2595.
[31] ARDITO F, GIULIANI M, PERRONE D, TROIANO G, MUZIO L L. The crucial role of protein phosphorylation in cell signaling and its use as targeted therapy (Review). International journal of molecular medicine, 2017, 40(2): 271-280.
[32] FRISO G, VAN WIJK K J. Posttranslational protein modifications in plant metabolism. Plant Physiology, 2015, 169: 1469-1487.
[33] MAURI P V, MANZANERA J A. Somatic embryogenesis of holm oak (L.): Ethylene production and polyamine content. Acta Physiologiae Plantarum, 2011, 33(3): 717-723.
[34] KĘPCZYŃSKA E, ZIELIŃSKA S. Disturbance of ethylene biosynthesis and perception during somatic embryogenesis inL. reduces embryos’ ability to regenerate. Acta Physiologiae Plantarum, 2011, 33(5): 1969-1980.
[35] LU J R, VAHALA J, PAPPINEN A. Involvement of ethylene in somatic embryogenesis in Scots pine (L. ). Plant Cell, Tissue and Organ Culture, 2011, 107(1): 25-33.
[36] 李惠华, 赖钟雄, 苏明华, 林玉玲. 龙眼体胚发生过程中两个乙烯受体基因的定量表达分析. 热带作物学报, 2011, 32(7): 1314-1319.
LI H H, LAI Z X, SU M H, LIN Y L. Quantitative expression analysis of two ethylene receptor genes from embryogenic callus inLour. Chinese Journal of Tropical Crops, 2011, 32(7): 1314-1319. (in Chinese)
[37] 陈燕, 吕科良, 厉雪, 高玉莹, 林玉玲, 赖钟雄. 龙眼ERF家族成员鉴定及其在体胚发生早期的表达. 西北植物学报, 2018, 38(11): 1986-1999.
CHEN Y, LÜ K L, LI X, GAO Y Y, LIN Y L, LAI Z X. Identification of ERF gene family and their expression analysis during early somatic embryogenesis in. Acta Botanica Boreali-Occidentalia Sinica, 2018, 38(11): 1986-1999. (in Chinese)
[38] NISSEN P. Stimulation of somatic embryogenesis in carrot by ethylene: Effects of modulators of ethylene biosynthesis and action. Physiologia Plantarum, 1994, 92(3): 397-403.
[39] 吴冰卉, 王桂萍, 王玉斌, 李召虎, 张明才. ACC处理对不同基因型玉米幼苗响应氮素供给的调控效应. 作物学报,2021,47(5):788-795.
WU B H, WANG G P, WANG Y B, LI Z H, ZHANG M C. Regulation of ACC treatment on nitrogen supply response of maize seedlings with different genotypes. Acta Agronomica Sinica, 2021,47(5):788-795.(in Chinese)
Identification of Ethylene Synthesis Pathway Genes in Longan and Its Response to ACC Treatment
LAI ChunWang1, ZHOU XiaoJuan2, CHEN Yan1, LIU MengYu1, XUE XiaoDong1, XIAO XueChen1, LIN WenZhong3, LAI ZhongXiong1, LIN YuLing1*
1Institute of Horticultural Biotechnology, Fujian Agriculture and Forestry University, Fuzhou 350002;2Agricultural and Rural Bureau of Ganzhou Jiangxi, Ganzhou 341000, Jiangxi;3Quanzhou Institute of Agricultural Sciences, Quanzhou 362000, Fujian
【Objective】 S-adenosylmethionine synthetase (SAMS), 1-aminocyclopropane-1-carboxylic acid synthetase (ACS) and 1-aminocyclopropane-1-carboxylic acid oxidase (ACO) are three key enzymes in the biosynthesis of ethylene in plants. In this study, the gene families of SAMS, ACS and ACO in(DlSAMS, DlACS and DlACO) were identified at the whole genome level. Bioinformatics analysis, expression pattern analysis at different early stages of somatic embryogenesis (SE), and expression pattern analysis of embryogenic callus (EC) in longan treated with 1-aminocyclopropane-1-carboxylic acid (ACC) at different time and different concentrations were carried out, so as to lay the foundation for in-depth study and utilization of DlSAMS, DlACS and DlACO family genes in longan. 【Method】 The protein sequences of SAMS, ACS and ACO ofwere downloaded from TAIR as reference sequences. TBtools, NCBI blast and other tools were used to search longan genome database to identify DlSAMS, DlACS and DlACO gene families. ExPASy, PrediSi, TMHMM Server2.0, NetPhos3.1Server, Plant-PLoc, MEME, PlantCARE, STRING, TBtools and other tools were used to predict the basic physicochemical properties, chromosomal localization, gene collinearity and selection pressure, gene structures, protein conservative motifs,-acting elements of promoters and protein interaction relationship of DlSAMS, DlACS and DlACO gene family members. The proteins sequences of longan,, tomato, rice and maize were aligned by ClustalW software, and the evolutionary trees of SAMS, ACS and ACO were constructed by MEGA-X software. According to the FPKM values of longan transcriptome database, TBtools software was used to draw the expression heat maps of DlSAMS, DlACS and DlACO members at different early stages of SE. The expression of DlSAMS, DlACS and DlACO members in EC of longan under different concentrations of ACC and treatment time were analyzed by real-time fluorescence quantitative PCR (qRT-PCR). 【Result】 There were 4, 11 and 4 members of SAMS, ACS and ACO families in the third generation genome of longan, respectively, and the number of family members in longan had little difference with those ofand tomato. DlSAMS family members were the most conservative, and all members had the same motifs, DlACS and DlACO family members also had many conservative motifs. A total of 19 members of the three families were distributed on 11 chromosomes, with six pairs of collinearity genes and 30 pairs of collinearity genes with, all of which were subjected to purification selection. All the members of the three gene families contained a large number of light, hormone and stress response elements. The proteins interaction within the family was weak, but the interaction between the families were very close. According to the phylogenetic relationship, SAMS, ACS and ACO gene families could be divided into three subgroups. DlSAMS family members were only distributed in SAMS-Ⅰ and SAMS-Ⅱ, SAMS-Ⅲ might be unique to monocotyledons. DlACS and DlACO family members were distributed in all three subgroups, and the distribution was relatively uniform. The three gene families were closely related to SAMS, ACS and ACO in tomato and. The analysis of transcriptome FPKM value showed that all members of DlSAMS family andwere highly expressed in the early three stages of SE, which might play an important role in SE.andwere highly expressed in globular embryo (GE) stage, which might be closely related to the formation of GE. The proliferation of EC and the expression of DlSAMS, DlACS and DlACO members were significantly affected by different concentrations of ACC in subculture medium. After 20 days of culture, the genes were mainly up-regulated, and the higher concentrations of ACC, the higher up regulation of genes. In 25-35 days, the expression of genes were mainly down regulated. However, at 20 d, the genes expression in EC under 0.01 mmol∙L-1ACC treatment was mainly down regulated, which might be the reason for its significantly higher proliferation than that of CK. 【Conclusion】 There were 4, 11 and 4 members of SAMS, ACS and ACO family in the third generation genome of longan, which were relatively conservative in evolution, and they contained a lot of hormones and stress response elements. These three gene family members played important roles in the regulation of SE in longan. 0.01 mmol∙L-1ACC treated might regulate and control the proliferation of EC by regulating the expression of DlSAMS, DlACS and DlACO genes.
Longan; SAMS; ACS; ACO; gene family; gene expression analyses
2021-04-06;
2021-06-21
国家自然科学基金(31672127)、福建省自然科学基金(2020J01543)、福建省高原学科建设经费(102/71201801101)、福建农林大学创新基金(CXZX2019033S,CXZX2018078)
赖春旺,E-mail:laichunwang@163.com。通信作者林玉玲,E-mail:buliang84@163.com
(责任编辑 赵伶俐)
