中华蜜蜂气味结合蛋白AcerOBP7的表达及结合特性
2022-03-04赵慧婷彭竹姜玉锁赵淑果黄丽杜亚丽郭丽娜
赵慧婷,彭竹,姜玉锁,赵淑果,黄丽,杜亚丽,郭丽娜
中华蜜蜂气味结合蛋白AcerOBP7的表达及结合特性
赵慧婷1*,彭竹1,姜玉锁1,赵淑果1,黄丽1,杜亚丽2,郭丽娜2
1山西农业大学生命科学学院,山西太谷 030801;2山西农业大学动物科学学院,山西太谷 030801
【目的】中华蜜蜂(,简称中蜂)是我国本土蜂种,也是重要的传粉昆虫和经济昆虫。气味结合蛋白(odorant binding protein,OBP)是蜜蜂嗅觉感知中的关键蛋白。在前人对中蜂基因序列特征分析的基础上,本研究进一步对其表达特性及与气味物质的结合能力进行探究,为揭示气味结合蛋白在中蜂嗅觉系统中的作用提供基础数据。【方法】采用qRT-PCR检测在工蜂不同组织和发育阶段的表达特性;通过原核表达系统获得AcerOBP7融合蛋白,使用Ni-NTA柱进行蛋白纯化;采用荧光竞争结合法,以1-NPN(N-phenyl-1-naphthylamine)为荧光探针,测定AcerOBP7与信息素及植物挥发物的结合能力;设计并合成ds,采用饲喂法对该基因进行沉默,通过qRT-PCR测定沉默效率;结合RNAi,利用EAG检测并比较对照组与干扰组中蜜蜂触角对待测物质反应值的差异。【结果】qRT-PCR结果显示,mRNA在工蜂触角中的表达量极显著高于其他组织(<0.01),且在20日龄时表达量最高,在1日龄时表达量最低。成功构建了pET28a/AcerOBP7表达载体,通过大肠杆菌原核表达系统获得了高纯度的重组蛋白。与37种配体分子的荧光竞争结合试验表明,AcerOBP7与9-ODA、1-壬醇结合能力最强,Ki值均为1.85 µmol·L-1,其次与(+)-柠檬烯、1-辛烯-3-醇、芳樟醇、反式肉桂酸乙酯、桉树脑、(+)-3-蒈烯及壬醛有较强的结合活性,Ki 值分别为1.87、2.66、2.72、3.05、3.88、4.14和4.40 µmol·L-1,与所选择的幼虫信息素均无结合能力。使用饲喂dsRNA的方法成功干扰了的表达,干扰效率最高可达70.63%。干扰后的EAG试验表明,中蜂触角对所测气味物质的反应强度均有所下降,其中1-辛烯-3-醇、壬醛、桉树脑和9-ODA的EAG相对值显著降低(<0.05)。【结论】在中蜂采集蜂触角中高表达,重组蛋白能与多种气味分子结合,表明AcerOBP7是一种广谱型结合蛋白,推测其可能在工蜂采集和哺育蜂王的行为中发挥着重要作用。另外,1-辛烯-3-醇、壬醛、桉树脑和9-ODA可能是AcerOBP7结合特异性较高的配体物质。
中华蜜蜂;气味结合蛋白;表达模式;蛋白纯化;结合特性
0 引言
【研究意义】昆虫通过嗅觉来进行觅食、交配和寻找寄主等行为和生理活动,并通过识别信息素、植物挥发物和动物气味等多种化学物质,与种群中成员进行联络和信息交流[1-2]。对昆虫嗅觉识别机理以及气味物质与嗅觉蛋白间分子互作的研究,对于制定通过干扰嗅觉行为的控制策略来开发昆虫引诱剂或趋避剂具有现实意义。昆虫外周嗅觉系统涉及多种嗅觉相关蛋白,其中,气味结合蛋白(odorant binding protein,OBP)是感受外界化学刺激,并运载、释放化学信息的重要蛋白[3-4]。蜜蜂是一类社会性昆虫,嗅觉在蜜蜂几乎所有的生物学行为中都具有重要作用,为蜂群内部凝聚力的维持和外出采集行为提供了重要的感觉网络[5]。中华蜜蜂(,简称中蜂)是我国重要的经济蜂种,有许多独特的生物学特性,如能从零星的蜜源植物中检测到微量的气味物质从而找到蜜源,对瓦螨()等寄生虫具有高抗性,以及耐低温环境等优良特性[6]。对中蜂OBP进行研究有助于了解其灵敏的化学感受机制,为有效指导和利用中蜂生产提供基础数据。【前人研究进展】昆虫OBP是一类小分子的水溶性蛋白,由嗅觉感器中的助细胞分泌到感器淋巴液中[4]。OBP被认为可以结合疏水性气味分子,并将它们运送到气味受体(odorant receptor,OR),还可以保护气味分子免受感器淋巴液中气味降解酶的影响[7-8]。目前,OBP基因家族已经在棉铃虫()、草地螟()、中华按蚊()等多种昆虫中被鉴定[9-11],为昆虫嗅觉分子机制的深入研究打下了基础[12-13]。通过生物信息学方法,在西方蜜蜂()基因组中鉴定了21个OBP,是目前已知的OBP数量较小的昆虫种类[14]。蜜蜂OBP家族基因序列具有高度的异质性,每个OBP基因可能执行不同的功能[15]。中蜂与西方蜜蜂的嗅觉蛋白基因序列具有高度的相似性[16]。自昆虫OBP基因被鉴定以来,其表达特性及功能成为了研究的热点。一般认为在触角高表达的OBP与嗅觉功能相关[17],在非嗅觉器官中高表达的OBP可能具有其他广泛的功能[18]。目前对昆虫OBP功能的研究主要采用荧光竞争结合、RNAi及电生理等手段[19-21]。研究昆虫OBP在农业生产中亦具有潜在的应用价值。利用化合物与OBP的结合亲和力,将OBP作为筛选活性化合物的分子靶点,从而减少脐橙螟()候选引诱剂气味物质的数量,与该领域常用的其他试错筛选法相比,不但节省时间,还降低了研究成本[22]。Leal等[23]利用CquiOBP1作为结合靶点,结合反向和常规化学生态学方法来鉴定非天然配体,促进了商品化致倦库蚊()产卵引诱剂的研发。近年来对中蜂OBP也开展了一系列研究,如比较了中蜂和意大利蜜蜂()的序列特征、表达模式,并利用荧光竞争结合试验检测了两个同源基因与感染白垩病的蜜蜂幼虫挥发性物质苯甲醇、2-苯乙醇和乙酸苯乙酯3种配体的结合特性[12];通过体外诱导AcerOBP12重组蛋白的表达,探究了与吡虫啉的结合机理[24];利用荧光竞争结合试验研究了与蜜蜂多种信息素成分如下颌骨信息素、对羟基苯甲酸甲酯和反式-9-氧代-2-癸烯酸(9-ODA)的结合特性[25];Guo等[26]研究了在非生物胁迫作用下的表达模式。【本研究切入点】陈艺杰等[27]克隆了中蜂并分析了其序列特征,发现AcerOBP7为classical OBP亚家族的一种分泌蛋白。但表达特性及嗅觉功能有待于进一步明确。【拟解决的关键问题】利用qRT-PCR技术对在中蜂不同发育阶段及组织中的表达水平进行检测;通过荧光竞争结合试验,确定AcerOBP7蛋白与信息素及植物挥发物的结合能力;联合RNAi及EAG试验进一步鉴定AcerOBP7的特异性配体物质。
1 材料与方法
1.1 供试中蜂
试验用中蜂于2019年采自山西农业大学中蜂场。
qRT-PCR用样本:选择健康蜂群,将即将羽化出房的巢脾置于恒温恒湿培养箱(温度(34±1)℃,相对湿度(75±5)%)中。待新蜂出房后,使用无毒无味的颜料标记1日龄工蜂胸部(约2 000只),把刚羽化出房的蜜蜂记为1日龄,标记后随机放入3个蜂箱中,随后收集不同发育阶段(1、5、10、15、20、25、30日龄)的触角样本,每个样本为80只蜜蜂,设3个生物学重复。另外在巢门口采集后足携带花粉的采集蜂,分离并收集触角(80只)、头(去触角,8只)、胸(8只)、腹(3只)、足(20只)、翅(80只)。将收集到的组织样本立即投入液氮中,充分研磨后置于1.5 mL EP管中,加入1 mL Trizol,-80℃保存备用。
RNAi用样本:在巢门口采集后足携带花粉的采集蜂,用消毒镊子轻轻夹住其胸部,放至木盒中。将木盒置于恒温恒湿培养箱(温度(28±1)℃,相对湿度(75±5)%)中,饥饿30 min后分别饲喂30%糖水、含有ds、ds的30%糖水,每组3个重复,并于饲喂后24、48、72、96 h分别收集蜜蜂全组织(去除腹部)。将收集到的组织样本立即投入液氮中,研磨至粉末状后,-80℃保存备用。
1.2 引物设计
利用在线工具Primer3.0 Plus设计qRT-PCR及dsRNA用引物序列,选用东方蜜蜂作为荧光定量的内参基因(GenBank登录号:HM640276.1),选用绿色荧光蛋白(GenBank登录号:JQ064510.1)作为RNAi试验的阴性对照。所需引物详细信息见表1。
1.3 总RNA提取和cDNA合成
按照Trizol(Invitrogen,美国)试剂盒说明书提取中蜂不同发育阶段的触角、采集蜂不同组织及RNAi饲喂后各时间段蜜蜂组织的总RNA。经Nanodrop 2000c微量核酸蛋白测定仪(ThermoFisher,美国)测定RNA纯度和浓度后,根据PrimeScriptTMRT Reagent Kit with gDNA Eraser(perfect real-time)试剂盒(Takara,大连)说明书反转录合成cDNA 第一链,合成后置于-20℃保存备用。
1.4 实时荧光定量PCR(qRT-PCR)
使用SYBR ® Premix Ex TaqTMII(Takara,大连)试剂盒在StepOnePlus实时荧光定量PCR仪(ABI,美国)上进行qRT-PCR,反应体系为15 μL。反应程序:95℃预变性30 s;95℃变性5 s,60℃退火30 s,共42个循环。熔解曲线反应条件:95℃ 15 s,60℃ 1 min。分别以工蜂1日龄触角、采集蜂触角中的表达量为基准,采用2-ΔΔCt法对在工蜂不同发育阶段和不同组织的表达量进行分析,每个样品做3 次技术重复。
1.5 AcerOBP7原核表达载体构建
根据中蜂触角转录组测序得到的基因完整的ORF序列,去除信号肽(前19个氨基酸),设计带有H I和d III(Takara,大连)酶切位点的引物序列(表 1),以采集蜂触角cDNA为模板进行PCR扩增,PCR扩增产物经1.0%琼脂糖凝胶电泳检测,胶回收的目的片段连接到表达载体pET-28a(+)上,然后转化到大肠杆菌BL21(DE3)感受态细胞中(全式金,北京),次日,挑取菌落振荡培养12 h(37℃,220 r/min),用Plasmid Mini Kit I试剂盒提取质粒DNA(OMEGA,美国)并测序验证(生工生物工程上海股份有限公司)。
1.6 AcerOBP7原核表达及分离纯化
将测序验证后的重组质粒pET-28a/AcerOBP7转入大肠杆菌 BL21(DE3)感受态细胞,涂板培养后挑取单菌落于LB培养液中振荡培养(37℃,220 r/min,12 h),将少量培养后的菌液按体积比1﹕1 000接种于新鲜的LB培养液(含Kan 50 μg·mL-1)中,37℃,220 r/min振荡培养至OD600=0.8时,加入终浓度1 mmol·L-1IPTG诱导培养6 h,然后离心收集菌体,将菌体重新悬浮后超声波破碎,12 000 r/min离心30 min,收集上清和沉淀,SDS-PAGE检测蛋白的表达情况。
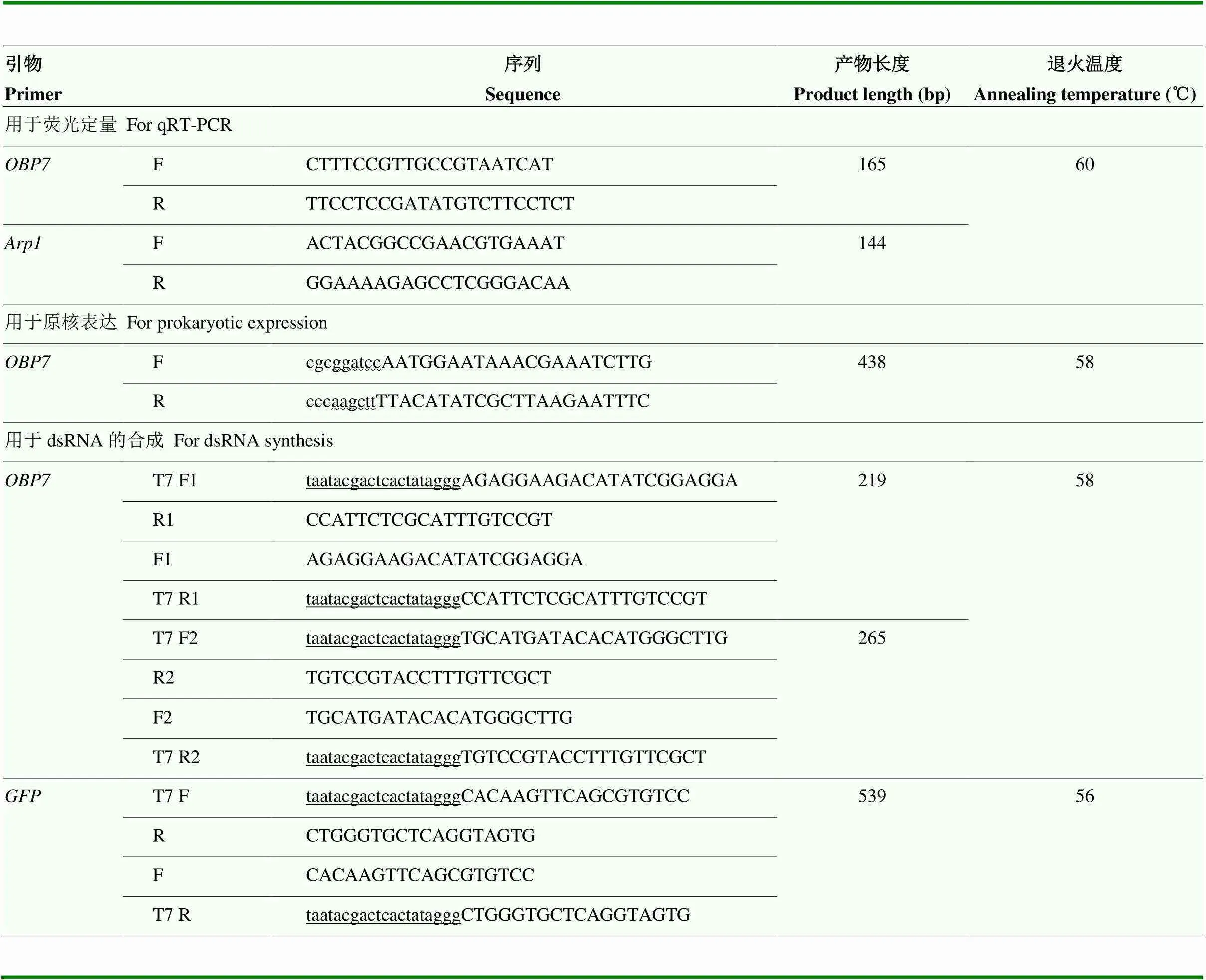
表1 引物信息列表
酶切位点和T7启动子序列分别用“~”和“_”表示The wavy lines represent the restriction sites. The underlines represent the T7 promote sequence
500 mL LB培养基大量表达目的蛋白,诱导后离心收集菌体,用25 mL 50 mmol·L-1Tris-HCl(pH 7.4)悬浮,超声破碎后离心取上清,保存沉淀,SDS-PAGE电泳检测目的蛋白表达形式。含有重组目的蛋白的溶液参照His标签蛋白纯化试剂盒说明书进行亲和层析蛋白纯化,纯化后利用凝血酶(索莱宝,北京)切除His-tag,再次纯化,经超滤凝缩管(Millipore,上海)浓缩及复性后,将得到的目的蛋白置于-80℃备用。
一个月零三天后,也就是6月10日,《沮水巫音》被列入国家级非遗保护名录,这对保康来说,是一件大好事,极大地提升了保康的文化内涵,打响了文化品牌。我第一时间打电话把这个好消息告诉给王述金,电话的那头传来的是老王悲喜交加的哭泣声。
1.7 荧光竞争结合试验
荧光竞争结合试验选取37种气味标品物质(阿拉丁,上海),包括1种蜂王信息素,2种告警信息素、4种那氏信息素、7种幼虫信息素和23种植物挥发物。该试验在RF-5301PC荧光分光光度计(Shimadzu,日本)上完成,具体操作过程:在荧光比色皿中加入AcerOBP7蛋白溶液(终浓度为1 μmol·L-1),记录最大荧光值,加入1-NPN(N-pheny-1-naphthylamine),吹打混匀后静置2 min使充分反应,扫描并记录荧光强度,1-NPN浓度1—10 μmol·L-1依次递增,记录最大荧光值。利用GraphPad Prism 8.0软件对1-NPN浓度和其对应的荧光最大值数据进行非线性回归拟合分析,并用Scatchard法线性化该曲线,计算AcerOBP7与1-NPN的结合常数。为了测定AcerOBP7与待测气味分子的结合特性,将溶于甲醇的气味标品样(终浓度为l μmol·L-1)依次加到荧光比色皿中,浓度1—10 μmol·L-1依次递增,记录最大荧光值。气味分子与蛋白1﹕1结合,根据气味物质的IC50值,计算配体的解离常数Ki,公式为Ki = IC50/[I +(1-NPN)/K1-NPN]。其中,IC50为配体替换50%探针时的浓度,1-NPN为未结合1-NPN浓度,K1-NPN为OBP/1-NPN复合物的结合常数。
1.8 RNA干扰及EAG试验
设计RNAi试验沉默目的基因,具体步骤参照T7 RiboMAXTMExpress RNAi System说明书,合成两对的dsRNA,经浓度和质量检测后,保存至-80℃备用。将采粉蜂收集至木盒中,饥饿30 min后,饲喂含有dsRNA的30%糖水。每30只蜜蜂作为一个生物学重复,共设置3个重复。每只蜜蜂的dsRNA饲喂量为8 μg,将蜜蜂置于人工培养箱中。饲喂后24、48、72和96 h分别采样,经RNA提取及反转录后,利用qRT-PCR技术检测的沉默效率。以饲喂30%糖水和ds作为空白对照和阴性对照。
选取荧光竞争结合试验中与AcerOBP7结合能力较强的气味物质于昆虫触角电位测量仪(Syntech,荷兰)上进行EAG试验。将再次采集的采粉蜂分别饲喂30%糖水和含有dsRNA的30%糖水,选取最佳干扰时间进行EAG试验。
待测气味物质的终浓度为300 μg·μL-1。剪取长3 cm,宽1 cm条状滤纸,折叠成“V”形后塞入巴斯德管内。调好EAG系统后,用手术刀片随机将蜜蜂一侧触角自基部切下,轻轻切除触角两尖端的小部分,用导电胶将触角固定在金属电极上,将安装好的触角与气流端口垂直放置。待屏幕上显示的基线稳定后,吸取10 μL配置好的待测样品均匀滴加在巴斯德管内的滤纸条上(测试前后以液体石蜡为对照)。每次刺激时间为0.5 s,刺激间隔为30 s。每种气味物质至少重复测定10根触角。
1.9 数据分析
试验数据经Excel初步记录整理后,采用SPSS 26.0统计软件进行分析,两组间比较采用独立样本检验,多组间比较采用单因素方差分析,处理组间两两比较采用Duncan法。将数据录入Graphpad Prism 8.0软件中进行作图。
2 结果
2.1 AcerOBP7表达谱分析
在工蜂不同发育阶段触角中均有表达,且在20日龄的表达量最高,极显著高于其他日龄(<0.01);在1日龄触角中表达量最低,极显著低于其他日龄(图1)。在采集蜂各组织中均能检测到的表达,但表达量存在显著差异,其中触角的表达量最高,极显著高于其他组织(<0.01);除足部外的其他组织均呈微量表达,且表达量差异不显著(>0.05)(图2)。
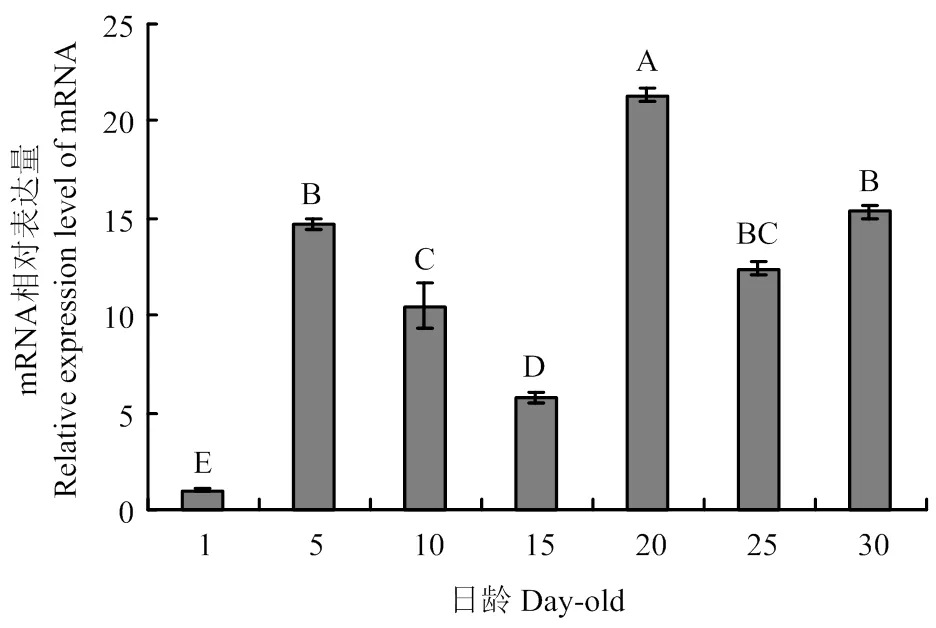
组间无相同字母表示差异极显著(P<0.01)。图2同
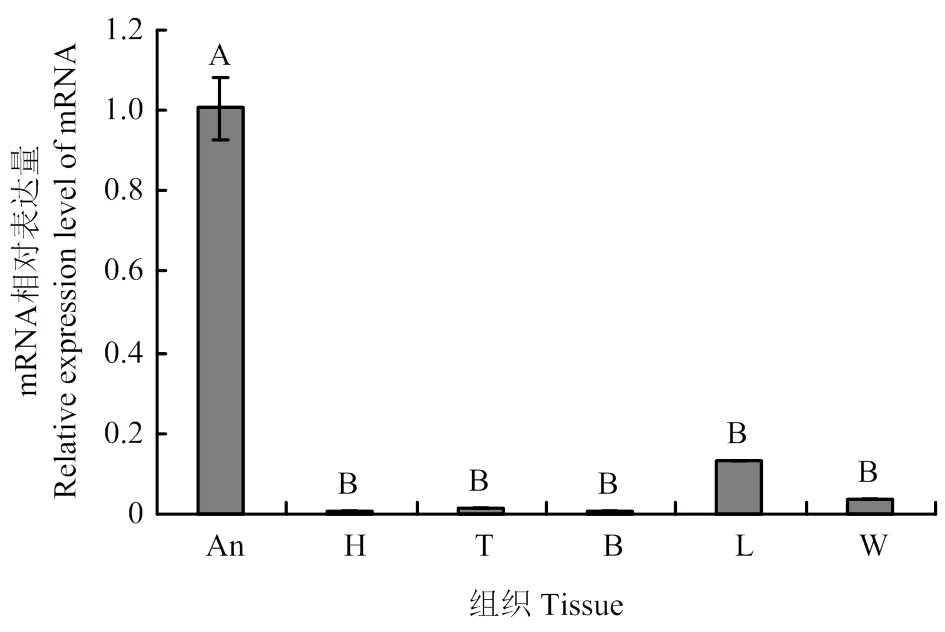
An:触角Antenna;H:头Head;T:胸Thorax;B:腹Abdomen;L:足Leg;W:翅Wing
2.2 AcerOBP7的原核表达和纯化
重组质粒pET28a/AcerOBP7经测序鉴定正确无误后转入表达菌株BL21(DE3),经IPTG诱导出目的蛋白。SDS-PAGE电泳检测目的蛋白主要以包涵体形式表达,通过尿素变性、纯化及透析复性后用凝血酶切除 His-tag,对切除标签后的蛋白进行再次纯化,纯化后的蛋白预测分子量约为14 kD。电泳结果显示在预期的位置出现单一清晰的条带,说明分离的蛋白纯度较高,可用于后续荧光竞争结合试验(图3)。
2.3 AcerOBP7的荧光结合试验
采用Bradford蛋白浓度测定法测定纯化后AcerOBP7的蛋白浓度为0.071 mg·mL-1。通过Scachard方程对AcerOBP7与1-NPN的结合曲线进行线性化处理,计算出二者的结合常数Kd=3.18 µmol·L-1(图4-a),可以看出目的蛋白与荧光探针间具有较好的结合活性。测定了AcerOBP7与37种气味化合物的结合能力(表2),解离常数越小,表示蛋白与气味分子间的结合能力越强。结果显示,AcerOBP7可以与蜂王信息素、告警信息素、那氏信息素及多种植物挥发性气味分子结合,其中,结合能力最强的是蜂王信息素9-ODA及植物挥发物1-壬醇,Ki值均为1.85 µmol·L-1,其次AcerOBP7与(+)-柠檬烯、(+)-3-蒈烯、1-辛烯-3-醇、芳樟醇、桉树脑、反式肉桂酸乙酯及壬醛也有较强的结合活性,Ki 值分别为1.87、4.14、2.66、2.72、3.88、3.05和 4.40 µmol·L-1,与所测试的7种幼虫信息素组分无结合能力。图4-b为AcerOBP7与部分气味物质的结合曲线。
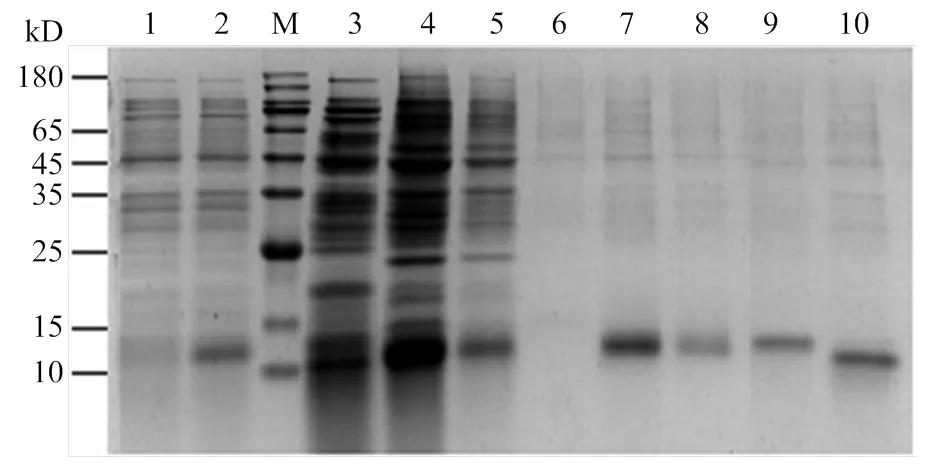
M:蛋白分子量标准Protein marker;1:IPTG诱导前pET28a/AcerOBP7 before induced by IPTG;2:IPTG诱导后pET28a/AcerOBP7 after induced by IPTG;3:超声破碎后离心的上清液Centrifugal supernatant after ultrasonication;4:超声破碎后离心的沉淀Centrifugal precipitation after ultrasonication;5:蛋白流穿液Protein waste liquid;6:洗杂流穿液Washing waste liquid;7—9:分别为50、100和300 mmol·L-1咪唑溶液洗脱后的AcerOBP7 AcerOBP7 eluted with 50, 100 and 300 mmol·L-1 imidazole solution, respectively;10:切除His标签后纯化的AcerOBP7 Purified AcerOBP7 without His-tag
2.4 RNAi沉默效果
以饲喂dsRNA后24 h糖水组的表达量为基准,分析饲喂不同dsRNA后在不同时间表达量的变化,从而确定最佳干扰条件。由图5可以看出,设计的两个dsRNA片段均能在不同程度上沉默的表达水平。
在饲喂dsRNA 24、48、72和96 h后,的表达量均显著低于糖水组和ds组(<0.05)。其中,ds沉默效率更强,且最佳干扰时间为饲喂后48 h,沉默效率达70.63%(图5)。
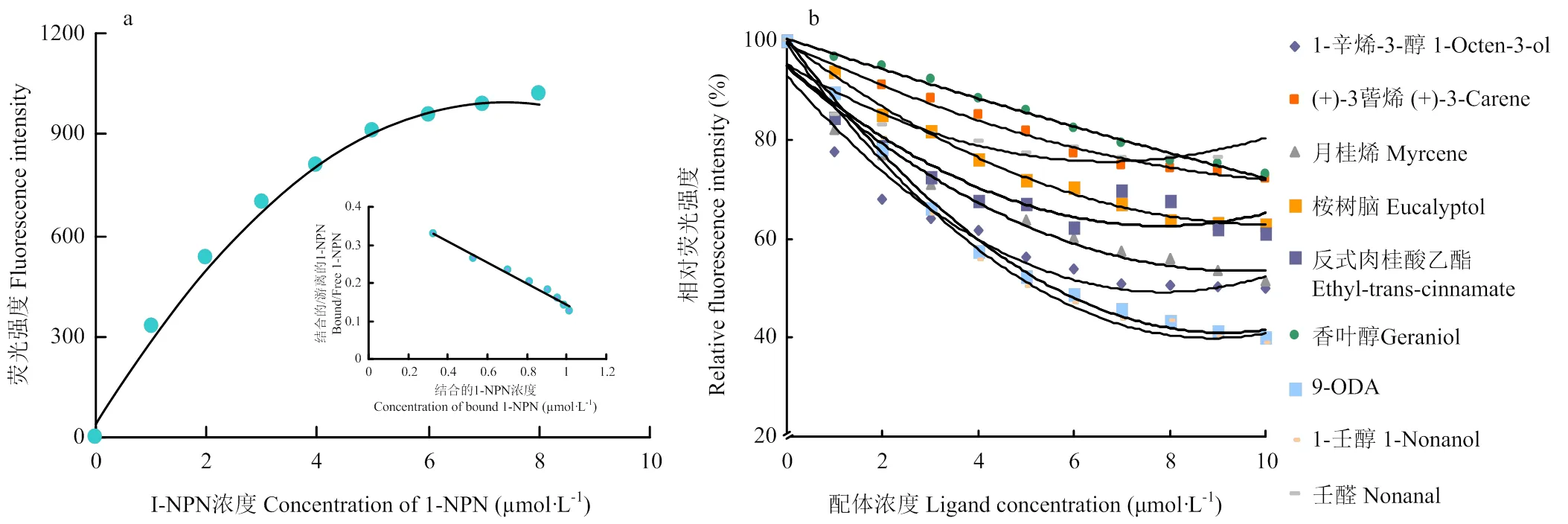
a:1-NPN 与AcerOBP7的结合及Scatchard分析The binding result and relative Scatchard plot of 1-NPN with AcerOBP7;b:AcerOBP7与部分气味物质的竞争结合曲线Competitive binding curves of AcerOBP7 to some of the odorant compounds
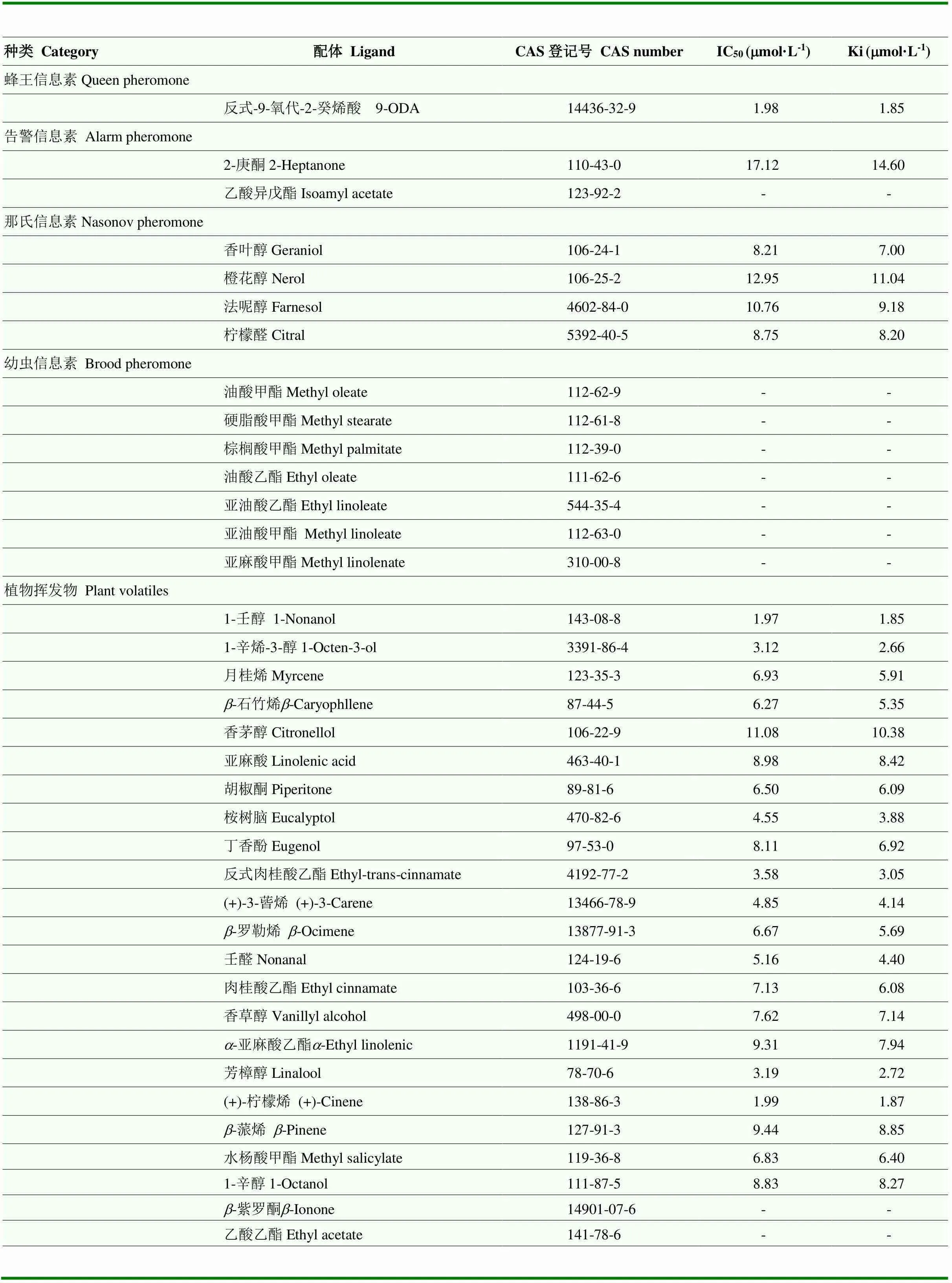
表2 气味物质与AcerOBP7的结合数据
“-”表示不能计算出IC50值“-” indicates that the IC50value can’t be calculated
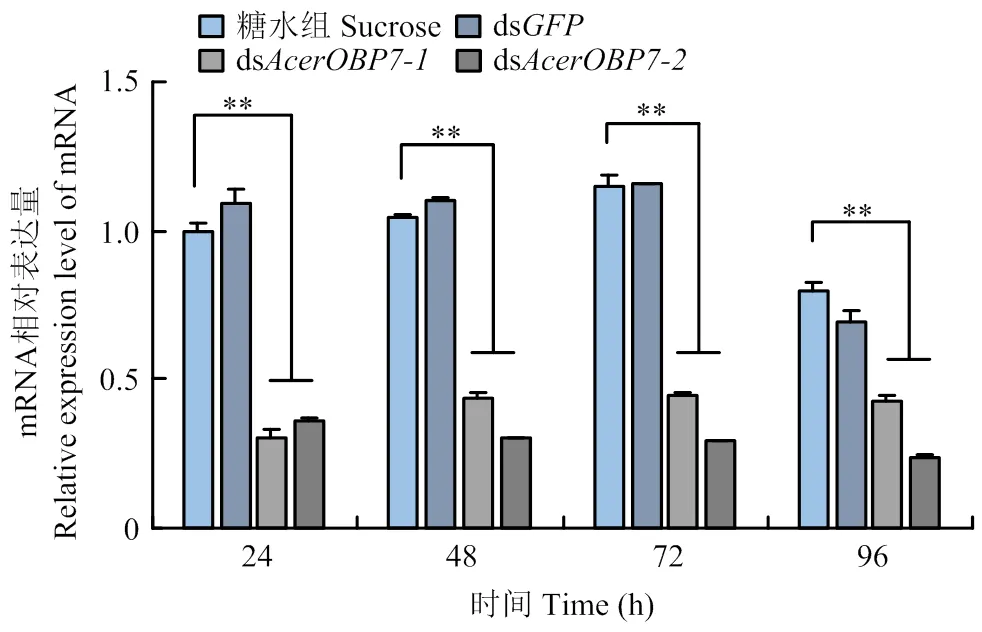
**:P<0.01,组间差异极显著extremely significant differences between groups;*:P<0.05,组间差异显著Significant differences between groups。图6同The same as Fig. 6
2.5 AcerOBP7干扰后的EAG反应
根据荧光竞争结合试验的结果,筛选出(+)-3-蒈烯、1-壬醇、(+)-柠檬烯、芳樟醇、桉树脑、反式肉桂酸乙酯、1-辛烯-3-醇、壬醛和9-ODA,共9种与AcerOBP7结合能力较强的气味物质用于后续EAG试验。
依据RNAi干扰效率的分析,选取沉默效率较高的dsRNA片段(ds)及最佳干扰时间(48 h)对目的基因再次进行沉默。结果显示(图6),工蜂触角对1-辛烯-3-醇和壬醛的反应较强烈;与30%糖水组相比,饲喂dsRNA后干扰组的EAG相对值均有所下降,其中,触角对桉树脑、1-辛烯-3-醇和9-ODA的EAG值极显著降低(<0.01),对壬醛的EAG值显著降低(<0.05),说明这4种物质与AcerOBP7结合的特异性较好。
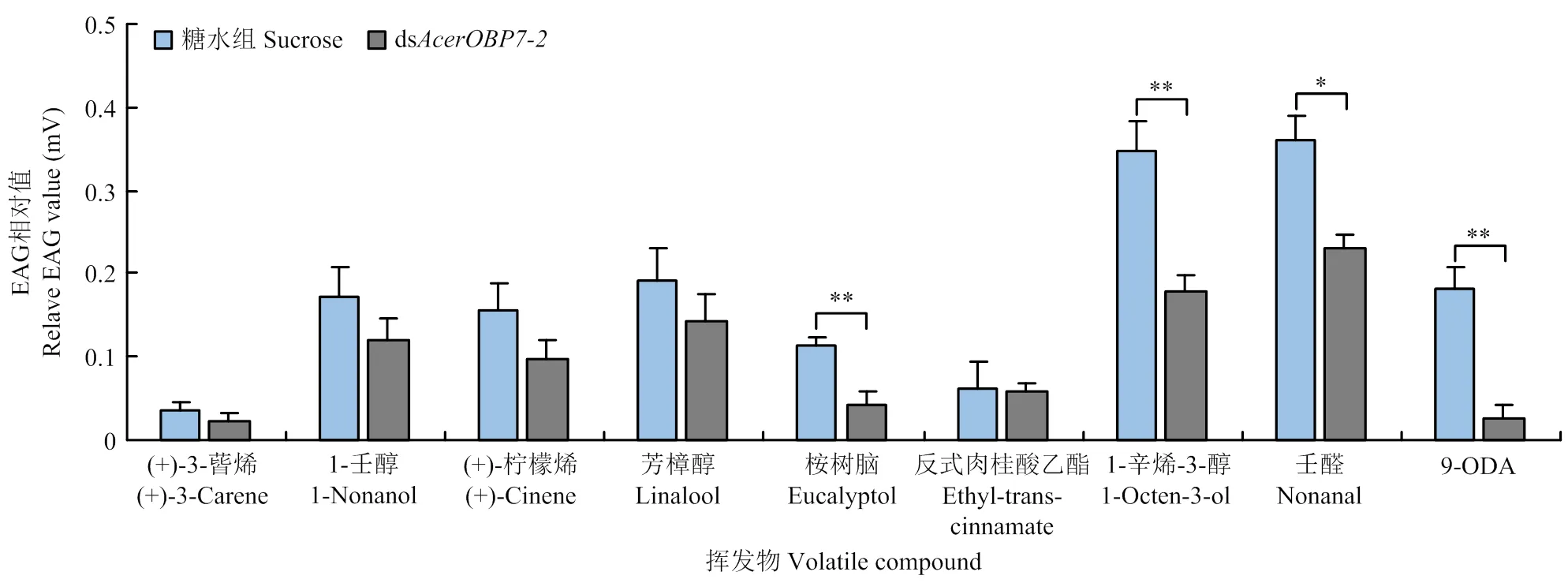
图6 饲喂dsAcerOBP7后触角对不同挥发物的EAG反应
3 讨论
3.1 AcerOBP7 mRNA在采集蜂触角中高表达
蜜蜂是真社会性昆虫,蜂群里的蜂王、雄蜂和工蜂各司其职,分工明确。工蜂随其日龄增长和外界蜜粉源变化情况执行不同的任务。一般来说,从事巢内哺育、清理等工作的工蜂称为内勤蜂,出巢采集花粉、花蜜和水等的工蜂称为采集蜂[28]。本研究荧光定量分析结果显示,在工蜂触角中的表达量极显著高于其他组织,与西方蜜蜂同源基因的表达模式一致[13]。另外,在不同发育阶段的工蜂触角中均有表达,且20日龄时表达量最高。这一时期的工蜂正处于壮年期,采集力旺盛[29],初步推测在中蜂的采集行为中发挥作用;在1日龄时表达水平最低,可能是由于蜜蜂嗅觉神经元在其羽化后2 d才开始成熟,导致嗅觉基因表达量低[30]。为进一步探讨在采集蜂中可能发挥的作用,测定了其在采集蜂不同组织中mRNA的相对表达量,发现在采集蜂触角中表达量极显著高于其他组织。触角是昆虫主要的嗅觉器官[31],因此推测该基因与采集蜂执行嗅觉功能相关。
3.2 AcerOBP7是一种广谱型气味结合蛋白
昆虫气味结合蛋白(OBP)可以广泛识别并转运多种类型的气味化合物。荧光竞争结合试验是目前研究OBP结合特性与功能较基础和经典的方法,在棉铃虫、铜绿丽金龟()、绿盲蝽()、小菜蛾()、斑翅果蝇()等昆虫中得到了广泛的应用[32-34]。AcerOBP7能够与蜂王信息素、告警信息素、那氏信息素以及植物挥发物等多种气味配体物质结合,表明该蛋白是一种广谱型结合蛋白,与先前报道的AcerASP1(AcerOBP1)、AcerOBP10、AcerOBP11、AcerOBP14、AcerOBP15的结合特性类似,其中AcerASP1与AcerOBP10是以信息素结合为主的多功能结合蛋白[25,35-38]。这些对中蜂OBP的研究也印证了一个观点:同一个OBP基因可能调控昆虫对多种挥发物的识别过程[39]。但是,上述OBP均是在工蜂触角中表达量较高的基因,在其他组织高表达的OBP是否也具有类似的功能,还有待进一步研究。
在本试验测试的37种气味物质中,与AcerOBP7结合能力最强的是9-ODA和1-壬醇,其次为(+)-柠檬烯等植物挥发物。9-ODA是蜂群中蜂王上颚腺分泌的蜂王信息素的主要活性成分,可以引诱雄蜂的追踪和交配,吸引工蜂形成侍从圈,抑制工蜂卵巢发育,还能够激励工蜂出巢采集食物[31];1-壬醇是桉树蜜等的挥发物成分之一[40];(+)-柠檬烯是一种优良的天然植物精油[41]。通过荧光竞争结合试验结果推测工蜂通过识别这些气味物质,进而从事采集、哺育蜂王等工作。
3.3 AcerOBP7在中蜂采集和哺育蜂王行为中行使其嗅觉功能
利用RNAi技术可使靶标基因在mRNA水平被有效沉默,是一种高效的研究基因功能的试验手段,主要实施方法有注射、浸泡、饲喂等,其中饲喂法是通过给昆虫饲喂含有人工合成或微生物体内合成的dsRNA食物以达到目的基因沉默的方法,该方法对昆虫机械损伤小,简便易行[42-43]。RNAi已在黑腹果蝇()、蜘蛛、布氏锥虫()等生物体上得到了广泛应用[44-46],在蜜蜂功能研究中也相继采用了该技术。由于蜜蜂以花蜜为食,各种物质可由肠道吸收进入血淋巴,从而使得蜜蜂可以采用饲喂方法实现对目的基因的沉默。有研究表明,通过饲喂dsRNA对意大利蜜蜂进行沉默,目的基因的表达量显著降低[47];郭丽娜等[48]通过饲喂不同的dsRNA片段,筛选出了中蜂气味受体基因的有效干扰序列。本试验中,饲喂不同片段的dsRNA后,mRNA表达水平与对照组相比显著降低,说明dsRNA的摄入可以有效干扰目的基因的表达,促进了AcerOBP7的功能研究。
EAG技术已应用于多种昆虫对环境中气味物质反应强度的检测试验[49-51]。为进一步探讨的嗅觉生理功能,依据荧光竞争结合试验及RNAi的结果,测定并分析了中蜂触角对9种气味物质的EAG数据,发现在饲喂ds后,触角对桉树脑、1-辛烯-3-醇、9-ODA和壬醛的EAG反应值均显著性降低,说明这4种物质与AcerOBP7之间不仅结合力较强,而且结合的特异性较好,很可能为AcerOBP7的配体物质。另外,因为9-ODA是蜂王信息素的重要组分,其余3种物质为植物挥发物成分,推测与工蜂出巢采集和哺育蜂王的行为密切相关。
蜜蜂是自然界中十分重要的授粉昆虫,其生物学行为受环境中多种化学物质的协同影响,可以通过对蜜蜂OBP功能的研究,将多种单一挥发性物质按比例配置[52-53],再结合生物信息学手段(如分子对接)、行为学试验(如趋避或吸引)、大田试验等,共同探讨植物挥发物或花香物质与蜜蜂行为的关系,从而为蜂群高效饲养及授粉提供新的思路。
4 结论
在中蜂采集蜂触角中高表达,且AcerOBP7可以与蜂王信息素9-ODA及多种植物挥发性物质结合,推测其可能在工蜂采集、饲喂蜂王等行为中发挥重要作用。蜂王信息素9-ODA和植物挥发物桉树脑、1-辛烯-3-醇、壬醛可能是AcerOBP7蛋白的配体分子。
[1] ZWIEBEL L J, TAKKEN W. Olfactory regulation of mosquito-host interactions. Insect Biochemistry and Molecular Biology, 2004, 34(7): 645-652.
[2] ZHAO H, GAO P, DU H, MA W, TIAN S, JIANG Y. Molecular characterization and differential expression of two duplicated odorant receptor genes,and,in. Journal of Genetics, 2014, 93(1): 53-61.
[3] PELOSI P, ZHOU J J, BAN L P, CALVELLO M. Soluble proteins in insect chemical communication. Cellular and Molecular Life Sciences, 2006, 63(14): 1658-1676.
[4] LEAL W S. Odorant reception in insects: roles of receptors, binding proteins, and degrading enzymes. Annual Review of Entomology, 2013, 58: 373-391.
[5] ZHAO H X, ZENG X N, LIANG Q, ZHANG X F, HUANG W Z, CHEN H S, LUO Y X. Study of thegene inand. Genetics and Molecular Research, 2015, 14(2): 6482-6494.
[6] RADLOFF S E, HEPBURN C, HEPBURN H R, FUCHS S, HADISOESILO S, TAN K, ENGEL M S, KUZNETSOV V. Population structure and classification of. Apidologie, 2010, 41(6): 589-601.
[7] PELOSI P, Maida R. Odorant-binding proteins in insects. Comparative Biochemistry and Physiology, 1995, 111(3): 503-514.
[8] VOGT R G, CALLAHAN F E, ROGERS M E, DICKENS J C. Odorant binding protein diversity and distribution among the insect orders, as indicated by LAP, an OBP-related protein of the true bug(Hemiptera, Heteroptera). Chemical Senses, 1999, 24(5): 481-495.
[9] ZHANG J, WANG B, DONG S, CAO D, DONG J, WALKER W B, LIU Y, WANG G. Antennal transcriptome analysis and comparison of chemosensory gene families in two closely related noctuidae moths,and. PLoS ONE, 2015, 10(2): e0117054.
[10] WEI H S, LI K B, ZHANG S, CAO Y Z, YIN J. Identification of candidate chemosensory genes by transcriptome analysis in(Linnaeus). PLoS ONE, 2017, 12(4): e0174036.
[11] HE X, HE Z B, ZHANG Y J, ZHOU Y, XIAN P J, QIAO L, CHEN B. Genome-wide identification and characterization of odorant-binding protein (OBP) genes in the malaria vector(Diptera: Culicidae). Insect Science, 2016, 23(3): 366-376.
[12] WANG B, CAO S, LIU W, WANG G. Effect of OBPs on the response of olfactory receptors. Methods in Enzymology, 2020, 642: 279-300.
[13] VENTHUR H, ZHOU J J. Odorant receptors and odorant-binding proteins as insect pest control targets: a comparative analysis. Frontiers in Physiology, 2018, 9: 1163.
[14] FORET S, MALESZKA R. Function and evolution of a gene family encoding odorant binding-like proteins in a social insect, the honey bee (). Genome Research, 2006, 16(11): 1404-1413.
[15] SPPINELLI S, LAGARDE A, IOVINELLA I, LEGRAND P, TEGONI M, PELOSI P, CAMBILLAU C. Crystal structure ofOBP14, a C-minus odorant-binding protein, and its complexes with odorant molecules. Insect Biochemistry and Molecular Biology, 2012, 42: 41-50.
[16] ZHAO H, DU Y, GAO P, WANG S, PAN J, JIANG Y. Antennal transcriptome and differential expression analysis of five chemosensory gene families from the Asian honeybee. PLoS One, 2016, 11(10): e0165374.
[17] LOVINELLA I, CAPPA F, CINI A, PETROCELLI I, CERVO R, TURILLAZZI S, DANI F R. Antennal protein profile in honeybees: caste and task matter more than age. Frontiers in Physiology, 2018, 9: 748.
[18] PELOSI P, LOVINELLA I, ZHU J, WANG G, DANI F R. Beyond chemoreception: diverse tasks of soluble olfactory proteins in insects. Biological Reviews of the Cambridge Philosophical Society, 2018, 93(1): 184-200.
[19] DONG K, SUN L, LIU J T, GU S H, ZHOU J J, YANG R N, DHILOO K H, GAO X W, GAO Y Y, ZHANG Y J. RNAi-induced electrophysiological and behavioral changes reveal two pheromone binding proteins ofinvolved in the perception of the main sex pheromone component Z11-16:Ald. Journal of Chemical Ecology, 2017, 43(2): 207-214.
[20] AI H, LIU Y, LONG G, YUAN Y, HUANG S, CHEN Y. Functional characteristics of a novel odorant binding protein in the legume pod borer,. Scientific Reports, 2021, 11(1): 14027.
[21] 秦健辉, 李金桥, 赵旭, 李克斌, 曹雅忠, 尹姣. 铜绿丽金龟气味结合蛋白AcorOBP11的表达纯化及功能分析. 中国农业科学, 2021, 54(14): 3017-3028.
QIN J H, LI J Q, ZHAO X, LI K B, CAO Y Z, YIN J. Expression, purification and functional analysis of odorant binding protein 11 (OBP11) in. Scientia Agricultura Sinica, 2021, 54(14): 3017-3028. (in Chinese)
[22] LEAL W S, PARRA-PEDRAZZOLI A L, KAISSLING K E, MORGAN T I, ZALOM F G, PESAK D J, DUNDULIS E A, BURKS C S, HIGBEE B S. Unusual pheromone chemistry in the navel orangeworm: novel sex attractants and a behavioral antagonist. Naturwissenschaften, 2005, 92(3): 139-146.
[23] LEAL W S, BARBOSA R M, XU W, ISHIDA Y, SYED Z, LATTE N, CHEN A M, MORGAN T I, CORNEL A J, FURTADO A. Reverse and conventional chemical ecology approaches for the development of oviposition attractants for. PLoS One, 2008, 3(8): e3045.
[24] 吴帆. 中华蜜蜂气味结合蛋白配基结合特征和OBP12与吡虫啉结合机理研究[D]. 杭州: 中国计量大学, 2016.
WU F. Study binding characterization of Chinese honeybee’s () odorant binding proteins with ligands and binding mechanism of OBP12 with imidacloprid (Hymenoptera: Apidae)[D]. Hangzhou: China Jiliang University, 2016. (in Chinese)
[25] SONG X M, ZHANG L Y, FU X B, WU F, TAN J, LI H L. Various bee pheromones binding affinity, exclusive chemosensillar localization, and key amino acid sites reveal the distinctive characteristics of odorant-binding protein 11 in the eastern honey bee,. Frontiers in Physiology, 2018, 9: 422.
[26] GUO D, HAO C, CUI X, WANG Y, LIU Z, XU B, GUO X. Molecular and functional characterization of the novel odorant- binding protein genefrom. Journal of Biochemistry, 2021, 169(2): 215-225.
[27] 陈艺杰, 李英娇, 张瑾, 缪晓青. 中华蜜蜂气味结合蛋白基因的克隆及序列分析. 生物技术, 2020, 30(4): 313-317.
CHEN Y J, LI Y J, ZHANG J, MIAO X Q. Cloning and sequence analysis of odorant-binding protein genefrom. Biotechnology, 2020, 30(4): 313-317. (in Chinese)
[28] GADENNE C, BARROZO R B, ANTON S. Plasticity in insect olfaction: To smell or not to smell? Annual Review of Entomology, 2016, 61: 317-333.
[29] 曾志将. 养蜂学. 北京: 中国农业出版社, 2009: 28-45.
ZENG Z J. Apiculture. Beijing: China agriculture press, 2009: 28-45. (in Chinese)
[30] MASSON C, ARNOLD G. Ontogeny, maturation, and plasticity of the olfactory system in the worker bee. Journal of Insect Physiology, 1984, 30(1): 7-14.
[31] 王钰冲, 陈伟文, 谭垦. 9-ODA对工蜂卵巢的抑制. 蜜蜂杂志, 2013(3): 4-5.
WANG Y C, CHEN W W, TAN K. The inhibition of 9-ODA to worker bee’s ovary. Journal of Bee, 2013(3): 4-5. (in Chinese)
[32] 蒋欣. 麦长管蚜气味结合蛋白原核表达及结合特性分析[D]. 北京: 中国农业科学院, 2018.
JIANG X. Expression and binding specificity analysis of odorant binding proteins in the grain aphid(Fabricius)[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. (in Chinese)
[33] 李都, 牛长缨, 李峰奇, 罗晨. 斑翅果蝇气味结合蛋白OBP56h与小分子化合物的结合特征. 中国农业科学, 2019, 52(15): 2616-2623.
LI D, NIU C Y, LI F Q, LUO C. Binding characterization of odorant binding protein OBP56h inwith smell molecular compounds. Scientia Agricultura Sinica, 2019, 52(15): 2616-2623. (in Chinese)
[34] 彭竹, 黄丽, 赵慧婷. 荧光竞争结合技术在昆虫嗅觉相关蛋白结合能力检测上的应用. 激光生物学报, 2020, 29(2): 106-112.
PENG Z, HAUNG L, ZHAO H T. Application of fluorescence competitive binding technology in detection of the binding ability of insects olfactory related proteins. Acta Laser Biology Sinica, 2020, 29(2): 106-112. (in Chinese)
[35] 翁琛, 张林雅, 赵磊, 付余霞, 罗晨, 李洪亮. 中华蜜蜂性信息素结合蛋白 ASP1 的原核表达及配基结合特性分析. 昆虫学报, 2013, 56(10): 1110-1116.
WENG C, ZHANG L Y, ZHAO L, FU Y X, LUO C, LI H L. Prokaryotic expression and ligand binding characteristics of pheromone binding protein ASP1 in the Chinses honeybee (). Acta Entomologica Sinica, 2013, 56(10): 1110-1116. (in Chinese)
[36] 吴帆, 黄君君, 谭静, 唐明珠, 李红亮. 中华蜜蜂信息素结合蛋白OBP10的基因克隆、原核表达和配基结合特性分析. 昆虫学报, 2016, 59(1): 25-32.
WU F, HUANG J J, TAN J, TANG M Z, LI H L. Molecular cloning, prokaryotic expression and ligand-binding characterization of a novel pheromone binding protein OBP10 in(Hymenoptera: Apidae). Acta Entomologica Sinica, 2016, 59(1): 25-32. (in Chinese)
[37] DU Y L, XU K, ZHAO H T, JIANG Y S, LI H Q. Identification and functional characterization offrom(Hymenoptera: Apidae). Apidologie, 2021, 52: 668-683.
[38] 彭竹, 黄丽, 赵淑果, 吕建华, 赵慧婷. 中华蜜蜂气味结合蛋白AcerOBP14的表达及配体结合特性分析. 昆虫学报, 2021, 64(2): 178-186.
PENG Z, HUANG L, ZHAO S G, LÜ J H, ZHAO H T.Expression and ligand binding characterization of the odorant binding protein AcerOBP14 of. Acta Entomologica Sinica, 2021, 64(2): 178-186. (in Chinese)
[39] SUN S F, ZENG F F, YI S C, WANG M Q. Molecular screening of behaviorally active compounds with CmedOBP14 from the rice leaf folder. Journal of Chemical Ecology, 2019, 45: 849-857.
[40] 黄京平, 郭伟华. 利用固相微萃取方法分析蜜源植物的挥发性化合物. 中国蜂业, 2014, 65(5): 59-60.
HAUNG J P, GUO W H. Analysis of volatile compounds in honey plants by solid phase microextraction. Apiculture of China, 2014, 65(5): 59-60. (in Chinese)
[41] 关天旺, 刘嘉煜. 柠檬烯的防腐作用及抑菌机理研究进展. 保鲜与加工, 2015, 15(6): 83-87.
GUAN T W, LIU J Y. Research progress on preservative activity and antimicrobial mechanism of limonene. Storage and Process, 2015, 15(6): 83-87. (in Chinese)
[42] 于荣荣, 丁国伟, 杨美玲, 马恩波, 张建珍. 注射dsRNA对飞蝗基因在mRNA和蛋白水平的沉默效率. 昆虫学报, 2016, 59(12): 1395-1400.
YU R R, DING G W, YANG M L, MA E B, ZHANG J Z. Silence efficiency of mRNA and protein expression ofin(Orthoptera: Acridiae) by dsRNA injection. Acta Entomologica Sinica, 2016, 59(12): 1395-1400. (in Chinese)
[43] 李晨雨, 裴新国, 张伊杰, 高聪芬. RNAi技术在昆虫防控研究中的应用和发展前景. 现代农药, 2021, 20(1): 1-6.
LI C Y, PEI X G, ZHANG Y J, GAO C F. Application and development prospect of RNAi technology in pest control. Modern Agrochemicals, 2021, 20(1): 1-6. (in Chinese)
[44] BROWN S J, MANAFFEY J P, LORENZEN M D, DENELL R E, MAHAFFEY J W. Using RNAi to investigate orthologous homeotic gene function during development of distantly related insects. Evolution and Development, 1999, 1(1): 11-15.
[45] SCHOPPMEIER M, DAMEN W G. Double-stranded RNA interference in the spider: the role ofis evolutionarily conserved in arthropod appendage formation. Development Genes and Evolution, 2001, 211(2): 76-82.
[46] LACOIJNT D J, BRUSE S, HILL K L, DONELSON J E. Double-stranded RNA interference inusing head-to-head promoters. Molecular and Biochemical Parasitology, 2000, 111(1): 67-76.
[47] 陈艺杰. 中华蜜蜂和意大利蜜蜂基因的克隆、时空表达及功能分析[D]. 福州: 福建农林大学, 2017.
CHEN Y J. Molecular cloning, spatiotemporal expression and functional analyses of thegenes inand[D]. Fuzhou: Fujian Agriculture and Forestry University, 2017. (in Chinese)
[48] 郭丽娜, 赵慧婷, 任有蛇, 徐兵, 姜玉锁. 中华蜜蜂气味受体基因RNA最佳干扰片段的筛选. 环境昆虫学报, 2020, 42(5): 1068-1075.
GUO L N, ZHAO H T, REN Y S, XU B, JIANG Y S. Construction of RNA interference plasmid targeting ofand optimal interference efficiency determination. Journal of Environmental Entomology, 2020, 42(5): 1068-1075. (in Chinese)
[49] 徐伟, 马延旭, 张益恺, 董亚南, 孙晓玲. 中华弧丽金龟甲对十二种常见植物挥发物的触角电位和嗅觉反应. 植物保护学报, 2018, 45(5): 1028-1034.
XU W, MA Y X, ZHANG Y K, DONG Y N, SUN X L.Electroantennographic and behavioral responses of four spotted beetleto 12 plant volatiles. Journal of Plant Protection, 2018, 45(5): 1028-1034. (in Chinese)
[50] 刘爱华, 孔婷婷, 张静文, 温俊宝, 焦淑萍. 苹果小吉丁虫对病虫害诱导野苹果树挥发物触角电位和行为反应. 浙江农林大学学报, 2020, 37(6): 1149-1158.
LIU A H, KONG T T, ZHANG J W, WEN J B, JIAO S P. Electroantennogram and behavioral responses ofto the volatiles fromtrees induced by pest and disease. Journal of Zhejiang A&F University, 2020, 37(6): 1149-1158. (in Chinese)
[51] 林方辉, 童应华. 椰心叶甲对植物挥发化合物的触角电位与行为反应. 森林与环境学报, 2019, 39(2): 214-219.
LIN F H, TONG Y H.Electrophysiological and behavioral responses ofto plant volatile compounds. Journal of Forest and Environment, 2019, 39(2): 214-219. (in Chinese)
[52] MCCormickA C, UNSICKER S B, GERSHENZON J. The specificity of herbivore-induced plant volatiles in attracting herbivore enemies. Trends in Plant Science, 2012, 17(5): 303-310.
[53] 林健, 刘文波, 孟昭军, 严善春. 缓释单萜类挥发物对落叶松毛虫行为及落叶松主要防御蛋白的影响. 生态学报, 2014, 34(11): 2978-2985.
LIN J, LIU W B, MENG Z J, YAN S C. Monoterpene volatiles affecting host selection behavior ofand the activities of defense protein in larch needles.Acta Ecologica Sinica, 2014, 34(11): 2978-2985. (in Chinese)
Expression and binding properties of odorant binding protein AcerOBP7 in
ZHAO HuiTing1*, Peng Zhu1, JIANG YuSuo1, Zhao ShuGuo1, Huang Li1, Du YaLi2, GUO LiNa2
1College of Life Sciences, Shanxi Agricultural University, Taigu 030801, Shanxi;2College of Animal Science, Shanxi Agricultural University, Taigu 030801, Shanxi
【Objective】is the indigenous bee of China, which is also one of the important pollinator and economic insect. Odorant binding proteins (OBPs) are the key proteins in the olfactory perception of. Based on the previous analysis about the sequence characteristics of, the present study intends to further research its expression profiles and binding properties, so as to provide basic data for revealing the role of OBPs in the olfactory system of.【Method】In this paper, qRT-PCR was used to detect the spatio-temporal expression characteristics ofAcerOBP7 protein was obtained by prokaryotic expression system, and the recombinant protein was purified using Ni-NTA column. Competitive fluorescence binding method was adopted, with 1-NPN (N-phenyl-1-naphthylamine) was used as a fluorescent probe, to determine the binding affinity of AcerOBP7 with pheromone and plant volatiles. dswas designed and synthesized, and the gene was silenced by feeding method, the silencing efficiency was detected by qRT-PCR. Combined with RNAi method, EAG was conducted to test and compare the difference of response values of AcerOBP7 to the candidate volatiles between the control and RNAi group.【Result】qRT-PCR results showed thatexpressed significantly higher in the antennae of worker bees than that in other tissues (<0.01), and the expression reached to the highest level at 20-day-old and the lowest at 1-day-old. The pET28a/AcerOBP7 expression vector was successfully constructed, and the high-purity recombinant protein was obtained using theprokaryotic expression system. Fluorescence competition binding assay showed that AcerOBP7 had the strongest binding affinities with 9-ODA and 1-nonanol among 37 ligand molecules, with the Ki values was both 1.85 µmol·L-1, followed by (+)-limonene, 1-octene-3-ol, linalool, trans-ethyl-cinnamate, eucalyptol, (+)-3-carene and nonanal, and the Ki values were 1.87, 2.66, 2.72, 3.05, 3.88, 4.14 and 4.40 µmol·L-1, respectively, while AcerOBP7 had no binding ability with all the tested larval pheromone components.was successfully silenced by feeding dsRNA, and the highest interference efficiency could reach to 70.63%. The results of EAG assay after RNAi showed that the EAG values response to the tested odorant chemicals were all decreased, and the relative EAG values of 1-octen-3-ol, nonanal, eucalyptol and 9-ODA decreased significantly (<0.05).【Conclusion】is highly expressed in antennae of the forager bees and the recombinant protein can bind to a variety of odor molecules, suggesting that AcerOBP7 is a binding protein with broad spectrum, which may play an important role in the foraging behavior and feeding the queen of the worker bees. In addition, 1-octen-3-ol, nonanal, eucalyptol and 9-ODA are the ligands with high binding specificity to AcerOBP7.
; odorant binding protein (OBP); expression profile; protein purification; binding property
2021-07-28;
2021-08-30
国家自然科学基金青年科学基金(31502021)、山西农业大学校青年科技创新(2019003)
赵慧婷(通信作者),E-mail:zhaohting@126.com。彭竹,E-mail:pzhu66@126.com。赵慧婷和彭竹为同等贡献作者
(责任编辑 岳梅)
