高通量测序分析镉污染土壤原位修复中细菌群落的研究
2022-03-04聂衍韬
聂衍韬,黄 聪
(中南安全环境技术研究院股份有限公司,湖北 武汉 430062)
1 引言
微生物在农田生态系统中起着至关重要的作用,它不仅作用于农作物的生长,也容易受外界环境影响而改变[1,2]。通常情况下,在农田土壤原位修复的过程中,修复处理工艺会引起微生物群落的变化,进而影响农田生态系统的稳定性[3,4]。以重金属污染农田土壤原位修复工程为例,市面上常用的修复剂主要为无机、有机和微生物三类。众多工程案例已证明它们对镉(Cd)有良好的稳定作用,但是这些处理方法对Cd污染土壤中微生物的影响尚不明确。
本研究以湖北省黄石市市郊的Cd污染农田土壤为对象,采用高通量测序技术对无机、有机和微生物等3种不同土壤修复剂处理下Cd污染土壤的细菌群落进行解析,以探究细菌群落对不同土壤修复剂的响应变化,揭示不同细菌群落与有效态Cd含量的关系,期望为后续寻找新的微生物修复方法提供理论参考。
2 材料与方法
2.1 土壤概况及处理工艺
Cd污染土壤来自湖北省黄石市市郊农田,土壤类型为岩泥田水稻土。经初步检测,试验土壤的pH值为6.5,总Cd含量为7.67 mg/kg。本试验中使用的有机、无机和微生物修复剂分别为生石灰-海泡石混合剂(CaO≥ 34%、pH=12)、生物炭(主要成分秸秆、鸡粪)和芽孢杆菌,皆为固态粉末修复剂。其中生物炭来自河南椰碳环保材料有限公司,生石灰-海泡石混合剂来自环保桥(湖南)生态环境工程股份有限公司,芽孢杆菌来自武汉丰甜生物科技有限公司。
本试验共设计4个处理,即对照组(不进行修复处理,CK);无机修复组(添加石灰-海泡石混合剂粉末,T1);有机修复组(添加生物炭粉末,T2);微生物修复组(添加芽孢杆菌粉末,T3),每个处理分别称取5 kg土壤,加入等量的除盐水和土壤修复剂均匀混合,土壤修复剂添加量为1%,各处理3次重复。将各组土壤移入实验玻璃容器中,随后将实验玻璃容器置于室外,模拟自然环境对土壤的影响。试验为期30 d。
2.2 样品收集和预处理
采用3点取样法收集试验后的土壤样品(500 g)。使用2 mm筛子过滤土壤样品,将过滤后土壤样品分为2份,1份储存于4 ℃下用于测定土壤中有效态Cd含量;1份储存于-80 ℃下用于DNA提取。
2.3 土壤有效态Cd的分析
土壤有效态Cd含量采用M3溶液(HOAc-NH4NO3-NH4F-HNO3-EDTA)浸提,后采用石墨炉原子吸收分光光度法测定。
2.4 DNA提取与高通量测序
DNA提取选用PowerSoil®土壤DNA提取试剂盒,按照其说明书要求进行采集。提取后的DNA使用0.8%琼脂糖凝胶电泳试剂盒评估其提取质量。将合格的DNA委托武汉华大基因科技有限公司完成扩增细菌16S rDNA基因V3-V4区域(338F:5′-ACTCCTACGGGAGGCAGCA-3′和806R:5′-GGACTACHVGGGTWTCTAAT-3′)和Illumina Miseq双端测序工作。
2.5 数据分析
使用USEARCH[5]软件在≥97%的相似度下,对获得的序列进行操作分类单元(operational taxonomic unit,OTU)的聚类、分析。通过比对亲缘关系的方法,注释每个OTU的分类学信息[6],比较分析土壤样品中细菌群落结构及组成。基于OTU数据计算各土壤样本的α-多样性指数及各注释水平的相对丰度。使用R软件对有效态Cd与主要属水平微生物的关系进行相关性分析。
有效态Cd及α-多样性指数数据分析均采用Excel软件(2016版本)进行处理,并使用SPSS软件进行组间方差分析,组间差异显著性水平P<0.05。
3 结果与讨论
3.1 不同处理方式对土壤细菌群落OTUs组成及多样性的影响
12个Illumina Miseq高通量测序土壤样品共产生319801条优质序列,平均每个样品18605~32003。稀释性曲线是判断样品测序结果是否能够反映样品实际微生物信息的分析方法。如图1所示,测序序列深度达到15000条以上,曲线趋于平坦,表明测序深度足够覆盖不同处理的土壤样品中绝大多数微生物种群信息。因此,根据样品的最低序列数进行抽平,对抽平后序列进行后续的细菌群落分析。
由表1可知,在本研究中,Chao1和ACE指数反映物种丰富度,Shannon、Simpson指数和系统发育多样性(phylogenetic diversity,PD)指数反映物种多样性。根据表1可知,4组土壤样品都具有较高的覆盖率(>99%)。CK组具有最高的Shannon指数、Simpson指数和PD指数,说明Cd污染土壤样品具有较高的物种多样性。除T1组外,T2和T3组Chao1指数和ACE指数(P<0.05)均显著低于CK组,说明T2和T3组会减少土壤细菌群落的物种丰富度,这与Li等[7]的研究结果相一致。其可能的原因是,石灰-海泡石属于无机物,主要是通过吸附作用和提升土壤的pH值以达到修复土壤的目的,短期内对细菌群落影响不大。而生物炭和芽孢杆菌处理直接作用于土壤微生物系统,提升了能稳定有效态Cd的一类细菌在系统中的优势,从而导致了其他细菌群落的减少,综合比较不同土壤修复剂处理后土壤细菌群落多样性,CK>T1>T2>T3。

图1 不同土壤修复剂处理后土壤细菌群落的稀疏曲线

表1 不同土壤修复剂处理后土壤细菌群落的α多样性指数
3.2 不同处理方式对土壤细菌群落结构的影响
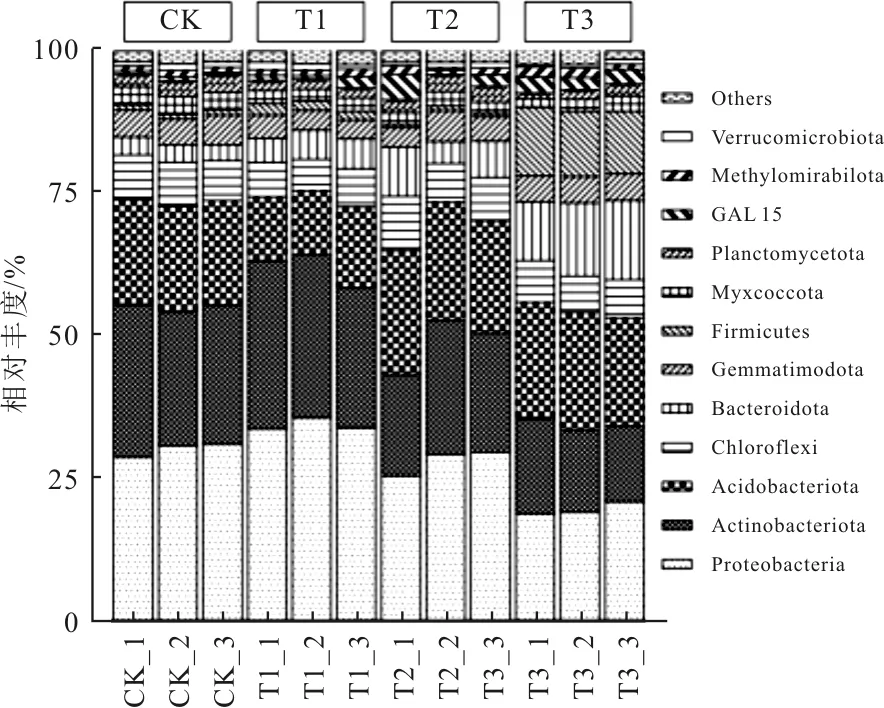
土壤微生物群落的结构容易受到重金属含量的影响,其可作为鉴定土壤修复进展的指标之一[8]。如图2所示,土壤样品中前10个优势菌门分别为变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、酸杆菌门(Acidobacteriota)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidota)、第四门(Gemmatimodota)、厚壁菌门(Firmicutes)、Myxococcota、浮霉菌门(Planctomycetota)、GAL15,其平均相对丰度分别为28.28%、21.93%、17.82%、7.03%、6.65%、4.31%、3.71%、2.37%、2.15%、1.67%。其中变形菌门、放线菌门和酸杆菌门是Cd污染土壤中主要的优势菌门,三者相对丰度之和接近70%左右。该结果与Pei等[9]的研究结果相似。
需要额外说明的是,T3组中厚壁菌门的相对丰度可达11.51%,远高于其他组,说明外源添加的芽孢杆菌可以在含Cd土壤中定殖[10]。
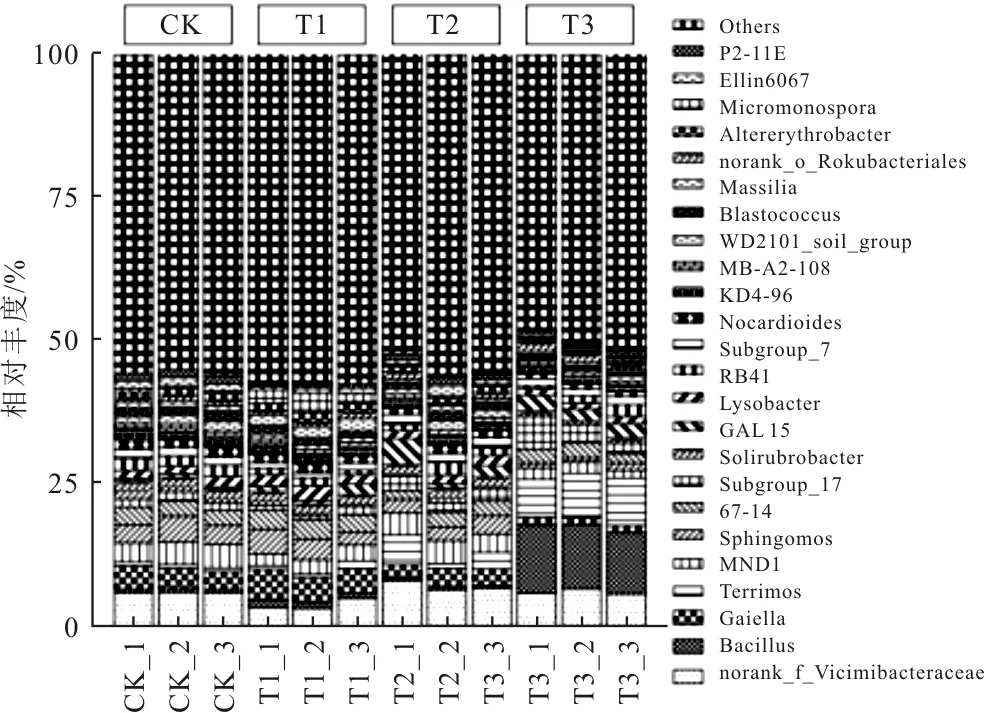
如图3可知,在属水平上,T1组中主要的优势菌属与CK组的优势菌属的种类较为相似,但两组中优势菌属的平均相对丰度存在明显差异。T2组中观察到Subgroup_17、Sphingomos等优势菌属的平均相对丰度变化显著。T3组最主要差异在于芽孢杆菌属(Bacillus),其平均相对丰度分别在T3组达到11.25%。值得注意的是,norank_f_Vicimbacteraceae在T2和T3组中平均相对丰度与CK组无明显差异,而在T1组的平均相对丰度仅为4.01%,比CK组降低了35.02%,说明石灰-海泡石处理会显著改变norank_f_Vicimbacteraceae在土壤中的丰度,可能与石灰使得pH值呈碱性有关。
注:Others表示相对丰度<1%的微生物合集
注:Others表示相对丰度 < 1%的微生物合集
3.3 有效Cd含量与主要差异属的关系
不同处理方式下的有效Cd含量见表2,随后用相关性分析的方法探究不同处理的差异属与有效Cd含量的关系。结果表明,有效Cd含量与MND1、Ellin6055、Lacunisphaera、P2-11E和UTCFX1呈正相关,无负相关的细菌属(P<0.05),相关系数见表3。
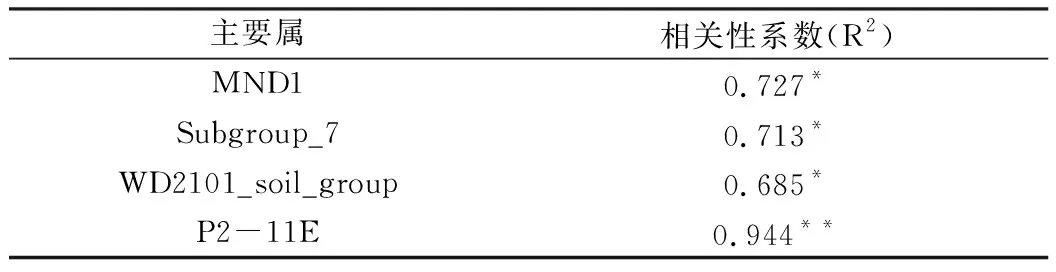
表3 有效Cd含量与主要差异属的关系的相关性系数
4 结论
(1)石灰-海泡石、生物炭和芽孢杆菌的处理均会影响土壤细菌群落的多样性,其中芽孢杆菌处理对土壤细菌群落的影响最显著。
(2)主要优势菌门组成为变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)和酸杆菌门(Acidobacteriota),不同处理方式对主要优势菌门结构影响差异明显,在属水平细菌群落组成差异较大。
(3)与有效Cd含量有关的微生物属主要是MND1、Ellin6055、Lacunisphaera、P2-11E和UTCFX1。
