电针对慢性炎性疼痛大鼠Wnt/β-catenin以及ERK/MAPK信号通路相关蛋白表达的影响*
2022-03-03桑亚男郭现辉王权亮张安东
桑亚男,郭现辉,董 升,王权亮,张安东,闫 瑞
(1.河南中医药大学第三附属医院 郑州 450000;2.河南省中医药研究院附属医院 郑州 450000;3.阜外华中心血管病医院 郑州 450000)
慢性炎症疼痛是临床上最常见的病理性疼痛之一,引起的持续性疼痛会对患者身心造成严重影响。慢性疼痛的经历会影响个体的生理状态,即使在疼痛感觉已经恢复之后,有慢性疼痛经历的受试者通常对随后的较低疼痛表现出增强的反应[1]。目前常用的疼痛治疗药物为各类抗炎药和镇痛药,但长期使用会产生不同程度的副作用。针灸镇痛已被广泛用于缓解多种疼痛,特别是慢性疼痛。虽然已有研究表明针灸可以通过抗氧化途径,神经保护和抗炎途径产生镇痛作用[2],但目前针刺镇痛的机制仍不完善。
Wnt-1和β-catenin是经典Wnt/β-catenin信号通路的关键蛋白,已有研究表明,Wnt/β-catenin信号通路以及相关蛋白的表达与炎症反应密切相关[3-4]。此外,在神经系统发育过程中,Wnt蛋白家族在调节轴突再生和神经性疼痛的发病机制中起着重要作用[5]。Wnt信号通路的激活可刺激促炎因子TNF-α和IL-1β的分泌,加剧神经性疼痛[6-8]。Wnt或β-catenin的活化都可以促进脑源性神经营养因子(BDNF)表达,然后加重神经疼痛[9-11]。然而针灸治疗慢性疼痛的机制是否与Wnt/β-catenin信号通路的调控有关仍不清楚。
CREB和ERK蛋白都与各种类型的疼痛传递有关[12],例如神经性疼痛、糖尿病神经病变疼痛、或者辣椒素诱导的疼痛。CREB和ERK蛋白属于丝裂原活化蛋白激酶(MAPK)家族,通过调节背根神经节(DRG)、脊髓和大脑皮层的神经元可塑性和炎症反应导致疼痛超敏反应[13]。在慢性疼痛的外周和中枢神经系统中都存在MAPKs的过度磷酸化[14-15],而抑制MAPKs会减弱神经元兴奋性并缓解疼痛[16-17]。然而,ERK/MAPK信号通路在针灸治疗慢性疼痛中的作用尚不清楚。
因此,本研究建立慢性炎性疼痛大鼠模型,旨在探究电针(Electroacupuncture,EA)干预治疗对Wnt/β-catenin信号通路和ERK/MAPK信号通路的影响,进一步明确针刺消炎镇痛可能的分子机制。
1 材料与方法
1.1 实验动物
健康的SPF级雄性SD大鼠,体质量200-250 g,购自成都达硕实验动物有限公司,合格证号:20190078。所有大鼠均正常饮食饮水。
1.2 试剂与仪器
前列腺素E2(PGE2)ELISA试剂盒(Elabscience,54J6AM7NFP)、白 介 素-6(IL-6)ELISA试 剂 盒(Abcam,ab234570)、IL-1β ELISA试 剂盒(Abcam,ab255730);兔抗Wnt-1、兔抗β-catenin和兔抗GSK-3β(Abcam,ab15251、ab32572和ab32391);兔 抗CREB、兔抗p-CREB、兔抗ERK和兔抗p-ERK(Abcam,ab32515,ab32096,ab184699和ab76299)。
ZE5 Bio-Rad全能型成像系统(Bio-Rad,USA);MK3酶标仪(Thermo,USA);NC12775 Von-Frey纤维丝测痛仪(上海玉研科学仪器有限公司,中国)。
1.3 方法
1.3.1 实验动物分组
建模前1天,将SD大鼠置于特制的有机玻璃箱内,适应环境30 min后,对大鼠进行机械痛觉测试,剔除疼痛阈值异常(疼痛阈值过高或过低)的大鼠后分组进行实验。选出6只大鼠作为对照组,再将剩余的大鼠进行CFA造模,造模成功后,将大鼠随机分为3组,每组6只,组间大鼠体重没有显著性差异,具体分组为:模型组、模型+电针组和模型+假电针组。
1.3.2 CFA动物模型
根据文献方法建立CFA动物模型[18]:腹膜内注射3%戊巴比妥钠(50 mg/kg)对大鼠进行麻醉,给实验组大鼠左后足皮下注射100 µL完全弗氏佐剂诱发足底内炎症,对照组注射100 µL生理盐水。造模7天后,与未造模组比较,造模组大鼠左后足出现明显的红肿,并且活动行为明显减少,则造模成功。
1.3.3 电针(EA)治疗
在CFA大鼠模型建立后第8天,对EA治疗组大鼠左后肢足三里(ST36)和阳陵泉(GB34)进行电针治疗,ST36位于膝关节后外侧,腓骨小头下约5 mm处,GB34位于距ST36上外侧5 mm处,穴位定位标准参照《实验针灸学》[19]),针灸针置于大鼠肌肉层(2-3 mm),刺激参数选用疏密波,频率2/100 HZ,强度0.5-1.5 mA(每10 min增加0.5 mA),每次治疗30 min,连续电针治疗7天,每天在同一时间(上午9∶00-11∶00)进行。实验中4组大鼠均在没有麻醉的情况下被固定在固定装置内,除电针治疗处理外,其余操作完全相同。不同处理为对照组和模型组不进行电针治疗,模型组+假电针组针灸针置于大鼠肌肉层(1 mm),但不进行通电治疗。
1.3.4 大鼠一般情况观察
观察大鼠一般情况,包括大鼠的精神状态、饮食饮水、步态和足底红肿程度。
1.3.5 Up-down法检测机械痛
在实验前3天取实验大鼠提前适应Up-down法环境,每次20 min。用VonFrey针刺触觉测量套件刺激大鼠左后足,Up-down法检测和计算大鼠机械痛阈,详细步骤为:将大鼠置于镂空的行为检测钢丝网上适应后,然后序贯采用1.4、2.0、4.0、6.0、8.0、10.0、15.0、26.0 g的Von Frey细丝垂直检测各组大鼠足底疼痛阈值,若出现缩足、舔足、抬足等行为,则表明该Von Frey细丝对应规格为此时大鼠足底疼痛阈值。检测时间点在EA治疗的前1天(T0)、第1天(T1)、第3天(T3)、第5天(T5)和第7天(T7)记录大鼠机械痛变化。
1.3.6 化学刺激法检测冷刺激痛觉超敏反应
在检测机械痛30 min后,以0.2 mL丙酮快喷射大鼠左后足,观察大鼠的应激反应情况,根据其对冷刺激的反应进行冷刺激评分,没有任何反应者为0分;轻抬受刺激的后足为1分;反复剧烈抬、摇晃后足为2分;持续或反复撤足并舔爪、摇爪或大叫者为3分[20]。于EA治疗的前1天(T0)、第1天(T1)、第3天(T3)、第5天(T5)和第7天(T7)记录大鼠冷刺激评分。
1.3.7 ELISA检测血清和左后足组织中PGE2、IL-6、TNF-α和IL-1β的表达
实验最后1天,在行为学测试结束后1 h,大鼠麻醉后腹主动脉取血,4℃,5000 r/min离心10 min后取血清;取致炎足足底组织,冰浴研磨,制备组织匀浆,3000 r/min离心15 min,取上清。ELISA法检测上清和血清中PGE2、IL-6、TNF-α、IL-1β和BDNF的含量,具体操作参考试剂盒说明书。
1.3.8 Western blot检测左后足组织中相关蛋白的表达水平
取大鼠左后足组织,PBS清洗,加裂解液,冰浴研磨,离心后收集上清,Bradford法测定蛋白浓度。取25 µg蛋白,进行SDS-聚丙烯酰胺凝胶电泳,并转移至PVDF膜,然后进行TBST清洗、一抗孵育(Wnt-1,1∶1000;β-catenin,1∶5000;GSK-3β,1∶5000;CREB,1∶1000;p-CREB,1∶5000;ERK,1∶10000;p-ERK,1∶10000)、TBST清洗、二抗孵育(抗兔HRP标记的二抗,1∶5000,Santa Cruz Biotechnology)、TBST清洗等常规Western blot操作步骤,最后加入超敏发光底物曝光,使用Image J分析蛋白相对表达水平,β-actin为内参。
1.4 统计学分析
采用GraphPad 8.0统计软件对实验结果进行分析,实验结果用均值±标准差(±s)表示。本实验中数据均呈正态分布,对照组和模型组采用T检验,模型组、电针组和假电针组三组间采用单因素分析,方差齐性,事后检验采用Tukey做事后分析,方差不齐,事后检验采用Dunnett's做事后分析。P〈0.05为差异有统计学意义。
2 结果
2.1 电针治疗对慢性炎性疼痛大鼠大体情况的影响
四组大鼠精神状态都表现良好,饮食饮水正常。正常组大鼠未发现明显异常状况,其余三组小鼠造模后,均出现患足红肿、活动行为明显减少,并且活动时有不同程度的拖足表现。
2.2 电针治疗对慢性炎性疼痛大鼠机械痛阈值与冷痛觉反应的影响
结果如图1所示,与对照组相比,第0天、第1天、第3天、第5天和第7天的模型组小鼠机械痛阈值均显著降低(均P〈0.001),冷刺激评分均显著升高(均P〈0.001)。EA治疗第1天和第3天,与模型组相比,EA治疗组大鼠机械痛阈值有升高趋势(均P〉0.05),冷刺激评分有下降趋势(均P〉0.05),但差异不显著;在EA治疗后第5天及第7天,EA治疗组大鼠的机械痛阈值显著增高(P〈0.01,P〈0.001),冷刺激评分显著降低(均P〈0.05)。此外,与模型组相比,假EA治疗组大鼠的机械痛阈值和冷刺激评分均无显著改变。
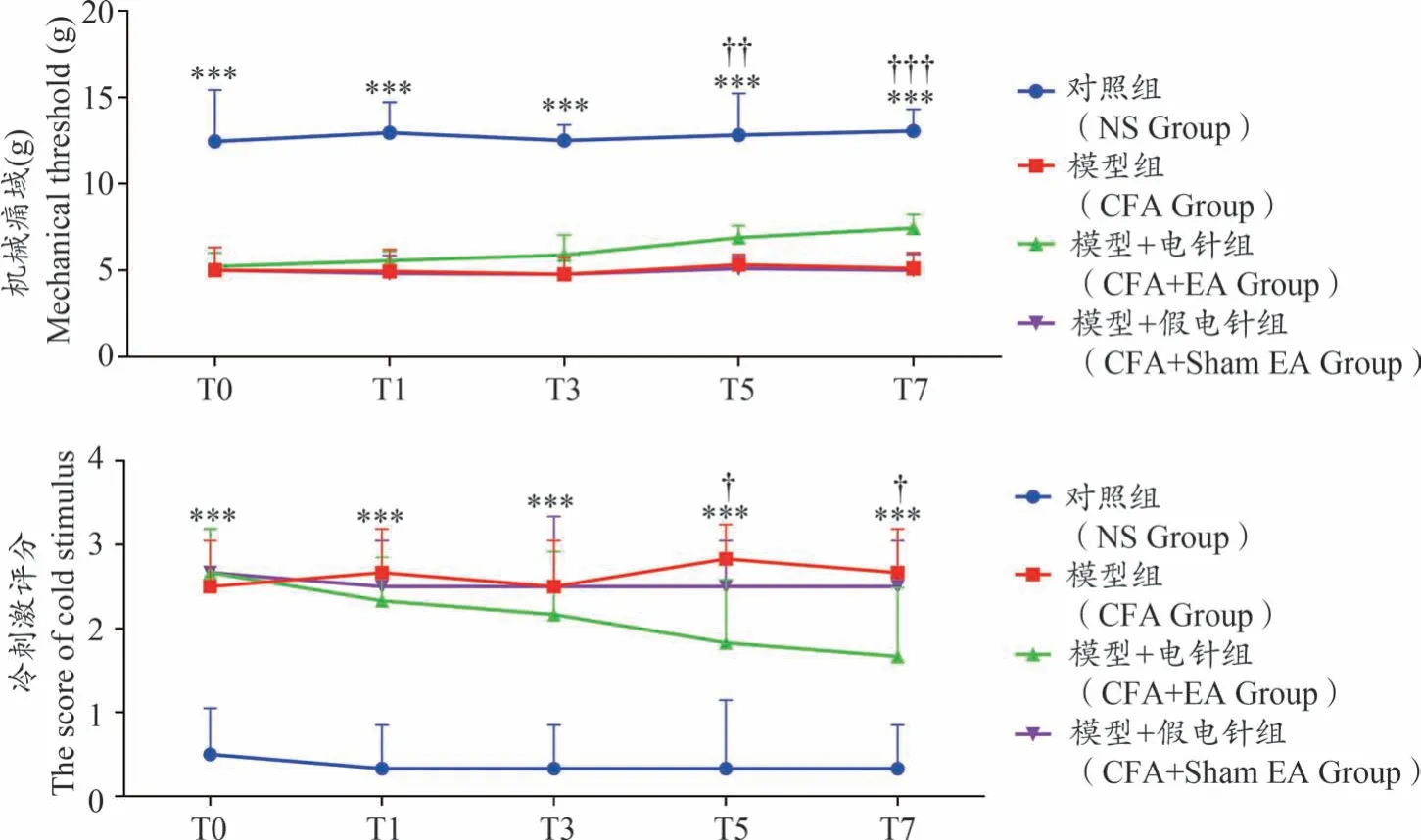
图1 机械痛域及冷刺激评分检测结果(g)(n=6)
2.3 电针治疗对慢性炎性疼痛大鼠血清、左后足组织中炎症介质的影响
与对照组相比,模型组大鼠血清和左后足组织中的炎症介质IL-1β、IL-6、PGE2、TNF-α和BDNF的表达水平显著升高(均P〈0.001)。与模型组相比,EA治疗显著降低了CFA大鼠血清IL-1β(P〈0.05)、IL-6(P〈0.05)、PGE2(P〈0.05)、TNF-α(P〈0.05)和BDNF(P〈0.01)的表达水平,并下调了左后足组织中IL-1β(P〈0.01)、IL-6(P〈0.05)、PGE2(P〈0.01)、TNF-α(P〈0.01)和BDNF(P〈0.05)的表达水平。此外,假EA治疗对CFA大鼠血清和左后足组织中PGE2、IL-6、TNF-α、IL-1β和BDNF的表达无显著影响(均P〉0.05)。见表1,表2。
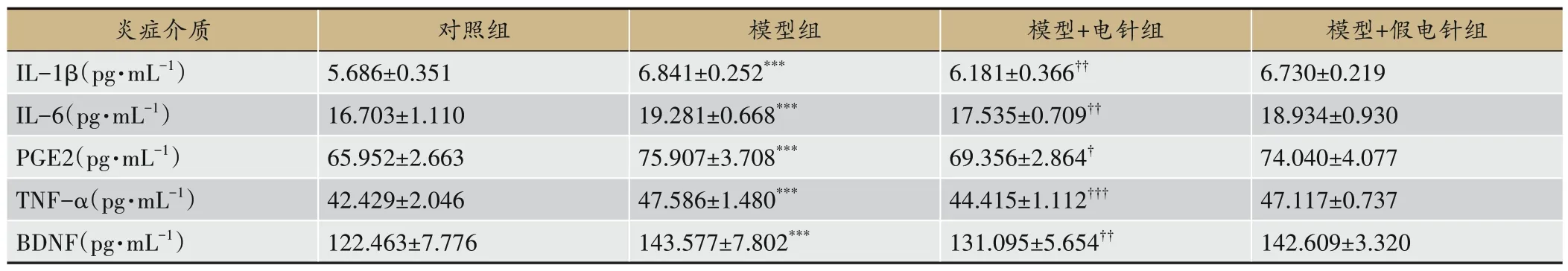
表1 血清中PGE2、IL-6、TNF-α和IL-1β的表达(n=6)
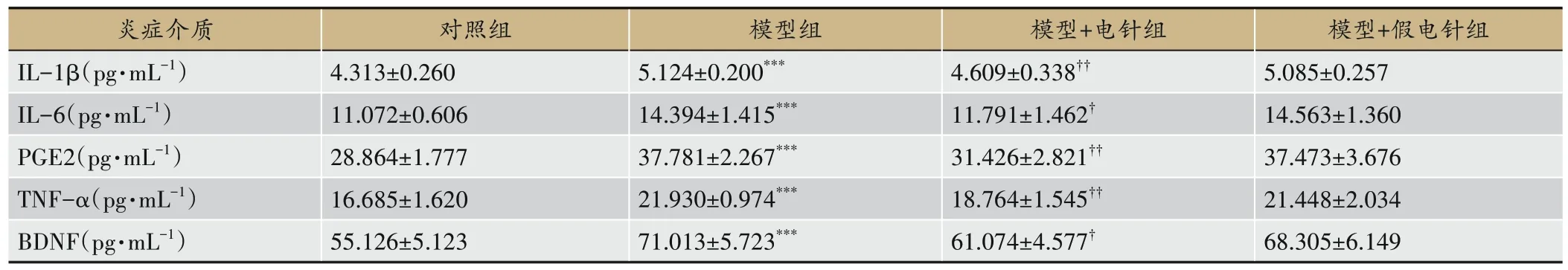
表2 左后足组织中PGE2、IL-6、TNF-α和IL-1β的表达(n=6)
2.4 电针治疗对对慢性炎性疼痛大鼠左后足组织中Wnt/β-catenin信号通路的影响
如图2所示,与对照组相比,模型组大鼠左后足组织中Wnt-1、β-catenin、GSK-3β的蛋白表达水平均显著上升(P〈0.001)。与模型组相比,EA治疗组大鼠左后足组织中Wnt-1和β-catenin的蛋白表达水平显著下降(P〈0.001),GSK-3β蛋白的表达水平显著上升(P〈0.001)。此外,假EA治疗组与模型组相比,大鼠左后足组织中Wnt-1和β-catenin蛋白显著下降(P〈0.05,P〈0.01),GSK-3β蛋白显著上升(P〈0.001)。
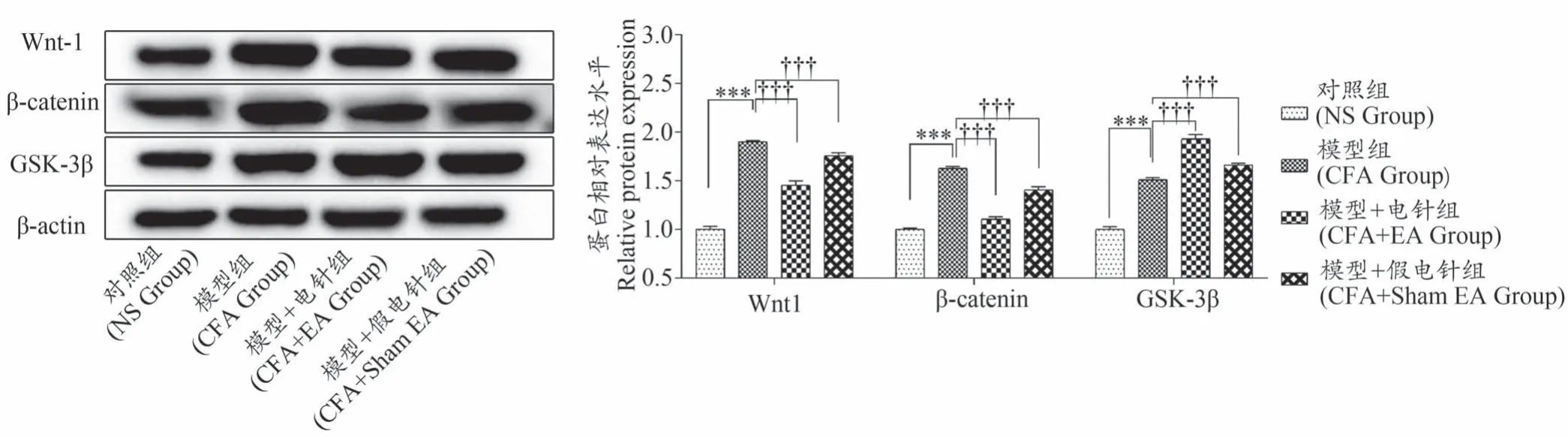
图2 各组大鼠左后足组织中Wnt/β-catenin信号通路分子的表达(±s,n=6)
2.5 电针治疗对对慢性炎性疼痛大鼠左后足组织中ERK/MAPK信号通路的影响
如图3所示,与对照组相比,模型组大鼠左后足组织中CREB和ERK蛋白磷酸化水平均显著上升(P〈0.001)。与模型组相比,EA治疗组大鼠左后足组织中CREB和ERK蛋白磷酸化水平显著下降(P〈0.001)。此外,假EA治疗组与模型组相比,大鼠左后足组织中CREB蛋白磷酸化水平显著下降(P〈0.05),但ERK蛋白磷酸化水平无明显差异(P〉0.05)。
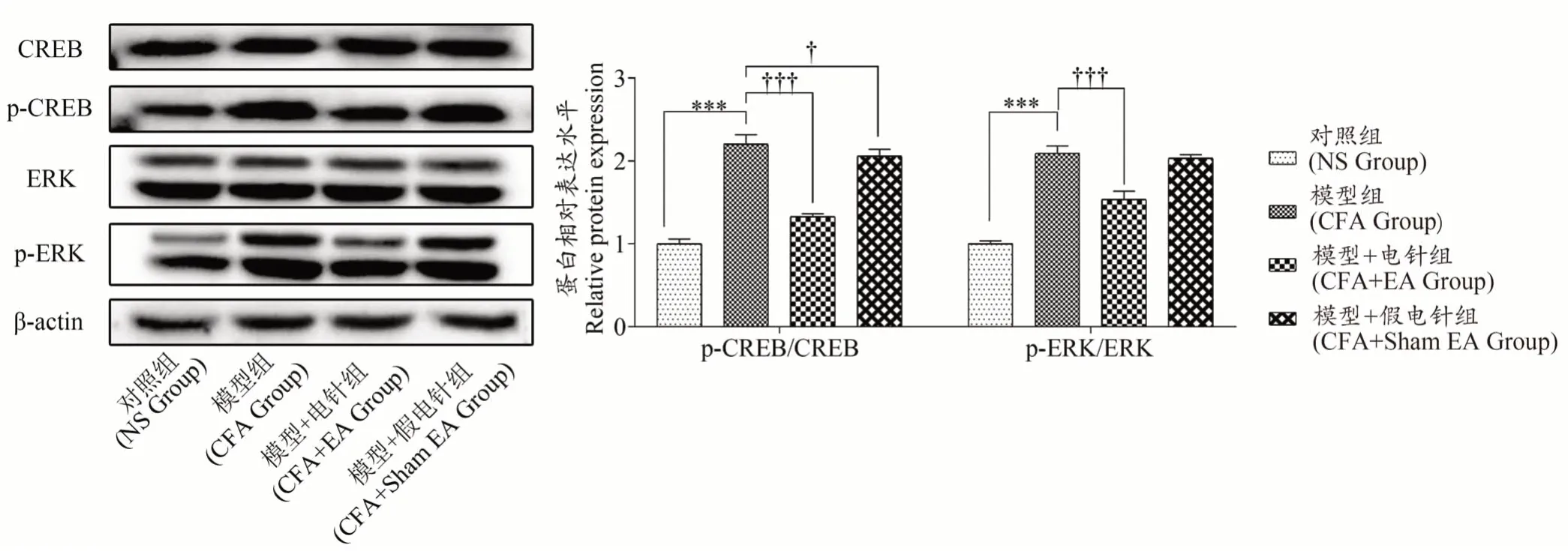
图3 各组大鼠左后足组织中ERK/MAPK信号通路分子的表达(±s,n=6)
3 讨论
慢性炎症疼痛是世界上患病率很高的疾病[21],通常与精神疾病和神经发育疾病(包括重度抑郁症)并存[22],同时慢性疼痛常伴发患者睡眠障碍[23],严重影响患者身心健康。针刺是中国传统医学之一,能治疗各种急慢性疼痛[24-26]。左后足皮下注射完全弗氏佐剂是常用的慢性炎性疼痛动物模型建模方法[18]。祖国中医学说认为疼痛的病机是“不通则痛”和“不荣则痛”,因此中医以化瘀通络止痛及益气养血止痛两种为主[27]。中医针灸理论认为,针刺特定的腧穴、经脉,能够疏通经络、调和气血,因而改善气滞血瘀、经脉痹阻所导致的疼痛[27]。阳陵泉(GB34)穴为足少阳之脉所入为合的合上学,为八会穴之筋会,针刺阳陵泉穴可疏肝利胆、舒筋利节[28]。足三里(ST36)穴属足阳明胃经,为胃经合穴,针刺可生化气血,荣养四肢百骸,梳理上、中、下三焦之气血[29]。足三里(ST36)和阳陵泉(GB34)是中医针刺治疗常用的组合穴位,化瘀通络,益气养血。EA基于传统针灸衍生而来,相比于传统针灸,EA具有操作简便、更加安全的优点[30]。沈伟等[31]研究表明电针足三里(ST36)和阳陵泉(GB34)可以缓解CFA模型大鼠的疼痛。本研究表明也表明足三里(ST36)和阳陵泉(GB34)对CFA模型大鼠有阵痛效果,与沈伟等[31]研究结果一致,而假EA对CFA大鼠疼痛无明显改善。
细胞因子介导促炎或抗炎反应,IL-1β、IL-6、TNF-α是促炎因子的标志物[32-33]。PGE2是一种经典的炎症介质,在炎症反应中介导疼痛和发热[34]。因此炎症因子IL-1β、IL-6、TNF-α和炎症介质PGE2的表达水平一定程度上代表了炎症反应程度。而BDNF通过中枢敏化调节慢性疼痛的发展[35]。本研究表明,EA治疗结束后血清和左后足组织中炎症因子PGE2、IL-6、TNF-α、IL-1β和BDNF表达也显著下降,这些表明电针治疗能显著改善CFA大鼠炎症反应和疼痛反应。此外,假EA对CFA大鼠炎症反应无显著改变。
慢性炎症痛的发生机制尚不明确,目前较为认可的是炎症机制[18,36]。张媛媛等[37]发现EA可能通过抑制大鼠关节Wnt/β-catenin信号通路下调MMP-13的表达,降低促炎因子IL-1β的释放,改善膝骨关节炎软骨退变。有多项研究发现EA通过Wnt/β-catenin信号通路参与脊髓损伤的组织修复过程[38-39]。因此,Wnt/β-catenin信号通路被认为是EA治疗作用的炎性通路之一。研究表明GSK-3β与Axin、APC、CK1形成的复合物在细胞质内使β-catenin磷酸化而降解,而Wnt蛋白能与Fzd、LRP5/6结合,募集Dvl,阻止GSK-3β与Axin、APC、CK1复合物的形成,从而阻止β-catenin磷酸化,使β-catenin在细胞质中累积造成炎症反应[40],因此提高GSK-3β的表达有利于抑制β-catenin在细胞质中累积造成的炎症反应。本研究结果显示,EA抑制了Wnt/β-catenin信号通路的活化,提高了GSK-3β的表达,提示EA作用机制与GSK-3β促进β-catenin磷酸化有关。令人意外的是,在CFA模型组大鼠中GSK-3β的表达水平显著上升。研究表明,动物机体组织都具有自我修复的功能[41-42],而肌肉是一种具有强大的自我修复功能的组织,当受到轻微损伤时肌肉组织可以自我修复[43],因此我们推测这是CFA大鼠机体自我修复的结果,而EA促进了CFA大鼠机体的自我修复,但EA促进CFA自我修复的作用机制仍进一步研究。
CREB和ERK蛋白都与各种类型的疼痛传递有关。外周神经损伤会引起神经性疼痛和背根神经节(DRG)和背角中丝裂原活化蛋白激酶(MAPK)家族成员的磷酸化。神经损伤后,细胞外信号调节蛋白激酶(ERK)(MAPK家族的重要成员)的磷酸化在神经元、小胶质细胞和背角星形胶质细胞中依次增加[44]。神经损伤诱导的ERK磷酸化(p-ERK)发生较早且持续时间长,并且发生在多种神经性疼痛动物模型中,例如,当受到伤害性疼痛刺激时,背根神经节和脊髓中的CREB和ERK蛋白表达升高[12]。此外,CREB和ERK蛋白在神经性疼痛模型、糖尿病神经病变模型或辣椒素诱导疼痛模型中,表达也会升高[12]。研究表明,抑制ERK激活的MEK抑制剂可在不同时间点有效缓解疼痛[13,45-46]。然而,在CFA动物模型中,CREB和ERK蛋白在慢性疼痛中的可能作用尚不清楚。本研究表明,CREB和ERK蛋白磷酸化水平在CFA疼痛组织中升高,EA电针抑制了CREB和ERK蛋白的磷酸化,表明EA治疗CFA与其抑制ERK/MAPK信号通路有关。
此外,我们发现假电针抑制了Wnt和β-catenin的蛋白表达,并且降低了CREB蛋白磷酸化水平,但ERK蛋白磷酸化水平无明显差异。有趣的是,假电针治疗7天后对大鼠疼痛和炎症反应并无明显改善,这有可能是因为假电针同样刺激了足三里(ST36)和阳陵泉(GB34)两个穴位,改善了Wnt/β-catenin信号通路和ERK/MAPK信号通路,对CFA有治疗作用,但是其对CFA的治疗效果较慢,在治疗7天后无法达到明显改善CFA疼痛的效果。同时,这也说明电针介入的时间点很可能对慢性炎性疼痛疗效有影响,然而,其具体影响机制还需进一步证明。
总而言之,本研究表明,EA显著改善了大鼠慢性炎性疼痛,其机制可能与EA抑制Wnt/β-catenin信号通路以及ERK/MAPK信号通路有关。
