牡蛎多肽组分OE-I抗氧化活性及其对秀丽隐杆线虫抗衰老作用
2022-03-03肖嵋方陈弘培
王 力,肖嵋方,陈弘培,刘 斌,曾 峰,*
(1.闽台特色海洋食品加工及营养健康教育部工程研究中心,福建 福州 350002;2.福建农林大学食品科学学院,福建 福州 350002)
衰老是一个由遗传和环境共同介导的复杂生物过程,由多种因素如氧化应激、细胞凋亡和DNA损伤等引起[1]。在大多数情况下,与衰老有关的疾病和程序性细胞死亡主要由细胞氧化应激引起[2]。越来越多的证据表明,天然活性物质(如多肽)具有较强的抗氧化活性,可以提高机体内的抗氧化能力,减轻氧化损伤,并通过控制衰老过程中重要基因的表达和相关途径的相互作用来延缓衰老,但目前鲜有具有明确抗衰老功效的药物;因此,寻找抗衰老的天然活性物质对于延缓衰老具有十分重要的意义[3]。
牡蛎是海洋生态系统中的重要物种,对全世界的渔业和水产养殖业具有重大的经济效益,在营养和药用方面也体现出极高的价值,是我国卫生部公布的第一批药食同源食品原料,含多种氨基酸、维生素,还富含钙、磷、铁、锌、硒等营养成分,并具有治虚弱、解丹毒、降血压、滋阴壮阳等功能[4]。福建省海洋贝类资源丰富,2016年海水贝类产量276.4×104t,占全省海水养殖产量的63.9%;养殖面积为82 389 hm2,占全省海水养殖面积的47.2%,而牡蛎是福建省沿海最重要的养殖贝类[5]。在本课题组前期研究中发现,牡蛎含有丰富的蛋白质,使用中性蛋白酶酶解牡蛎肉糜得到的牡蛎多肽具有较强的羟自由基和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力,表现出较强的抗氧化活性,能显著增强小鼠体内抗氧化能力;此外,牡蛎多肽组分OE-I的结构鉴定结果发现其组分主要含有10 个肽序列[6]。Miao Jianyin等[7]探究复合蛋白酶酶解牡蛎肉(OM)的特性,用6 kDa超滤膜将牡蛎水解产物(OH)分离成OH-I(<6 kDa)和OH-II(>6 kDa)两个组分,考察了OM、OH、OH-I和OH-II组分的抗氧化活性,并进一步分析了OH-I和OH-II的抗疲劳作用,结果表明,OH-I具有很强的抗氧化活性,与对照组相比,OH-I能显著延长小鼠的游泳时间。Umayaparvathi等[8]使用SU12蛋白酶酶解牡蛎,发现酶解制备的抗氧化肽有较强的过氧化氢自由基清除活性和羟自由基清除活性,通过超高效液相色谱-质谱进一步纯化活性肽段,共收集到7 种抗氧化肽,其中的SCAP 1、SCAP 3和SCAP 7这3 种多肽对DPPH自由基有很强的清除能力。宋文静[9]发现用中性蛋白酶酶解的牡蛎蛋白和经Sephadex G-25凝胶柱分离纯化后的组分均具有较好的DPPH自由基清除能力,并发现分离的牡蛎肽NA、NB组分对双氧水诱导的LO2细胞氧化损伤有一定的保护作用。抗氧化肽的活性与其分子质量大小密切相关,分子质量较小的多肽活性相对较好,虽然已经有研究证实了牡蛎多肽的抗氧化作用,但是关于其体内抗氧化和延缓衰老的报道仍比较少,其作用机制尚不明晰,因此本实验将对牡蛎多肽延缓衰老的机制作进一步研究。
秀丽隐杆线虫(Caenorhabditis elegans)是一种在生物医药领域应用广泛的模式生物,具有生命周期短、繁殖能力强、饲养简单、便于计数和观察等特点,国际上公认为线虫在抗氧化和延缓衰老研究领域中具有优势[10-11]。Vayndorf等[12]研究了全苹果提取物对线虫寿命和体内抗胁迫能力的影响,结果表明,经全苹果提取物处理后,线虫的平均寿命和最长寿命均显著延长,且具有剂量依赖性。金司仪[13]以秀丽隐杆线虫为模式生物,探究了不同粒度的三七粉对线虫寿命的影响,结果表明,三七粉可以延长线虫的寿命,具有一定的抗衰老作用。本实验以秀丽隐杆线虫为模型,测定不同质量浓度的牡蛎多肽组分OE-I对线虫正常情况下寿命、急性氧化应激情况下寿命和热应激情况下寿命的影响,以及线虫体内活性氧(reactive oxygen species,ROS)水平、细胞凋亡、体内抗氧化酶活力和相关基因表达水平的变化,对牡蛎多肽的抗氧化活性以及抗衰老的作用机制进行研究,以期为海洋生物资源的精深加工及抗衰老功能食品的研究与开发提供参考。
1 材料与方法
1.1 动物、材料与试剂
野生N2型秀丽隐杆线虫 福建上源生物科学技术有限公司。
牡蛎 福州市金山大润发超市。
Western及细胞IP裂解液 上海碧云天生物技术公司;2’,7’-二乙酸二氯荧光素(2’,7’-dichlorofluorescin diacetate,H2DCF-DA) 中性蛋白酶(50 000 U/g)、VC、DPPH 北京索莱宝科技有限公司;过氧化氢酶(catalase,CAT)活力测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)活力测定试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力测定试剂盒 南京建成生物工程研究所;吖啶橙、盐酸左旋咪唑、UNlQ-10柱式TRIzol总RNA抽提试剂盒、M-MuLV第一链cDNA合成试剂盒、SYBR Green染料法Mix 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
高速冷冻离心机 日本久保田株式会社;人工气候箱 上海一恒科学仪器有限公司;SpectraMax i3x酶标仪、ABI多功能聚合酶链式反应(polymerase chain reaction,PCR)仪、ABI7300实时荧光定量PCR仪 美国赛默飞公司;荧光显微镜 德国卡尔-蔡司股份公司。
1.3 方法
1.3.1 牡蛎多肽的制备
称取适量牡蛎肉糜,选用中性蛋白酶进行酶解,固液比(牡蛎肉糜/超纯水)为1∶10,加酶量1 400 U/g(以牡蛎肉糜质量计),调节pH值为7.0,酶解温度50 ℃,酶解时间4.0 h,酶解结束后沸水浴灭酶,5 000 r/min离心30 min,分离上清液即为牡蛎酶解液(oyster enzymatic hydrolysate,OE),采用截留分子质量分别为10、5 kDa的超滤膜对酶解液进行分级,收集得到3 个组分OE-I(<5 kDa)、OE-II(5~10 kDa)与OE-III(>10 kDa)样品,分别冷冻干燥,储存备用[6]。
1.3.2 牡蛎多肽的体外抗氧化活性评价
1.3.2.1 DPPH自由基清除能力测定
取0.5 mL的DPPH溶液(0.4 mmol/L),分别加入0.5 mL不同质量浓度(2、4、6、8、10 mg/mL)的OE-I、OE-II与OE-III样品溶液并混匀,同时以VC作为阳性对照,以超纯水代替样品为空白组,以超纯水代替DPPH溶液为对照组,在避光、室温的条件下反应30 min,于517 nm波长处检测其吸光度,每个质量浓度样品做3 个平行。按式(1)计算DPPH自由基清除率。
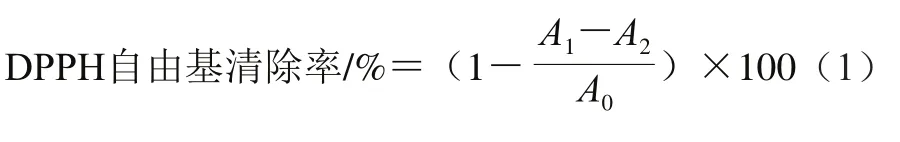
式中:A0为空白组的吸光度;A1为样品组吸光度;A2为对照组的吸光度。
1.3.2.2 羟自由基清除能力测定
取0.5 mL的FeSO4溶液(15 mmol/L)和1 mL不同质量浓度(2、4、6、8、10 mg/mL)的OE-I、OE-II与OE-III样品溶液混合,再加50 μL体积分数为0.03%的H2O2启动反应,37 ℃孵育10 min,最后加入150 μL的水杨酸-乙醇溶液(20 mmol/L),在37 ℃反应30 min,在562 nm波长处测定的吸光度为A1,以超纯水代替水杨酸-乙醇为对照组,所测定的吸光度为A2,以超纯水代替样品为空白组,所测定的吸光度为A0,以VC作为阳性对照,每个质量浓度样品做3 个平行。按式(2)计算羟自由基清除率。

1.3.2.3 超氧阴离子自由基清除能力测定
取4.5 mL Tris-HCl缓冲液(pH 8.2、50 mmol/L)分别与1 mL不同质量浓度(2、4、6、8、10 mg/mL)的OE-I、OE-II与OE-III样品溶液混合,25 ℃水浴中预热20 min,再加入0.4 mL的邻苯三酚溶液(25 mmol/L),混匀后于25 ℃水浴中反应5 min,最后加入1 mL的HCl溶液(8 mmol/L)终止反应,于325 nm波长处测定吸光度A1,以超纯水代替邻苯三酚溶液为对照组,所测定的吸光度为A2,以超纯水代替样品溶液为空白组,所测定的吸光度为A0,以VC作为阳性对照,每个质量浓度样品做3 个平行。按式(3)计算超氧阴离子自由基清除率。

1.3.2.4 亚铁离子螯合能力测定
取50 μL不同质量浓度(2、4、6、8、10 mg/mL)的OE-I、OE-II与OE-III样品溶液分别与185 μL的甲醇和5 μL的FeCl2溶液(2 mmol/L)混合,加入10 μL的菲啰嗪溶液(5 mmol/L)开始反应,在室温下静置10 min后,在562 nm波长处测其吸光度A1,以超纯水代替菲啰嗪溶液为对照组,所测定的吸光度为A2,以超纯水代替样品溶液为空白组,所测定的吸光度为A0,以乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)为阳性对照,每个质量浓度样品做3 个平行。按式(4)计算亚铁离子螯合率。

1.3.3 线虫同期化处理
挑选含有大量产卵期雌雄同体线虫的培养基,用M9缓冲液(3 g KH2PO4、6 g Na2HPO4、5 g NaCl溶解于1 L的超纯水中,高压灭菌后加入1 mL的1 mol/L MgSO4)吹洗培养基数次,使菌苔中附着的线虫和虫卵脱落,用灭菌的1.5 mL离心管收集含线虫的洗液,加1 mL的M9缓冲液冲洗虫体,1 000 r/min离心1 min弃上清液,重复3 次,再加入现配的1 mL细胞裂解液裂解线虫,振荡后,在显微镜下观察,直至大部分虫体裂解,将离心管于6 000 r/min下离心1 min,弃上清液,加M9缓冲液洗涤3 次,将洗涤后的虫卵转移至线虫生长培养基(nematode growth medium,NGM)上,在20 ℃恒温下培养48 h后虫卵基本发育成L4期幼虫,即完成同期化。
1.3.4 线虫寿命实验
将同期化的线虫随机分为4 组,每组设置3 个平行,每板30 只,分别为空白组(0 μg/mL)及不同质量浓度的OE-I(20、40、80 μg/mL)的实验组。将线虫转移到NGM上,然后在20 ℃人工气候箱中培养,此时记为第0天,每2 d更换NGM培养基并记录死虫和活虫的数量(用铂金丝轻轻触碰线虫没有反应,即认为是死虫),直至所有线虫死亡为止。根据线虫生存和死亡的时间绘制生存曲线[14]。
1.3.5 线虫急性氧化应激实验
收集同期化线虫,将线虫按照1.3.4节方法培养72 h后,将各组线虫转移到新的NGM上,此时每10 mL NGM培养基中添加体积分数30%的双氧水10 μL,每1 h记录一次线虫存活数量,直至线虫全部死亡。根据线虫生存和死亡的时间绘制生存曲线。
1.3.6 线虫热应激实验
收集同期化线虫,将线虫按照1.3.4节方法培养72 h后,将各组线虫转移至35 ℃培养箱中培养,每2 h记录一次线虫存活数量,直至线虫全部死亡。根据线虫生存和死亡的时间绘制生存曲线。
1.3.7 线虫体内ROS水平的测定
收集同期化线虫,将线虫按照1.3.4节方法培养72 h后,收集各组线虫,用M9缓冲液冲洗3 次。ROS水平测定:将线虫转移到含20 μL H2DCF-DA的180 μL M9缓冲液中,室温黑暗中孵育30 min,M9缓冲液冲洗3 次,用酶标仪检测线虫的荧光强度,激发波长和发射波长分别为485、530 nm[15]。
1.3.8 线虫细胞凋亡染色测定
收集同期化线虫,将线虫按照1.3.4节方法培养72 h后,收集各组线虫,用M9缓冲液冲洗3 次。细胞凋亡染色测定:将线虫转移到200 μL的吖啶橙溶液(25 μg/mL)中,室温黑暗中孵育1 h,用M9缓冲液洗除染液后,将线虫转移到空白NGM培养皿上,用盐酸左旋咪唑溶液(60 μg/mL)麻醉线虫,置于质量分数3%琼脂糖载玻片上,在荧光显微镜下观察线虫,拍照并计算荧光强度,激发波长和发射波长分别为485、530 nm。
1.3.9 线虫体内抗氧化酶活力的测定
收集同期化线虫,将线虫按照1.3.4节方法培养72 h,用M9缓冲液清洗3 次,然后加入200 μL的细胞裂解缓冲液,在冰上孵育1 h,用手持式匀浆机匀浆处理后在3 000 r/min下离心5 min,取上清液,分别用SOD、CAT、GSH-Px活力测定试剂盒检测相应酶活力[16]。
1.3.10 衰老相关基因表达水平的测定
收集培养72 h后的线虫,用M9缓冲液冲洗。采用试剂盒提取总RNA并通过逆转录合成cDNA。实时荧光定量PCR采用SYBR染料法和ABI 7300 PCR系统进行。扩增条件:95 ℃预变性2.5 min;94 ℃变性15 s,60 ℃退火30 s,共40 个循环。引物的设计如表1所示,act-1为mRNA的内参基因,基因表达量以2—ΔΔCt法计算[17]。

表1 定量聚合酶链式反应中所用引物序列Table 1 Primer sequences used for quantitative polymerase chain reaction (qPCR)
1.4 数据处理与分析
采用Excel软件、Origin 8.0软件对实验结果进行统计和作图,用Image Pro Plus 6.0软件定量线虫的荧光强度,结果用平均值±标准差表示。利用SPSS R26.0统计分析软件对线虫寿命的实验数据以及对线虫抗氧化相关生理指标的数据进行单因素方差分析,P<0.05表示显著差异,P<0.01表示极显著差异。
2 结果与分析
2.1 牡蛎多肽的体外抗氧化活性
2.1.1 DPPH自由基清除能力
不同质量浓度的牡蛎多肽组分对DPPH自由基的清除率如图1所示,3 个组分多肽都表现出较强的DPPH自由基清除能力,在2~10 mg/mL范围内,随着质量浓度的增加,牡蛎多肽组分的DPPH自由基清除率增大,3 个组分都表现出显著的剂量-效应关系。其中组分OE-I的DPPH自由基清除率高于OE-III,OE-II的DPPH自由基清除率略低于OE-I,组分OE-I的DPPH自由基清除率最高。

图1 OE-I、OE-II、OE-III及VC对DPPH自由基的清除能力Fig.1 DPPH radical scavenging capacity of OE-I, OE-II, OE-III and VC
2.1.2 羟自由基清除能力
不同质量浓度的牡蛎多肽组分对羟自由基的清除率如图2所示,3 个组分多肽均具有一定的羟自由基清除能力,且其羟自由基清除能力与质量浓度之间存在剂量-效应关系,OE-I组分的羟自由基清除能力较其他两个组分高,明显高于组分OE-III,且在高质量浓度(10 mg/mL)下,组分OE-I的羟自由基清除能力接近阳性对照VC。

图2 OE-I、OE-II、OE-III及VC的羟自由基清除能力Fig.2 Hydroxyl radical scavenging capacity of OE-I, OE-II, OE-III and VC
2.1.3 超氧阴离子自由基清除能力
不同质量浓度的牡蛎多肽组分对超氧阴离子自由基的清除率如图3所示,随着质量浓度的增加,各组分的超氧阴离子自由基清除率均呈上升趋势,且组分OE-I的清除率最高,与组分OE-III相比差异明显。

图3 OE-I、OE-II、OE-III及VC的超氧阴离子自由基清除能力Fig.3 Superoxide anion radical scavenging capacity of OE-I, OE-II,OE-III and VC
2.1.4 亚铁离子螯合能力
不同质量浓度牡蛎多肽组分的亚铁离子螯合率如图4所示,随着质量浓度的升高,各组分的亚铁离子螯合能力均呈上升趋势,且组分OE-I的活性最高,与其他两组分相比差异明显。牡蛎多肽具有高含量的谷氨酸及天冬氨酸,为牡蛎多肽提供了亚铁离子结合位点,其亚铁离子螯合能力可能与氨基酸的组成有关[18]。
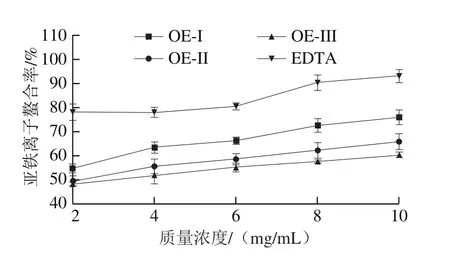
图4 OE-I、OE-II、OE-III及EDTA的亚铁离子螯合能力Fig.4 Ferrous ion chelating capacity of OE-I, OE-II, OE-III and ethylene diamine tetraacetic acid (EDTA)
2.2 牡蛎多肽对线虫寿命的影响
寿命是评价牡蛎多肽抗衰老效果最直接的指标[19]。由表2可知,空白组平均寿命为14.53 d,最长寿命为15.71 d,OE-I中剂量组线虫的平均寿命和最长寿命分别相比空白组延长了14.73%(P<0.05)和25.59%(P<0.05),OE-I高剂量组线虫的平均寿命和最长寿命分别相比空白组延长了35.37%(P<0.01)和43.92%(P<0.05)。线虫的生命曲线如图5所示,牡蛎多肽OE-I各剂量组线虫的寿命随着牡蛎多肽质量浓度的升高而延长,且具有明显的剂量-效应关系,表明牡蛎多肽OE-I可以延长线虫的寿命,发挥抗衰老作用。

表2 牡蛎多肽对线虫寿命的影响Table 2 Effects of oyster peptides on the lifespan of C.elegans

图5 线虫的寿命曲线Fig.5 Lifespan curves of C.elegans
2.3 牡蛎多肽对线虫急性氧化应激的影响
由表3可知,空白组平均寿命为2.48 h,最长存活时间为6 h;OE-I高剂量组线虫的平均寿命最长,与空白组相比有极显著差异(P<0.01)。线虫的寿命曲线如图6所示,牡蛎多肽OE-I各剂量组线虫寿命与牡蛎多肽质量浓度有明显的剂量-效应关系,表明牡蛎多肽OE-I对双氧水氧化损伤线虫具有明显的保护作用,相对于空白组,在OE-I干预后,20、40、80 μg/mL剂量组线虫平均寿命分别延长了6.04%、7.26%及26.21%。

图6 双氧水急性氧化应激损伤线虫的寿命曲线Fig.6 Lifespan curves of C.elegans with H2O2-induced acute oxidative stress

表3 牡蛎多肽对双氧水急性氧化应激损伤线虫寿命的影响Table 3 Effects of oyster peptides on the lifespan of C.elegans with H2O2-induced acute oxidative stress
2.4 牡蛎多肽对线虫热应激寿命的影响
由表4可知,空白组线虫的平均寿命为6.33 h,最长存活时间为10 h;在35 ℃时,不同质量浓度的牡蛎多肽OE-I对线虫抵抗热应激能力的分析结果显示,OE-I中剂量组线虫的平均寿命相比空白组延长了13.27%(P<0.05),OE-I高剂量组线虫的平均寿命相比空白组延长了22.91%(P<0.01),牡蛎多肽OE-I中剂量组、高剂量组显著增强了线虫的热应激抵抗能力。如图7所示,牡蛎多肽剂量组线虫热应激下寿命与牡蛎多肽质量浓度呈现明显的剂量-效应关系,OE-I高剂量组线虫的寿命曲线相比空白组明显右移。

表4 牡蛎多肽对线虫热应激寿命的影响Table 4 Effects of oyster peptides on the lifespan of C.elegans under heat stress

图7 热应激下线虫的寿命曲线Fig.7 Lifespan curves of C.elegans under heat stress
2.5 牡蛎多肽对线虫体内ROS的影响
ROS作为最重要的氧化剂之一,其水平可以间接反映机体细胞的氧化程度,其蓄积会对机体造成氧化损伤[20]。由图8可知,OE-I中剂量组和高剂量组线虫细胞内ROS相对含量较正常组显著降低(P<0.05),且OE-I高剂量组对线虫细胞内ROS的下调能力明显优于OE-I低剂量组。

图8 牡蛎多肽对线虫体内ROS的影响Fig.8 Effects of oyster peptides on ROS accumulation in C.elegans
2.6 牡蛎多肽对线虫细胞凋亡的影响
DNA损伤与细胞凋亡密切相关,吖啶橙染色结果可以反映线虫DNA的整合状况,这是由于吖啶橙可以进入凋亡细胞的细胞膜与DNA结合,细胞在荧光灯照射下呈绿色[21]。如图9A~D所示,牡蛎多肽OE-I各剂量组线虫虫体总体呈浅绿色,而空白组线虫虫体呈亮绿色,牡蛎多肽OE-I各剂量组线虫虫体的亮绿色面积小于空白组。此外,由图9E可知,牡蛎多肽OE-I高剂量组的荧光强度极显著低于空白组(P<0.01)。吖啶橙染色结果的差异表明,牡蛎多肽OE-I可以减轻线虫DNA的损伤,从而延长线虫的寿命。

图9 牡蛎多肽对线虫细胞凋亡的影响Fig.9 Effects of oyster peptides on cell apoptosis in C.elegans
2.7 牡蛎多肽对线虫体内抗氧化酶活力的影响
CAT、SOD和GSH-Px是线虫体内主要的抗氧化酶,提高抗氧化酶活力可以清除线虫体内多余的自由基,从而促进体内氧化平衡[22]。如图10所示,与空白组相比,牡蛎多肽OE-I各剂量组线虫体内3 种抗氧化酶活力随着质量浓度增加而升高。与空白组相比,OE-I低剂量组、中剂量组和高剂量组线虫体内GSH-Px活力分别是空白组的1.25 倍(P<0.05)、2.1 倍(P<0.01)和2.6 倍(P<0.01)。与空白组相比,OE-I中剂量组和高剂量组线虫体内SOD活力提高,分别为空白组的1.11 倍和1.17 倍(P<0.05);OE-I中剂量组和高剂量组线虫体内CAT活力为空白组的1.38 倍(P<0.05)和1.64 倍(P<0.01)。以上结果表明牡蛎多肽OE-I能提高线虫体内抗氧化酶活力,从而延长线虫的寿命。

图10 牡蛎多肽对秀丽隐杆线虫体内抗氧化酶活力的影响Fig.10 Effects of oyster peptides on antioxidant enzyme activities in C.elegans
2.8 牡蛎多肽对线虫衰老相关信号通路的影响
胰岛素通路是影响线虫寿命的典型通路之一,daf-2、daf-16和age-1是主要起调节作用的信号基因[23]。由图11A可知,经牡蛎多肽OE-I干预后,线虫体内daf-2和age-1mRNA的基因表达量均显著下调,OE-I高剂量组线虫体内的daf-2和age-1mRNA表达量较空白组相比分别降低了69.1%和42.4%(P<0.01),daf-16mRNA相对表达量较空白组相比升高了80.2%(P<0.01)。skn-1是抵抗氧化应激最重要的机体防御分子,主要通过调节抗氧化酶相关基因的表达缓解氧化应激引起的机体损伤;sod-3是线虫体内超氧化物歧化酶家族成员之一,与线虫过氧化损伤和抗氧化酶有关。sod-3和mtl-1都是daf-16的下游基因,mtl-1对重金属毒性和氧化应激有一定的保护作用[24-25]。由图11B可知,经牡蛎多肽干预后,OE-I高剂量组线虫体内skn-1、sod-3和mtl-1mRNA相对表达量相比空白组分别升高了62.2%、51.4%和189.5%(P<0.01),这与实验组线虫体内SOD抗氧化酶水平提高的结果相一致。以上结果表明,牡蛎多肽OE-I可以上调daf-16及其下游基因mtl-1和sod-3,并上调机体防御分子skn-1,以及下调daf-2和age-1,从而延长线虫的寿命。

图11 牡蛎多肽对秀丽隐杆线虫衰老相关基因表达的影响Fig.11 Effects of oyster peptides on expression of senescence-related genes in C.elegans
3 讨 论
本研究以DPPH自由基清除能力、羟自由基清除能力、超氧阴离子自由基清除能力和亚铁离子螯合能力为指标,对牡蛎多肽体外抗氧化作用进行了探究,结果发现小分子组分OE-I(<5 kDa)的抗氧化活性最强。在本课题组前期的研究中,对组分OE-I的氨基酸组成和序列进行了鉴定,发现其主要含有10 个肽序列,前5 个丰度较高的多肽依次为SFGSGLTPQQQ、GEPGPEGPAGPIGPR、NAVNSLNSQP、GPQGLVGPAG、GEPGPEGPAGPI[6]。蔡树杏等[26]研究发现通过酶解获得的牡蛎酶解液中含有丰富的蛋白质、微量元素和维生素,有较强的抗氧化活性。叶昱辉[27]采用酶解法酶解近江牡蛎,将牡蛎多肽进行超滤分级并利用Sephadex G-25葡聚糖凝胶进一步分离纯化得到两个组分,并对抗氧化活性高的组分进行超高效液相色谱-串联质谱结构解析,结果发现有13 条多肽序列,其中含有较多的七肽,经牡蛎多肽干预后,UV辐照的HaCaT细胞活力有显著提升,牡蛎多肽可以通过调节相关通路的靶点基因的表达,从而调控HaCaT细胞的抗光老化效应,说明牡蛎多肽可以很好地抑制细胞中ROS自由基的生成。Wang Qiukuan等[28]研究了太平洋牡蛎水解肽的抗氧化活性,将经酶解之后的牡蛎多肽进一步用Sephadex G-15凝胶过滤层析分离,随后将分离的两个生物活性肽用Kromasil C18柱进行反相高效液相色谱纯化,并测定其氨基酸序列,发现两种新多肽在羟自由基和DPPH自由基清除能力方面表现出较高的抗氧化活性,其分子质量分别为518、440 Da。采用蛋白酶对牡蛎多肽进行酶解,能够得到大分子质量的牡蛎多肽,为进一步得到活性更高的牡蛎多肽,一般采用超滤法、离子交换色谱法、凝胶过滤色谱法和反向高效液相色谱法等对牡蛎大分子肽进行分离纯化,以获取生物活性更高的小分子肽[29]。结合以上研究结果与本研究抗氧化实验相关结果,表明牡蛎多肽对于自由基有较强的结合能力,具有较强的抗氧化活性,且多肽的分子质量越小,其抗氧化能力越强。
ROS是氧化代谢的有害产物,它们的积累会破坏细胞结构和组织,加速机体衰老[30]。一旦机体的抗氧化防御系统被破坏,过量的ROS会对细胞造成功能性的氧化损伤,因此,减少ROS积累已被证明是延缓衰老的有效策略[31]。同时,细胞会产生各种非酶和酶类物质来防止氧化反应,包括维生素、硒、CAT、SOD和GSH-Px等,它们能催化超氧化物降解产生氧和过氧化氢,从而抑制ROS的积累[32]。线虫体内抗氧化酶被认为是影响线虫寿命的关键因素之一,线虫体内抗氧化能力与寿命有一定的相关性[33]。李玉英等[34]研究连翘花黄色素对线虫在氧化应激下的保护作用,发现连翘花黄色素有很好的抗氧化活性,能显著提高线虫在氧化应激下的寿命,降低线虫体内ROS水平,同时提高CAT、SOD和GSH-Px活力,缓解了线虫体内的氧化应激损伤,证明线虫寿命与抗氧化有关。陈纯[35]通过线虫实验发现紫薯提取物能显著延长线虫的寿命,缓解线虫的衰老,线虫体内抗氧化酶活力有所增加,相关抗衰老基因表达量也有所上调,并与紫薯提取物的质量浓度有剂量关系。本研究以秀丽隐杆线虫为模型生物,探究牡蛎多肽组分OE-I对线虫寿命和体内抗氧化能力的影响,结果发现牡蛎多肽组分OE-I能显著提高线虫体内CAT、SOD和GSH-Px 3 种抗氧化酶的活力,降低线虫体内ROS水平,并减轻线虫DNA损伤,对线虫的寿命有显著的延长作用。以上研究表明,线虫寿命与抗氧化能力有一定的关联性,而牡蛎多肽能增强线虫体内抗氧化能力,清除有害的自由基,减轻线虫的氧化损伤;因此,牡蛎多肽可能是通过调节机体的抗氧化能力发挥其抗衰老作用。
胰岛素信号通路是研究机体衰老的重要信号通路之一,在胰岛素信号通路中,受体蛋白与胰岛素受体daf-2结合并激活age-1的表达,3-磷酸磷脂酰肌醇的水平增加,导致丝氨酸/苏氨酸蛋白激酶磷酸化,从而抑制daf-16的表达[36-37]。本研究结果表明,牡蛎多肽能显著下调daf-2和age-1mRNA的表达水平,而daf-16的下游基因sod-3、mtl-1mRNA的相对表达量都显著升高,sod-3与线虫体内SOD有关;因此,牡蛎多肽的抗衰老作用可能是通过上调sod-3的表达来减少ROS的积累。同时,daf-16和机体防御分子skn-1mRNA的相对表达量也显著升高,证明了牡蛎多肽能通过胰岛素信号通路daf-2/daf-16延长线虫的寿命,并能促进机体防御分子skn-1、sod-3和mtl-1mRNA的表达,进而介导机体应激抵抗,延长寿命。这与张晓寒等[16]研究发现根皮素通过调控daf-2、daf-16和sod-3mRNA的表达延长线虫寿命的结果一致,证实了daf-16在调节线虫寿命和抗氧化能力方面的重要性。
综上所述,牡蛎多肽组分OE-I具有较强的体外抗氧化活性,能显著增加线虫体内抗氧化酶的活力,减轻线虫体内ROS积累导致的氧化损伤和细胞凋亡,并通过调控胰岛素信号通路和氧化应激调控因子skn-1、sod-3和mtl-1的表达,有效延长线虫的寿命。今后将对牡蛎多肽组分OE-I进一步分离纯化,获得单一的牡蛎多肽组分,对其结构进行鉴定并开展抗衰老功能评价,采用转录组学、蛋白组学和代谢组学等方法对牡蛎多肽的抗衰老作用机制进行多层次的深入研究。总而言之,牡蛎多肽作为一种活性肽,具有较强的体外抗氧化活性,对增强机体抗氧化能力和延长寿命有一定的积极作用。
