不同冻结方式对猪肉肌原纤维蛋白乳化与凝胶特性的影响
2022-03-03栗俊广马旭阳周月莹白艳红
栗俊广,马旭阳,周月莹,王 昱,刘 骁,白艳红,*
(1.郑州轻工业大学食品与生物工程学院,河南 郑州 450001;2.河南省冷链食品质量与安全控制重点实验室,河南 郑州 450001;3.食品生产与安全河南省协同创新中心,河南 郑州 450001)
在肉及肉制品加工中,冷冻能更长时间保证肉制品的食用品质与安全。然而,传统冻结方式如空气冻结(air freezing,AF)等,冻结完成后通常会在肌肉细胞间形成大小不均的冰晶[1-2],其机械损伤会导致组织细胞萎缩变形,进而造成肌纤维扭曲断裂及蛋白质结构与功能特性的改变,引起肉品汁液营养损失、感官和质构劣变等问题,严重制约了肉品产业的发展。
超声波(20~100 kHz)在食品冻结中的应用已得到广泛探索[3]。Hu Songqing等[4]采用超声辅助冻结面团时发现冻结时间显著缩短;Sun Qinxiu等[5]发现超声诱导成核提高鲤鱼冻结速率的同时减小了样品的持水性劣变,维持了品质。此外,超声空化效应与机械作用还可修饰蛋白质,改变蛋白空间结构,调控产品功能特性。肌原纤维蛋白(myofibrillar protein,MP)约占肌肉总蛋白质量的40%~60%,对肉制品的嫩度、保水性、乳化凝胶性有着重要影响[6-7]。Rastogi等[8]阐明超声波能够促进MP在肉产品中的释放,并改善肉的韧性、嫩度和黏性。Arzeni等[9]利用高强度超声处理乳清蛋白浓缩物发现,样品的粒径减小,溶解度提高,可用于调控蛋白功能性质。
然而,目前关于超声波改善MP功能特性的研究主要集中在对MP本身的处理[10-11],针对肉及肉制品冻结过程的报道相对较少。因此,有必要探讨超声辅助浸渍冻结(ultrasonic-assisted immersion freezing,UIF)处理猪肉后MP功能特性的改变。因此,本实验以鲜肉为对照,对比研究AF、浸渍冻结(immersion freezing,IF)和UIF处理对猪肉中MP乳化凝胶功能特性的影响,旨在为超声波技术在肉品冷冻加工中的应用提供理论指导。
1 材料与方法
1.1 材料与试剂
新鲜的猪背最长肌和金龙鱼大豆油购于郑州市丹尼斯超市,猪肉样品保持在0~4 ℃于15 min内运至实验室。
标准牛血清白蛋白(bovine albumin,BSA)、乙二醇-双-(2-氨基乙基醚)四乙酸(ethylenebis(oxyethylenenitrilo) tetraacetic acid,EGTA) 北京索莱宝公司;NaCl、NaH2PO4、Na2HPO4、HCl、NaOH、MaCl2天津市大茂化学试剂厂;十二烷基硫酸钠 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
SJT-I-10L超声波辅助速冻仪 无锡新上佳生物科技有限公司;BPHJ-500C高低温交变箱 上海一恒科学仪器有限公司;AT4508多通路温度巡检仪 常州精密仪器有限公司;LS13320/ULM2激光粒度仪 美国贝克曼库尔特公司;BX53M偏光显微镜 日本奥林巴斯株式会社;Turbiscan LabMeasuringExpert多重光散射仪法国Formulaction仪器公司;Discovery旋转流动仪美国TA仪器有限公司;TA.XT plus型质构分析仪 英国Stable Micro System公司;NMI20低场核磁共振仪纽迈电子科技(苏州)有限公司;Regulus8100高分辨场发射扫描电子显微镜(high-resolution field emission scanning electron microscope,FE-SEM) 日本日立公司。
1.3 方法
1.3.1 样品制备
新鲜的肌肉样品去除四周可见的脂肪与结缔组织后,分割为6 cm×6 cm×3 cm大小的肉块,4 ℃冰箱保存6 h,以获得均匀的初始冻结温度。除对照组(4 ℃放置6 h)外,其余各组分别为AF、IF和UIF。其中,AF在(-20.0±0.5)℃高低温交变箱中完成。IF与UIF均在超声波辅助速冻仪(20 kHz、50~2 000 W、(-20.0±0.5)℃)中完成。其中,IF组冻结时,样品完全浸渍于95%的工业酒精中,不施加超声处理,而UIF组冻结时,当样品中心温度降至0 ℃时开启300 W超声,工作模式5 s开/5 s关。所有样品中心温度使用温度巡检仪实时监测,-18 ℃时冻结完成。
1.3.2 MP提取
MP的提取参考栗俊广等[12]的方法。将样品置于4 ℃冰箱中隔夜解冻后绞碎,先后分别与提取缓冲液(10 mmol/L Na2HPO4/NaH2PO4、2 mmol/L MgCl2、0.1 mol/L NaCl、0.1 mol/L EGTA,pH 7.0,4 ℃)和NaCl洗液(0.1 mol/L,4 ℃)以1∶4(m/V)混合、均质、3 000×g离心15 min,以上步骤重复3 次(4 ℃),得到MP。MP质量浓度采用双缩脲法测定,并用磷酸盐缓冲液(0.6 mol/L NaCl、50 mmol/L Na2HPO4/NaH2PO4,pH 7.0,4 ℃)调整蛋白质量浓度。
1.3.3 MP乳液及凝胶的制备
调整MP质量浓度至10 mg/mL,与大豆油4∶1(m/V)混合后,10 000 r/min均质20 s,重复均质3 次,得到新鲜MP乳液。调整MP质量浓度至30 mg/mL,1 000×g下离心5 min除去气泡(4 ℃),准确称取5 g MP(除去气泡后得到的部分)于10 mL烧杯中,保鲜膜封口,80 ℃水浴30 min,煮制后迅速置于冰水中降温,冷却后放于4 ℃冰箱12 h,得到MP凝胶。
1.3.4 MP乳液的乳化活性和乳化稳定性测定
参考Li Ke等[13]的方法测定MP乳液的乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsion stability index,ESI)。取50 μL的新鲜MP乳液与5 mL质量分数0.1%十二烷基硫酸钠溶液漩涡混合,于500 nm波长处测定吸光度并记为A0,室温静置10 min,同样方法读取底部MP乳液的吸光度,记为A10,EAI与ESI分别按公式(1)、(2)计算。

式中,ρ为MP乳液质量浓度/(g/mL);φ为油相体积分数(20%);N为稀释倍数(100)。
1.3.5 MP乳液粒径及微观分布测定
利用LS13320/ULM2激光粒度仪测定MP乳液的粒径分布及平均粒径。
吸取10 μL稀释的MP乳液于载玻片中心,利用偏光显微镜在放大100 倍下观察液滴形态及微观分布。
1.3.6 MP乳液动态光散射总体稳定指数测定
总体稳定指数(total stable index,TSI)的测定参考李可等[14]的方法。取制备好的新鲜MP乳液18 mL置于样品瓶中,使用多重光散射仪测定样品TSI,每60 s扫描一次,扫描总时间3 600 s。
1.3.7 MP乳液流变学特性测定
参考Yang Fang等[15]的方法使用旋转流动仪测定MP乳液的流变学特性。采用40 mm平板夹具,乳液加载于平行板之间,狭缝设置400 μm。角频率扫描参数:频率扫描记录储能模量(G′)和损耗模量(G″),应变设置为1%,角频率0.1~100 rad/s。
1.3.8 MP凝胶蒸煮损失率及凝胶强度测定
准确记录蒸煮前MP乳液的质量记为m0/g,80 ℃水浴30 min,于冰水混合物中快速冷却,吸干析出的水分,再次称质量记为m1/g,蒸煮损失率按式(3)计算。
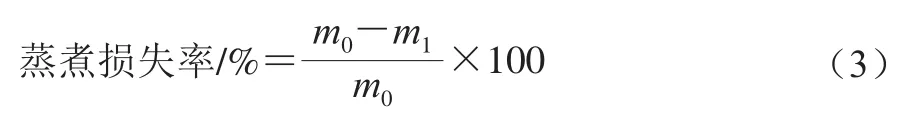
MP凝胶强度参考刘骁等[16]的方法并略作调整,具体采用质构仪测定。探头选择P/0.5,测前、测试与测后速度分别为2、1、2 mm/s,触发力5 g,压缩模式应变40%。每个处理组测6 个平行样品。
1.3.9 MP凝胶水分分布测定
使用纽迈核磁共振图像处理软件对MP凝胶中的氢质子密度进行成像扫描。样品成像采用Osiris软件进行伪彩处理。
1.3.10 MP凝胶微观结构观察
参考Zhou Feibai等[17]的方法并有所调整,将制备好的MP凝胶置于FE-SEM专用样品盘中观察凝胶微观形貌。液氮冻结后于样品制备腔室设置升华时间10 min,经5 mA、60 s的喷金溅射后,加速电压1 kV下,放大1 000 倍观察凝胶结构并拍照。
1.4 数据处理与分析
本研究所有实验均重复3 次,通过SPSS Statistics 25软件进行单因素方差分析,Duncan多重比较用于检验样本均值间的显著性,采用Origin 2019软件进行绘图。
2 结果与分析
2.1 不同冻结方式对MP乳液EAI和ESI的影响
MP的EAI与ESI对肉制品尤其是乳化型肉制品具有重要影响,包括质构特性、持水持油性等。MP的部分变性、结构的改变以及蛋白质粒度和比表面积的变化均会影响其在水-油界面的吸附能力。图1显示了不同处理方法的MP样品的EAI与ESI变化。其中,与对照组相比,AF、IF样品的EAI、ESI均有所降低,可能是缓慢冻结造成的蛋白变性和更多不溶性聚集体的形成,不利于MP在油滴表面的吸附,进而减弱了其乳化性。UIF样品的ESI相比于对照组差异不显著(P>0.05),且经超声处理后MP的EAI比对照组提高了37.83%,可能是超声的空化效应、剪切力及湍流作用破坏了MP聚集体,减小了MP粒径,增加了MP表面积/体积比,提高了MP的溶解度,使得乳化时更多蛋白参与界面层的形成[18]。

图1 不同冻结方法对MP乳液EAI和ESI的影响Fig.1 Effects of different freezing methods on EAI and ESI of MP emulsion
2.2 不同冻结方式对MP乳液粒径及微观分布的影响
乳液粒径通过影响乳析速度来影响其稳定性。不同样品的乳液粒径分布及平均粒径分别如图2A、B所示。相比于AF、IF更分散的液滴分布,UIF与对照组具有类似的更集中且均匀的液滴分布情况,可能是由于超声的空化作用维持了MP结构,减少了MP的聚集,使得MP乳液分布更加均匀。此外,与对照组相比,AF与IF样品的乳液平均粒径分别显著增加了92.7%和18.9%(P<0.05),可能是冻结过程中冰晶的形成对蛋白结构造成了破坏,加工冻藏期间导致更多的聚集体形成,从而增加了乳液的平均粒径[19]。经UIF处理的乳液平均粒径最小(22.23 μm),与对照组差异不显著(P>0.05)。较小的粒径增加了油滴表面吸附的蛋白含量,因此UIF处理更有利于维持乳液的稳定性[20]。

图2 不同冻结方式对MP乳液粒径分布(A)及大小(B)的影响Fig.2 Effects of different freezing methods on particle size distribution(A) and particle size (B) of MP emulsion
2.3 不同冻结方式对MP乳液稳定性的影响
多重光散射仪用于测定不同处理对MP乳液的物理稳定性及聚集程度的影响。TSI是对给定时间内乳液稳定性进行定量的指标,TSI越大,表明乳液稳定性越差。不同处理组MP乳液的TSI变化如图3所示。随着放置时间的延长,所有样品的TSI升高,且给定的3 600 s时间内,冻结造成了乳液稳定性下降。其中,AF样品的TSI最高,其次为IF,而UIF与对照组鲜肉TSI差异不明显,表明UIF时空化效应作用于MP,有助于乳液粒径减小,不易发生絮凝、聚集或相分离等失稳现象[14],3 600 s时间内稳定性更好。该结果与乳化稳定性变化趋势一致。

图3 MP乳液的TSI变化Fig.3 Change in Turbiscan stability index (TSI) of MP emulsions
2.4 不同冻结方式对MP乳液流变特性的影响
黏性和弹性对乳化型肉制品的加工具有重要影响。不同MP乳液的储能模量(G′)和损耗模量(G″)随振荡频率的变化如图4所示,在所有的样品中,G′与G″曲线接近平行,且G′远高于G″,具有弹性凝胶特征,且整个频率范围均表现较小的频率依赖性[21]。与对照组相比,冻结处理降低了样品的G′和G″,表明冷冻引起了蛋白质分子变性,造成天然构象的改变和结构解折叠,蛋白变性越大,样品G′和G″越低[22]。在所有处理组中,UIF具有较高的G′和G″,表明MP乳液具有较好的黏弹特性。

图4 不同冻结方式对MP乳液G′、G″的影响Fig.4 Effects of different freezing methods on G′ and G″ of MP emulsion
2.5 不同冻结方式对MP凝胶蒸煮损失率和凝胶强度的影响
不同凝胶样品的蒸煮损失率如图5所示。与对照组相比,AF、IF造成了蒸煮损失率的显著升高,分别提高了1.12%和0.94%(P<0.05),而UIF蒸煮损失率与对照组差异不显著。持水性的改变可能与MP中肌球蛋白的完整性有关,冻结生成的冰晶造成蛋白的结构损伤与变性,不利于形成良好的凝胶网络,导致持水力的下降[23-24]。UIF样品蒸煮损失率与对照组相比略微增加,但低于AF和IF样品,可能源自于超声空化引起的物理化学效应加速了冻结过程,部分展开了MP结构,暴露了相应的活性基团,加热过程中有利于蛋白-蛋白相互作用,形成更紧密均匀的凝胶网络结构,增加其持水力,减少蒸煮损失。
凝胶强度是反映MP凝胶特性的一个重要参数。图5反映了不同处理下MP凝胶强度的改变。与对照组(155.66 g)相比,AF、IF和UIF样品的凝胶强度分别降低了52.73%、26.44%和17.96%(P<0.05)。加热凝胶化过程MP的聚集与解折叠速率对凝胶的形成至关重要[25]。AF造成了蛋白二三级结构的破坏,暴露了更多的疏水基团和活性巯基[26],因此加热凝胶化时蛋白解折叠速率慢得多,聚集速率较快,形成的凝胶粗糙松散,降低了其凝胶强度。相反,UIF处理可以减小凝胶的弱化,凝胶强度保持较好。
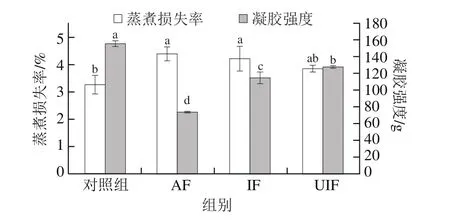
图5 不同处理对MP凝胶蒸煮损失率及凝胶强度的影响Fig.5 Effects of different freezing treatments on cooking loss and gel strength of MP gel
2.6 不同冻结方式对MP凝胶水分分布的影响
为了进一步研究MP凝胶内水分分布状态,采用核磁共振成像技术结合伪彩处理对凝胶中氢质子密度进行测定,结果如图6所示。从蓝色到红色依次代表水分含量的增加[27]。对照组显示出更强的质子密度,且水分分布最均匀,冻结后不同样品显示出不同程度的质子密度及水分含量的降低。与对照组鲜肉相比,AF成像有明显的红黄分界,IF的红黄分界线与AF相比略变模糊,但颜色分布仍不均匀。相反,UIF样品的凝胶成像颜色均匀度提高,说明UIF处理更好保持了MP凝胶的持水性,水分分布更加均匀。肌球蛋白是唯一在加热后参与凝胶形成的蛋白质,UIF提高了冻结速率,减缓了肌球蛋白变性,形成了孔径小、连续均匀的凝胶网络结构,因此合适的毛细管力增强了凝胶的持水能力。

图6 不同处理对MP凝胶水分分布的影响Fig.6 Effects of different freezing treatments on water distribution in MP gel
2.7 不同冻结方式对MP凝胶微观结构的影响
不同处理组的MP凝胶微观结构如图7所示。AF样品显示出较大空腔且松散的凝胶网络结构,蛋白质束部分断裂,可能是缓慢冻结形成的大冰晶挤压、扭曲肌纤维,造成MP变性,加热时蛋白过度聚集,最终形成的凝胶疏松多孔不连续,毛细管力降低,进而导致持水性的降低。UIF样品形成的凝胶网络结构更加密实、均匀,与鲜肉最为接近,可能是超声的空化效应加速了冻结过程,减弱了蛋白变性,更多MP参与凝胶的形成,重新聚合后MP分子间结合更加紧密[28]。此外,超声也可能通过减小粒径或加强蛋白二硫键及疏水作用促进形成了密集的凝胶网络[22]。Wang Yaoyao等[20]也发现超声减小MP粒径有助于形成更小间距蛋白凝胶,本研究结果与之相似。

图7 不同处理组MP凝胶FE-SEM图Fig.7 FE-SEM images of MP gels in different treatment groups
3 结 论
研究发现UIF可以提高猪背最长肌MP乳化活性,抑制冻结后乳化稳定性的降低,更好地保持其乳化凝胶性能。与鲜肉相比,AF、IF乳液平均粒径分别显著增加了92.7%和18.9%,而UIF增加不显著。流变学结果显示,UIF样品相比于其他冻结处理组具有更高的G′和G″值,表明UIF抑制了MP乳液黏弹性的劣变。经蒸煮后,UIF样品的蒸煮损失率与鲜肉相比差异不显著(P>0.05),并低于其他冻结组,且凝胶强度更大,水分分布更均匀。FE-SEM结果显示,UIF组MP凝胶网络结构更为均匀致密,与对照组MP相似,孔隙明显小于其他冻结处理组。因此,与其他冻结方式相比,UIF猪肉MP乳化性与凝胶功能最佳,与鲜肉组最为接近,更有利于保持肉的加工品质。
