基于三代高通量测序技术的不同养殖环境下日本医蛭微生物多样性研究△
2022-03-03柴晓昕甘奇超赵瑞亭史景彦郭平牯袁渊马莉
柴晓昕,甘奇超,赵瑞亭,史景彦,郭平牯,袁渊,马莉*
1.首都医科大学 中医药学院,北京 100069;2.重庆多普泰制药股份有限公司,重庆 400800
水蛭作为一种传统动物类中药,具有破血、逐瘀、通经之效[1],日本医蛭Hirudo nipponicaWhitman为《中华人民共和国药典》2020 年版收录品种,具有极大的药用价值。目前,由于人类过度捕捉及农药化肥的使用,日本医蛭野生资源锐减。因此日本医蛭养殖行业逐渐兴起并不断扩大。
人工养殖水蛭过程的关键技术包括环境水质[2-5]、养殖密度[5-7]、水体温度[2,6-7]、饲喂血液类型[8-9]等。其中水源作为日本医蛭生存生活的主要条件,将直接影响其生长。地下水是现有内陆水产养殖的重要水源之一[10],但资源有限、开采有难度,目前已有养殖户采用符合养殖标准的自来水试养日本医蛭,但水源改变是否会对水蛭养殖产生影响尚缺乏报道。
水蛭的生物学特性及其药用价值使得其体内的微生物广受关注。水蛭体内的微生物经过长期共同进化,最终形成复杂且呈动态平衡的微生物群落,对水蛭的健康具有极其重要的意义[11]。水蛭的消化系统十分完善,但存在于消化道内的消化酶是相当稀少的[12]。有研究发现,日本医蛭进行消化作用是靠与其共生的蛭假单孢杆菌Pseudomonas hirudins,通过培养基接种实验证实,该共生菌不仅可分解蛋白质和脂肪,还可抑制其他细菌,从而保持水蛭嗉囊中的血液不会腐败[13-14]。一些有益微生物能够在动物体肠道内定植并生长繁殖,维持肠道菌群的高水平稳定,预防肠道疾病。随着微生物鉴定技术的不断发展,因16S rDNA基因测序技术可以从遗传物质和分子水平上对微生物进行鉴定,其稳定性和特异性获得普遍认可,越来越多地应用于微生物鉴定中[15]。基于此,本研究从日本医蛭肌肉及肠道的细菌多样性角度入手,采用PacBio 三代高通量测序技术,对自来水养殖与地下水养殖的日本医蛭取样,对比2 种水质环境下水蛭的微生物多样性,评估自来水养殖水蛭的可行性。
1 材料
1.1 样品
新鲜日本医蛭样本采集于重庆市多普泰水蛭养殖基地(N28°56′52.29″,E106°55′53.31″),平均个体质量1.36~1.50 g。由北京协和医学院药用植物研究所石林春副研究员鉴定为日本医蛭Hirudo nipponicaWhitman。
1.2 试剂与仪器
D3146 细菌DNA 提取试剂盒(广州美基生物科技有限公司);NanoDrop One 型超微量分光光度计(Thermo Fisher Scientific公司)。
2 方法
2.1 样本采集及处理方法
水蛭养殖于聚乙烯塑料箱中,以新鲜猪血为饵料,养殖用水分别为自来水和地下水,水温为(26±1)℃,pH 为7.0±0.3,保证养殖箱内常流水,且每24 h 全部换水1 次。其中,自来水经充分曝气除氯后使用,地下水直接抽提使用。
经过为期90 d 的试验养殖,以自来水养殖水蛭为实验组,地下水养殖水蛭为对照组,将日本医蛭速冻处死后,还软30 min。在无菌状态下使用无菌解剖刀和镊子进行解剖。先分离肠道组织,并用滤纸将其中的血液吸尽后放入冻存管中,自来水组样本编号为B1,地下水组样本编号为B2。后分离肌肉组织,用灭菌剪刀、解剖刀切取约1 cm2的组织块,将组织块放入冻存管中,自来水组样本编号为M1,地下水组样本编号为M2。样品液氮速冻,置于-80 ℃冰箱保存备用。为保证样本均一性,每只水蛭均在同一部位进行取样,且同一取样点只取1 次,每组重复3次。
2.2 微生物总DNA 提取及聚合酶链式反应(PCR)扩增
各样品经液氮研磨后将粉末分别置于无菌离心管中,利用微生物DNA 提取试剂盒提取样品基因组DNA。检测DNA纯度和质量浓度。使用引物为27F:5′-AGRGTTYGATYMTGGCTCAG-3′和1492R:5′-RGYTACCTTGTTACGACTT-3′,扩增16S rRNA 基因 V1~V9 高变区[16],根据 16S Amplification SMRTbell®文库制备流程获得测序文库,并在PacBio Sequel Ⅱ平台上对该文库进行测序[17]。建库及高通量测序在广东美格基因科技有限公司完成。
2.3 数据优化及统计分析
根据各样本的Barcode 序列,使用Limma 1.9.0软件从下机数据中拆分出各样品数据,经过CCS 3.4.1 软件校正过滤掉过长或过短、subread 数过少的序列,得到Raw reads。最后进行引物切除、简单重复序列(SSR)去除和嵌合体去除,得到Clean fastq。采用UPARSE usearch 10软件对所有样品过滤后的数据按照97%的相似性水平聚类成操作分类单元(OTU)[18]。然后进行多样性分析,采用QIIME 1.9.1软件计算Chao1、Shannon和Simpson等α多样性指数,评估单个样品中的物种丰富度和多样性;用QIIME 1.9.1 软件计 算Bray-curtis、Weighted Unifrac 和Unweighted Unifrac 距离等β多样性指数,通过非度量多维尺度法(NMDS)对比不同样本组间群落多样性差异;通过统计相对丰度超过1%的物种,分析样本群落结构及关注的物种;利用相似性分析(ANOSIM)检验不同养殖组样本间差异是否有统计学意义。
3 结果与分析
3.1 微生物群落多样性分析
通过对2 种环境中养殖的日本医蛭肌肉及肠道组织样本(M1、M2、B1 和B2)16S rDNA 基因V1~V9(全长)区域进行扩增后测序,共得到69 368 条高质量DNA 序列,长度分布在1412~1443 bp,符合16S rDNA基因的V1~V9区序列长度,共包含83 个OTU。所有日本医蛭样本的Shannon 指数稀释曲线均趋于平缓,表明测序深度已覆盖水蛭菌群的绝大部分物种(图1)。
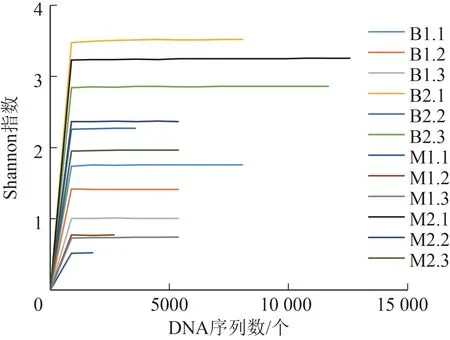
图1 日本医蛭样本的Shannon指数稀释曲线
对不同样品在97%一致性阈值下进行α多样性分析,采用Chao1 指数、Shannon 指数、Simpson 指数综合表征物种多样性。其中Chao1 指数常用于反映样品中群落的丰富度,Chao1 指数值越大,说明物种数量越多;Shannon 指数及Simpson 指数综合评估群落中物种的丰富度和均匀度,Shannon 指数越大,说明群落具有越大的多样性;Simpson 指数越大,说明群落具有越大的多样性(计算随机取样时取到不同物种的概率)。如表1 所示,与自来水养殖的水蛭样品相比,地下水养殖水蛭的肌肉及肠道样本均具有更多的物种数量且群落具有更大的多样性。
表1 水蛭样品的α多样性指数分析(, n=3)
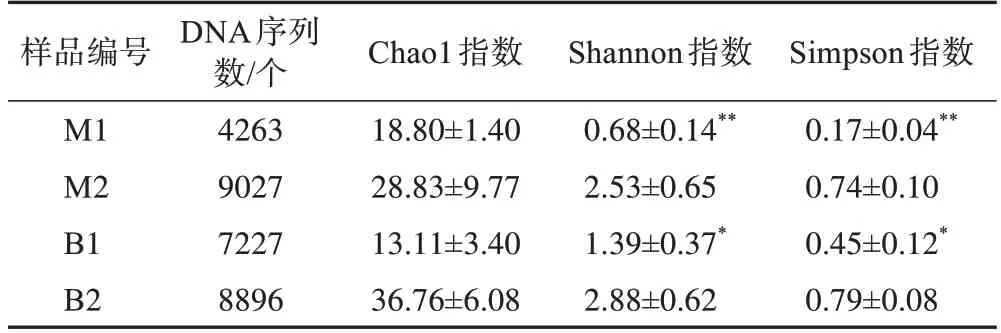
表1 水蛭样品的α多样性指数分析(, n=3)
注:不同养殖组同一类组织样本比较,*P<0.05,**P<0.01。
为克服主坐标分析(PcoA)等基于线性模型的排序方法的缺点,选用NMDS 反映水蛭肌肉和肠道组织细菌群落的β多样性。从NMDS 分布图(图2)可以看出,日本医蛭肌肉组M1 内的样品间距离更近,微生物群落也更加相似;肠道组B1 和B2 有部分重叠,排列在左上侧。NMDS分析的stress为0.1,可认为排序结果相对可靠。
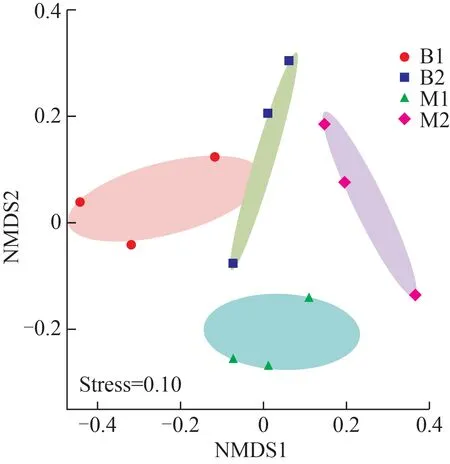
图2 日本医蛭样品微生物群落NMDS排序
3.2 日本医蛭肌肉及肠道样本的细菌群落结构
4组样本中的细菌共鉴定出8个门、13个纲、25个目、46 个科、48 个属。在此基础上,在不同分类水平上分别提取序列信息,计算各物种的相对丰度。选取相对丰度在1%以上的物种绘制条形图,反映不同样本在不同分类水平上的细菌组成(图3)。在门水平上,4 组日本医蛭样本中的优势门为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)及梭杆菌门(Fusobacteria)。在属水平上,M1、M2、B1、B2中所占比例最高的分别为氨基杆菌属(Aminobacter)、Elstera、Morganella及黏液菌属(Mucinivorans)。
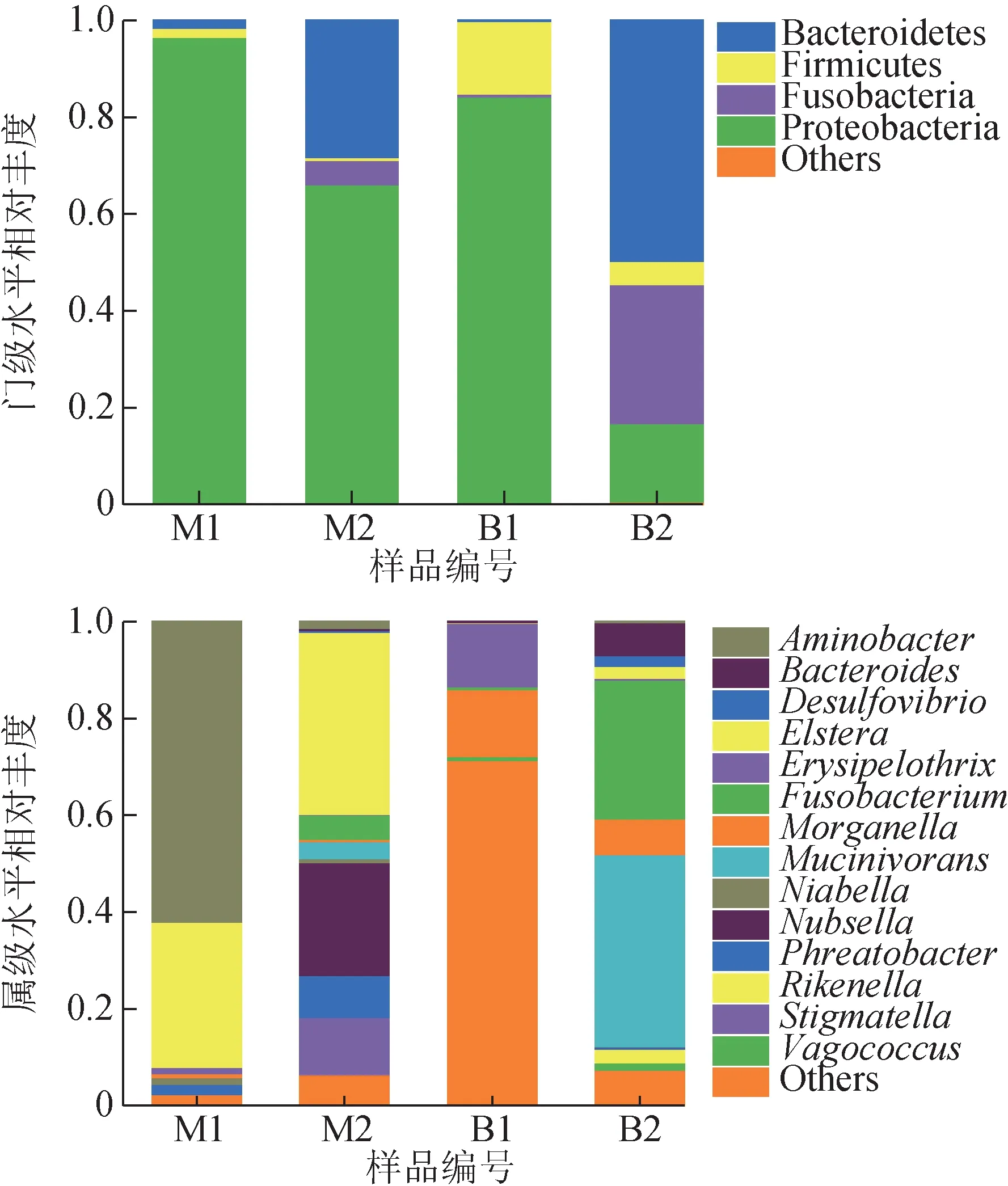
图3 日本医蛭样本的细菌群落结构
属水平的聚类热图(图4)表明,地下水养殖组肌肉与肠道聚为一簇,自来水养殖组肌肉与肠道聚为一簇。结合图3~4,与M1、B1 相比,M2、B2的细菌丰度和多样性均发生变化,表现出更为丰富的细菌群落结构。其中,黏液菌属(Mucinivorans)、梭杆菌属(Fusobacterium)、拟杆菌属(Bacteroides)等有潜在致病风险的菌属相对丰度在自来水养殖组中明显低于地下水养殖组。
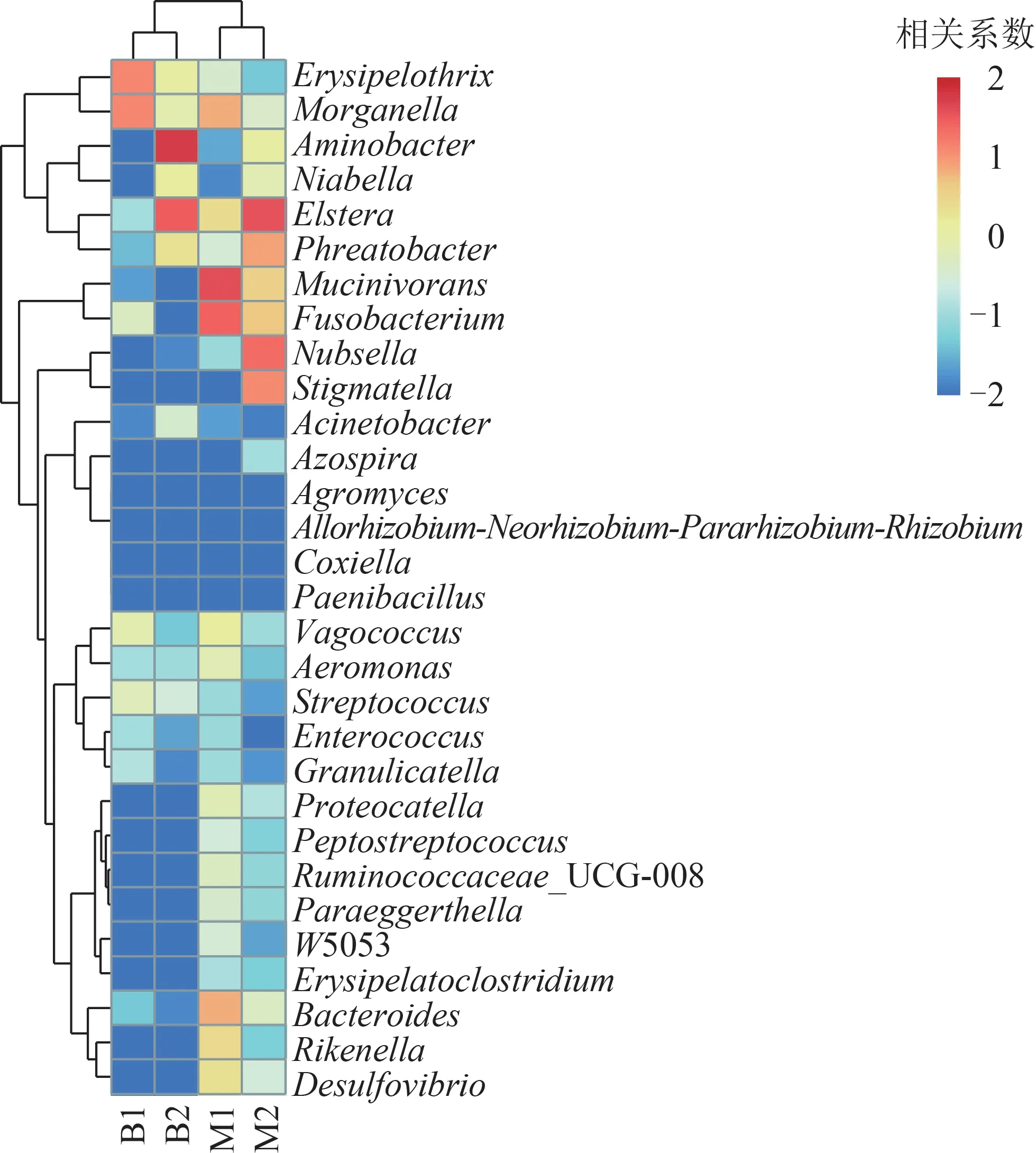
图4 日本医蛭样品属水平的分层聚类热图
采用Anosim 对不同养殖组医蛭同类组织样本间的群落结构的差异进行分析,结果显示,肌肉样本组间R=0.481,P=0.200,肠道样本组间R=1.000,P=0.333,提示不同养殖组的同类组织样本间差异无统计学意义。
4 讨论
基于水蛭的生活习性及养殖成本,人工养殖过程中的水环境对提高日本医蛭的产量尤为重要。本研究应用地下水与除氯的自来水对水蛭开展90 d 的养殖,水蛭生长状况均良好。与地下水养殖的水蛭相比,除氯自来水养殖的水蛭微生物群落表现出更小的多样性,但差异无统计学意义,因此认为采用自来水开展水蛭养殖工作是可行的。自来水是指通过汲取江河湖泊及地下水、地表水,由自来水厂经过沉淀、消毒、滤过等工艺流程的处理,生产出来的符合相应标准的供人们生活生产使用的水,水质稳定且资源相对易得,对养殖户来说成本也较低,可考虑将其充分曝气除氯后,作为地下水替换资源进行水蛭养殖。
水蛭体内的微生物在长期的进化过程中和水蛭形成共生关系。共生是物种进化的重要驱动力。因此研究药用水蛭的共生体具有重要意义[19]。本研究中,除氯自来水养殖组日本医蛭的肌肉及肠道样本的优势菌属分别为氨基杆菌属(Aminobacter)和Morganella。其中,Aminobacter来源主要为土壤环境,在受污染的土壤或水环境中有很强的应用潜力。该菌属中目前已知有3 种微生物,即ASI1、ASI2 和MSH1。这3 种微生物能够将农药代谢物2,6-二氯苯甲酰胺(BAM)矿化成CO2、NH4+和Cl-,将BAM 作为唯一的碳源、氮源和能源[20]。Morganella属于肠杆菌科的Proteeae属,积累的数据表明,其可引起多种感染,如败血症、脓肿、尿袋综合症、绒毛膜羊膜炎和蜂窝织炎。这种细菌通常会导致某些感染患者的高病死率。但也有研究认为其是不寻常的机会病原体,主要引起术后伤口和尿路感染[21-22]。另一方面,在对相对丰度排名前30 的物种进行统计分析时,发现其中存在的Aeromonas和Rikenella为目前已知的2 种水蛭共生菌[23]。Aeromonas是革兰阴性兼性厌氧菌[24],可产生大量的出口水解酶,帮助水蛭消化道内的营养物质分解,并且对摄入的动物血液具有杀菌作用。Tasiemski等[25]研究发现,水蛭与Aeromonas均可产生抗生素类物质,这些物质为其提供了针对侵入性细菌的相互保护,并且有助于水蛭肠道菌群的稳态,这种免疫优势是水蛭与Aeromonas间有稳定的进化关联的强有力证据。Whitaker 等[26]研究发现,如果从水蛭消化系统的共生天然菌群中去除了Aeromonas,则可能会产生更具毒性的细菌,影响水蛭的健康。Rikenella是专性厌氧菌,是拟杆菌属的成员,该物种倾向于在食血生物的胃肠道中定殖。有研究认为其对物种的进化适应和消化道生态系统具有一定的生理贡献[27]。但其在胃肠道内发挥的作用还未明确[28]。有研究指出Rikenella是肠道内具有保护性功能的菌群,小鼠灌胃呕吐毒素(DON)可使肠道Parabacterodies和Mucispirilla炎症敏感菌群及有益菌Rikenella的丰度降低,进而引起肠道炎症发生,导致肠道损伤同时危害机体健康[29]。Ott 等[30]认为Rikenella在宿主的肠胃中与Aeromonas具有协同作用,对Aeromonas的维持和增殖起到保护作用,而同时Aeromonas可减少氧气供应,从而使厌氧的Rikenella得以栖息。
随着日本医蛭养殖业的发展,人工养殖过程中日本医蛭的疾病爆发也越来越频繁。虽然传统化学药物和抗生素疗效显著,但大多都会在动物体内有残留,尤其长期使用还将导致耐药菌滋生,给后期食品、药品的使用带来安全隐患。从共生菌、有益微生物等角度出发研制的微生态制剂不仅能够抑制有害细菌、调节动物肠道微生态环境,还能提高水产动物的品质和产量,已有部分养殖户开始投入使用。张彬等[31]研究比较了硝化细菌T1、光合细菌T2和EM 复合菌T3 对菲牛蛭养殖水体的净化效果,结果表明这3 种有益微生物制剂均有显著增加水体溶氧量及降低氨氮、亚硝态氮、化学耗氧量的效应,达到水体净化作用,其中以EM 复合菌的净化效果最佳。张涛等[32]研究发现,新鲜猪血饲料辅以一定量的嗜水气单胞菌可以在一定密度下降低日本医蛭的病死率。刘飞等[33]研究发现,在饵料中适当加入粪肠球菌和丁酸梭菌也可以降低日本医蛭的病死率。因此,在日本医蛭的人工养殖过程中,建议扩大对日本医蛭的有益微生物的研究,研制微生态制剂,提高日本医蛭的产量。
