运用超高密度标测方法行二尖瓣瓣膜置换术后持续性房性心律失常的标测及消融*
2022-03-03李希张劲林陈艳红赵安全
李希 张劲林 陈艳红 赵安全
持续性房性心律失常是瓣膜病外科手术后远期常见的心律失常,其房性心律失常机制包括:手术相关心房切口、疤痕、自身心房肌病变[1],外科术中常常又同时行Maze术(Maze-IV)让其房性心律失常电生理机制进一步复杂化,增加了心动过速激动标测及消融的难度,常规三维标测结合拖带可提高此类心律失常标测及消融的成功率[2—3],然而仍存在许多局限性。面对相对复杂的瓣膜术后甚至合并Maze术后的房性心律失常,本院采用非逐点超高密度标测(Rhythmia系统)来进行标测及消融。笔者就该方法进行阐述。
1 资料与方法
1.1 一般资料 连续入选2016年11月至2018年12月既往在本院进行二尖瓣置换术后持续性房性心律失常患者(排除持续性心房颤动患者),入选病例二尖瓣置换术均在本院采用房间隔切口手术途径,部分病人采用迷宫IV 术式运用单极或双极消融笔进行消融,消融路径包括:双侧肺静脉消融、肺静脉至左心耳消融线(左心耳结扎或切除)、二尖瓣峡部消融线、沿界脊上、下腔静脉连线、下腔静脉至三尖瓣环连线。
1.2 术前准备 所有患者手术前均经食管超声心动图除外左房血栓。患者服用华法林则于术前1d停用并改为低分子肝素皮下注射抗凝。术前停用Ⅰ类抗心律失常药物至少5个半衰期。所有患者术前均行心脏增强CT 检查了解左房及肺静脉解剖形态,所有患者术前行经胸超声心动图检查测量左房内径(LAD)和左室射血分数(LVEF)。
1.3 心内电生理检查 术中使用多导电生理仪实时记录患者12导联心电图及腔内电生理图(GE 多导电生理仪,美国通用电气公司)。静脉全身麻醉患者,经左锁骨下静脉(左锁骨下静脉穿刺失败者经右侧锁骨下静脉)放置10极冠状静脉窦导管,经右侧股静脉行房间隔穿刺,穿刺成功后行左房、肺静脉造影。应用Rhythmia三维标测系统(波士顿科学公司美国)进行激动标测。房性心动过速(简称房速)发作时,在可控弯长鞘(Agilis;美国雅培公司)支撑下应用Orion多极网篮电极(Orion;波士顿科学公司)进行激动标测。标测系统基于以下原则自行采点标测:①心动过速周长稳定,周长变化在10 ms内;②2个冠状静脉窦参考电极之间的相对激动时间差在5 ms内;③呼气相的呼吸门控,阈值设置为峰G 峰振幅的50%;④导管位置稳定在1 mm 以内,导管记录到稳定的心电信号持续时间至少在75%的心搏间期;⑤电极与心腔表面接触最大距离≤2 mm。大折返房速定义:折返激动围绕一个中心障碍区,且心动过速周长可覆盖整个心房激动时间的90%以上。如果不存在明显的中心障碍区,且在一个很小的局部区域(表面直径<3 cm)可记录到覆盖心动过速周长90%以上的电位,同时心房其余区域为离心扩布传导时,定义为局部微折返性房速。
1.4 射频消融 激动标测明确房速机制后,消融靶点为折返环路的最窄的峡部传导通道,消融后将原瘢痕与电解剖屏障形成的峡部传导通道形成线性损伤,从而导致其解剖的传导阻滞。射频能量采用头端3.5 mm 的冷盐水灌注端导管,设定功率30~35 W,温度43℃,盐水流速17~30 m L/min。射频消融过程中房速终止转为窦性心律或目标房速转为另一种不同的房速定义为目标房速的终止。术后通过心房递增脉冲起搏刺激至最小起搏周长为200 ms或起搏直至心房组织的局部有效不应期进行诱发,证实房速不能诱发为手术终点。若诱发出不同激动顺序的心房扑动(简称房扑)或房速,则继续重复以上步骤进行激动标测及消融,直至心动过速不诱发。术中若进行三尖瓣及二尖瓣峡部的线性消融,则消融后再次通过Orion网篮标测电极,在起搏标测下验证消融线的双向传导阻滞。
1.5 术后围手术期及随访 所有患者均于术后在院进行持续心电监护(最初24~48 h),并口服华法林,维持国际标准比值(INR)2~3之间。术后1、3、6、12个月进行临床随访,每次随访除了进行常规心电图及INR 检测外,每3个月还需要行24 h动态心电图或者长时程单导联动态心电图筛查无症状房性心律失常及经胸心脏彩超评估瓣膜功能。此外,术后1、3、6、9、12个月均由经验丰富的随访者对患者进行电话随访,入选患者亦被要求在出现心律失常相关症状时尽量完善心电图检查。
1.6 统计学处理 连续变量以±s表示,采用SAS9.2统计软件进行统计分析。
2 结果
共有43例患者,其中男性22例,年龄(55±9)岁。左房内径(46.9±5.9)mm,左室射血分数LVEF 0.05±0.07。瓣膜置换(生物或机械瓣膜)22例,瓣膜置换(生物或机械瓣膜)+Maze 21例。共标测出房性心律失常数量为50种,其中三尖瓣峡部相关房扑13例(26%)(图1),标测时间(13.1±4.2)min,二尖瓣峡部房扑10例(20%)(如图2),肺静脉gap相关房扑11例(22%)(图3),房间隔切口相关房扑9 例(18%)(图4)、右房游离壁切口1 例(2%)(图5)、心房疤痕相关4例(8%)(图5)、局灶房扑2 例(4%)。单一机制心动过速患者28例(56%)。无消融相关并发症,术中即时成功率100%,术后总成功率88%,随访(23±11)个月。术后5例患者随访发现复发并再次行射频消融术,复发心律失常均与原心律失常机制不同,均消融成功(仍继续随访中)。
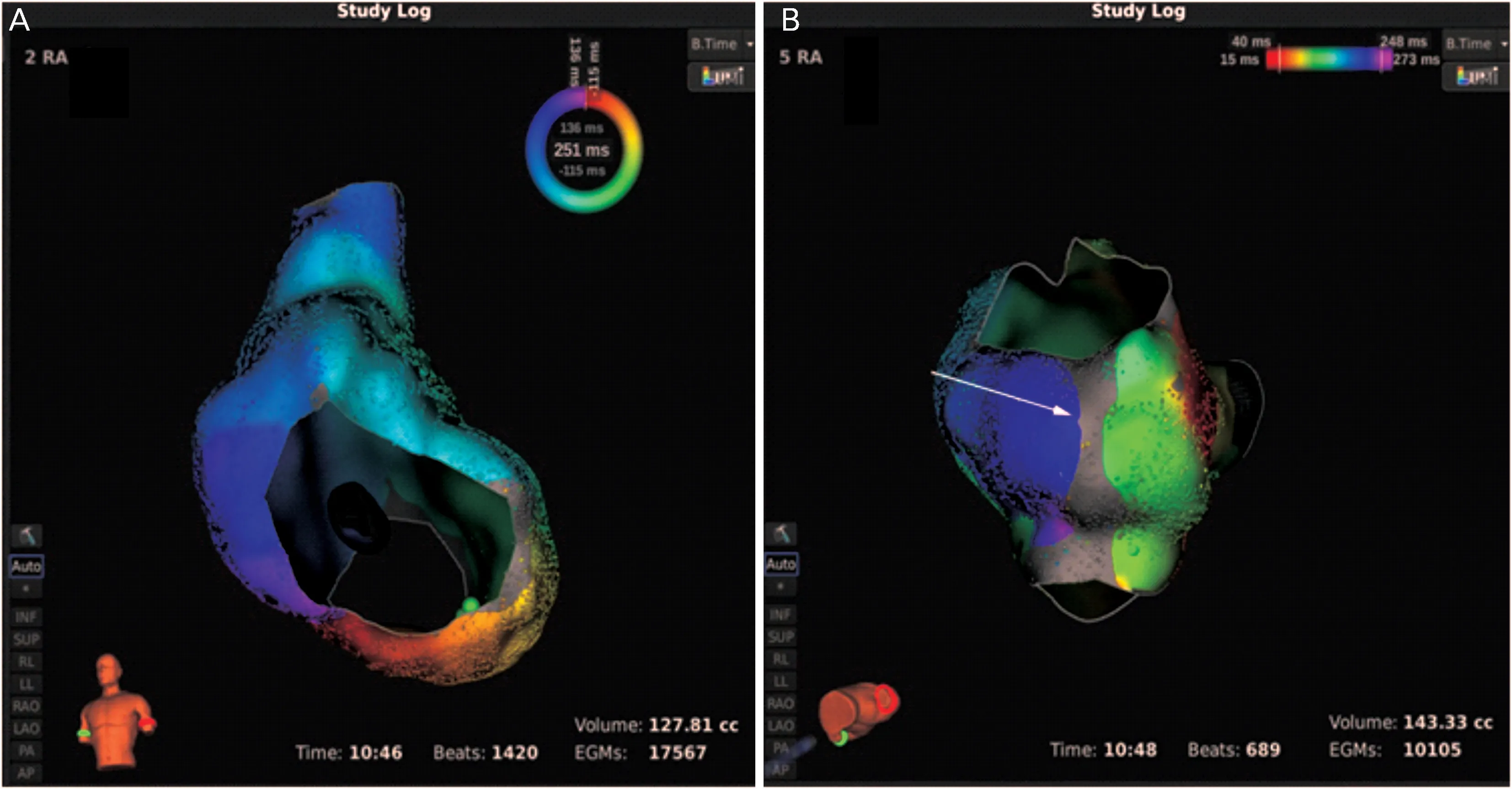
图1 围绕三尖瓣峡部大折返型房扑
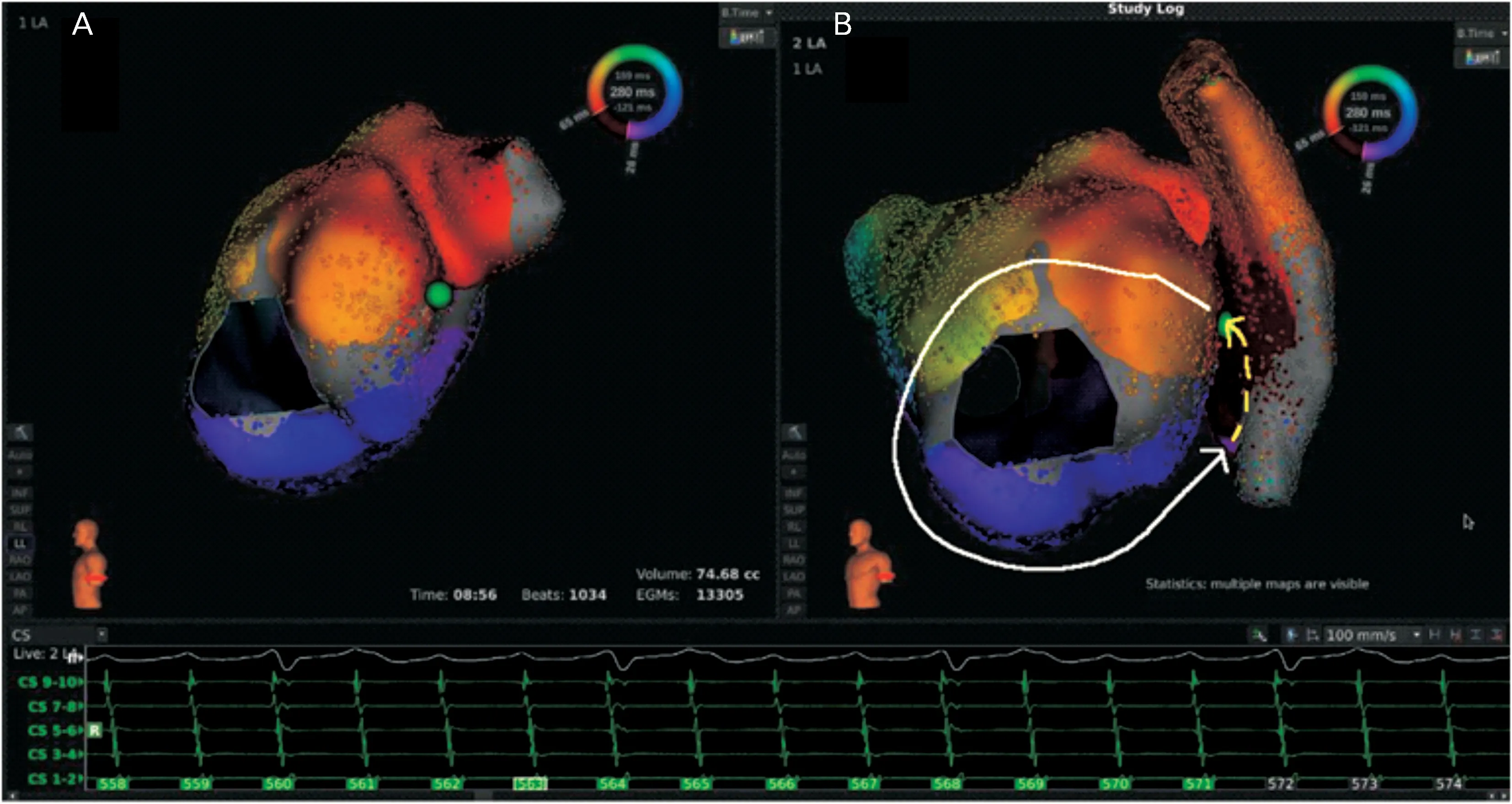
图2 二尖瓣峡部折返性房扑
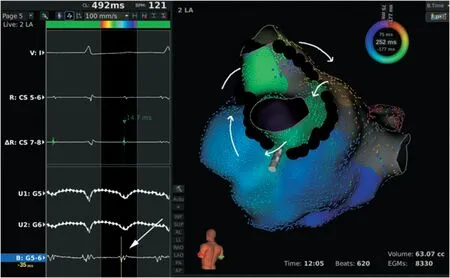
图3 肺静脉gap相关房扑
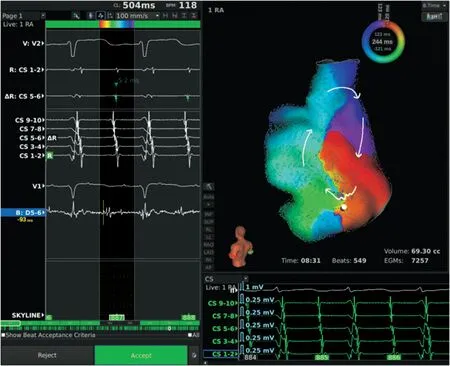
图4 经房间隔切口相关房扑
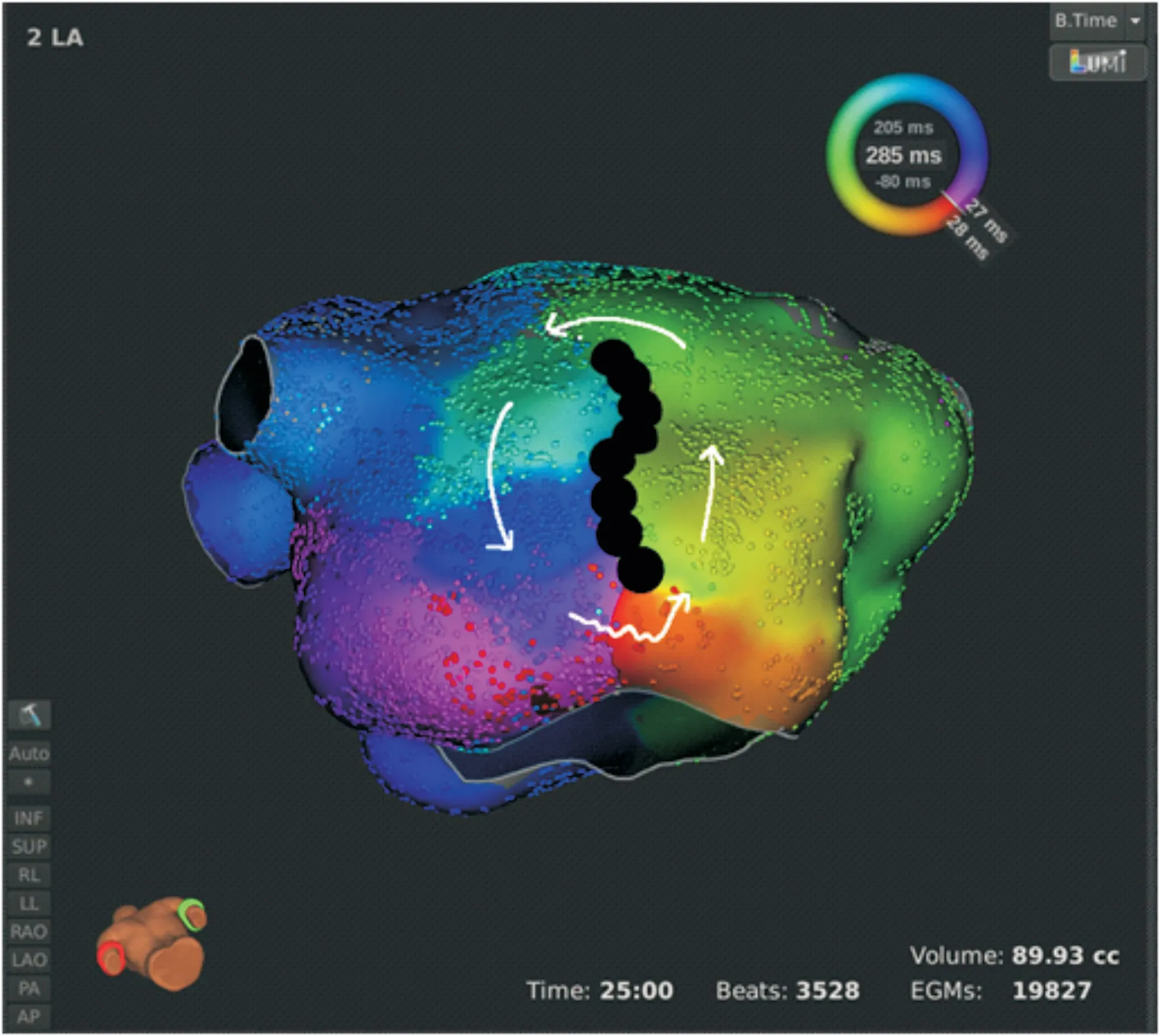
图5 疤痕相关房扑
3 讨论
外科术后持续性房性心律失常,特别是二尖瓣瓣膜置换术后患者出现的早期或晚期房性心律失常较为多见,本院入选病例中通过二、三尖瓣峡部大折返型房扑仍占大多数(23/50),和既往文献报道相符[4—5],进行峡部线性消融并实现峡部完全双向传导阻滞是消融的金标准[6—7],目前临床上多种验证峡部双向阻滞方法,比如:出现特征性双电位,消融前后峡部传导时间延迟50%以上,差异性起搏、峡部传导时间≥130 ms等,但仍然无法直观的体现消融线的连续性以及峡部显著的缓慢传导[8—9],本院运用Rhythmia系统,通过送入Orion网篮标测电极,快速进行左右房标测出三尖瓣/二尖瓣峡部大折返(图1),完成峡部线性消融后,通过CS电极或左心耳固定频率起搏状态下,运用Orion网篮标测电极再次进行左房及右房三维电重建,可明确峡部线性消融的连续性、是否阻滞(图2),如果消融线没有完全阻滞,标测中可以发现消融线上的gap位置,并指导导管进行gap附近局部放电消融,从而完成消融线的双向阻滞,运用超高密度标测明显提高峡部消融的效率及成功率。
除开二尖瓣、三尖瓣峡部大折返性房扑,不连续的外科手术切口及外科消融线,也是导致心律失常原因,传统三维标测系统的出现对于此类复杂心律失常成功率明显提升[10],然而在临床工作然而仍存在许多局限性,比如必须采取逐点标测解剖及电位、在标测中遇到双电位、碎裂电位、局部低电压区域需人工进行逐点校正,心肌出现较多的低电压、碎裂电位区时激动标测准确率明显下降。面对较为复杂的二尖瓣置换外科术后甚至合并Maze术后房扑,本院采用非逐点超高密度标测来(Rhythmia系统)进行标测,快速发现不连续消融线及切口的缓慢传导区内的细小碎裂电位,如不连续的外科Maze消融线导致的房扑(图3)及外科切口的gap(图4),并且可以精确消融缓慢传导区域,从而成功终止心动过速。
由于风湿性心脏病患者,心房不同程度纤维化,导致局部自身疤痕形成,也是持续性房性心律失常形成的机制之一,如图5所示。
虽然超高密度标测系统能给复杂的二尖瓣瓣膜置换术后持续性房性心律失常的标测带来极大的便利,但是术前了解外科手术的术式也是同样重要,因为不同的心脏中心在同一手术其手术方式存在差异,比如本院外科行二尖瓣置换术式,通常采用经房间隔途径,故术后出现房间隔切口相关房性心律失常(如图4)占比较多(9/50),这对术中心律失常机制的判断也起到一定提示作用。
对于外科换瓣术后,甚至同时合并外科Maze术后出现的持续性房性心律失常,其致心律失常机制复杂,相对于传统三维标测系统,运用超高密度标测(Rhythmia系统)所提供的超高密度激动标测图和高分辨率、高清晰的心内电图可快速准确的标测关键峡部和局部最早区域,实现易标测易消融,可以进一步提高此类心律失常的成功率。
