利用GST pull-down 联合质谱技术鉴定H7N9 禽流感病毒PA-X 的互作蛋白
2022-03-03徐国双姜童潇郭艺迪张茂林关振宏
徐国双,姜童潇,郭艺迪,段 铭,张茂林,关振宏
(吉林大学人兽共患病研究所/人兽共患病教育部重点实验室,吉林 长春 130062)
【研究意义】禽流感病毒(Avian Influenza Virus,AIV)可引发家禽及野生禽类出现高度接触性传染病,高致病性AIV 亚型病毒的致死率接近100%。AIV 通过在宿主中频繁变异和基因重组而不断跨越种属屏障,在人及其他哺乳动物之间造成感染和传播,H5N1 和H7N9 亚型是其最典型的毒株[1-2]。自2013 年H7N9 亚型AIV 首次在我国出现后,人感染此亚型AIV 的病例持续增多,死亡率接近40%,已对人类健康造成严重威胁[3-6]。研究H7N9 亚型AIV 的致病机制是其防控的迫切需要,而病毒蛋白质与宿主细胞蛋白质相互关系的阐明有利于揭示病毒生命活动的分子机制,对流感治疗和抗病毒新药开发也具有一定指导意义。
【前人研究进展】PA-X 蛋白是流感病毒PA基因通过核糖体移码来识别X-ORF 而产生的一种融合蛋白[7]。PA-X 蛋白已被证实在病毒感染过程中具有多种重要功能,包括宿主细胞关闭[8]、参与病毒复制[9-10]、调控宿主天然免疫和获得性免疫反应[11-12]、调节病毒毒力和聚合酶活性[13-14]等。Jagger 等[7]证实PA-X 蛋白可以减弱1918年大流行的H1N1 亚型AIV 对小鼠的致病性,并能显著抑制与炎症及细胞凋亡相关的细胞免疫应答。研究发现,H5N1 亚型AIV 的PA-X 蛋白作为病毒毒力的负调控因子,可以通过抑制病毒复制和钝化宿主的整体免疫反应而使病毒的毒力降低[15]。也有研究证实PA-X 蛋白能够降低2009年大流行的H1N1 亚型AIV 和H5N1 亚型AIV 在小鼠中的毒力和宿主炎症反应[16]。许多证据表明PA-X 蛋白的功能具有毒株、亚型或宿主特异性,其潜在的作用机制仍未被阐明。
【本研究切入点】AIV 感染过程中,PA-X蛋白可能通过与宿主细胞多种蛋白发生互作,进而影响宿主细胞的诸多生理过程。但目前对于PA-X 与宿主蛋白的互作及作用机制研究仍比较匮乏。为了更深入地解析H7N9 亚型AIV 的PA-X 蛋白影响其致病性的分子机制,本研究采用GST 融合蛋白沉降技术(GST pull-down)在哺乳动物细胞中筛选与之相互作用的宿主细胞蛋白。【拟解决的关键问题】本研究在原核表达系统中表达纯化可溶性GST-PA-X 融合蛋白,通过GST pull-down 技术将A549 细胞中能与PA-X 蛋白特异相互作用的宿主蛋白捕获,并进行质谱鉴定及生物信息学分析,为进一步研究PA-X 蛋白的作用机制和H7N9 亚型AIV 的分子致病机制及预防控制提供重要线索。
1 材料与方法
1.1 试验材料
质粒pGEX-4T-1、pcDNA3-HA-Hsp70-2、pCAGGS-FLAG-PA-X 及PA-X T 载体和A549 细胞均由吉林大学人兽共患病研究所病毒病研究室保存。大肠杆菌菌株DH5α 和BL21(DE3)感受态细胞购自北京全式金生物技术有限公司。Glutathione Sepharose 4B beads 购自美国General Electric(GE)公司;异丙基硫代半乳糖苷(IPTG)、聚偏二氟乙烯膜(PVDF 膜)、蛋白分子量标准、荧光素标记的羊抗鼠IgG 及羊抗兔IgG 购自美国赛默飞世尔科技公司;Anti-HA Antibody 和Anti-FLAG Antibody 购自美国Cell Signaling Technology(CST)公司;其他化学试剂均为国产分析纯。
1.2 试验方法
1.2.1 PA-X原核表达载体的构建 根据GenBank公布的H7N9亚型AIV的PA-X(KF420307.1)序列,设计引物扩增PA-X的X-ORF结构域(C末端191~252 aa),上游引物F:5'-CGGGATCCATGG AAGACTTTGTGCGACA-3',下游引物R:5'-CG GAATTCTCACTTCTTTTGACATCTGAG-3',引物由长春库美生物公司合成。以pMD-18T-PA-X野生型载体为模板进行扩增,将扩增片段连接至BamH Ⅰ/EcoR Ⅰ双酶切后的pGEX-4T-1载体上。连接后转化DH5α感受态细胞,挑取平板上单克隆菌培养并提取质粒。随后进行PCR鉴定及双酶切鉴定,对阳性质粒进行测序验证,测序正确的重组表达载体命名为pGEX-4T-PA-X。
1.2.2 融合蛋白的诱导表达及纯化 将构建的pGEX-4T-PA-X 原核表达载体转化BL21 感受态细胞,进行GST-PA-X 融合蛋白的诱导表达。利用0.2 mmol/L IPTG 诱导剂于16 ℃下对融合蛋白进行诱导表达,收集菌体对其进行超声裂解并收集上清,利用SDS-PAGE 分离蛋白后,通过考马斯亮蓝染色法检测GST-PA-X 融合蛋白的表达。
1.2.3 GST pull-down 筛选与PA-X 互作的蛋白采用RIPA 裂解液裂解A549 细胞,离心收集上清液。将A549 全蛋白裂解物500 μL 分别加入到GST 蛋白及GST-PA-X 蛋白吸附柱中,4 ℃震荡孵育3 h。两组蛋白沉淀物用裂解液洗涤4 次以洗掉非特异性结合蛋白,加入SDS 上样缓冲液煮沸后,进行SDS-PAGE 分析及考马斯亮蓝染色。将两组蛋白泳道中GST 蛋白富集处的条带切下,其余部分蛋白胶进行后续的质谱分析。
1.2.4 质谱鉴定与PA-X 互作的蛋白 将GST pull-down 试验获得的蛋白胶送至北京华大蛋白质研发中心有限公司,以液相色谱-质谱-质谱(LC-MS/MS)联用方法进行质谱分析,采用Mascot 软件[17]鉴定蛋白质。
1.2.5 PA-X 互作蛋白的生物信息学分析 整理质谱鉴定结果,去掉GST 空载体组所有的非特异性蛋白,筛选出与H7N9 亚型AIV PA-X 互作的特异性宿主蛋白,利用PANTHER、DAVID 等在线数据库进行GO 功能富集和KEGG 通路分析,包括蛋白质分类(Protein Class,PC)、生物学过程(Biological Process,BP)和分子功能(Molecular Function,MF)分析。
1.2.6 免疫荧光技术验证Hsp70-2 与PA-X 的相互作用 将A549 细胞接种于铺有细胞爬片的12 孔培养板,长成单层后用脂质体转染试剂Lipofectamine LTX 共转染pcDNA3-HA-Hsp70-2和pCAGGS-FLAG-PA-X 质粒,24 h后细胞用4%多聚甲醛固定20 min,再用2% Triton X-100 透化处理10 min;随后加入一抗FLAG 和HA,4 ℃下结合过夜;加入二抗Alexa 488 标记的山羊抗鼠和Alexa 594 标记的山羊抗兔IgG,室温下结合1 h;最后用Hochest 染细胞核5 min,置荧光显微镜下观察蛋白共定位情况。
2 结果与分析
2.1 PA-X 原核表达载体的构建
为了在大肠杆菌中表达纯化PA-X 蛋白,将PA-X 特有的X-ORF 结构域基因构建到pGEX-4T-1 原核表达载体上,对pGEX-4T-PA-X 重组表达载体进行PCR 鉴定和双酶切鉴定,对阳性质粒进行测序分析。从鉴定结果(图1)可见,得到与预期大小一致的目的条带,表明成功构建PA-X 原核表达载体。

图1 重组质粒pGEX-4T-PA-X 的PCR 鉴定(A)及酶切鉴定(B)结果Fig.1 Results of PCR identification(A)and enzyme digestion of pGEX-4T-PA-X recombinant plasmid(B)
2.2 GST pull-down 筛选与PA-X 互作的蛋白
从A549 细胞中提取总蛋白,考马斯亮蓝染色结果显示蛋白大小分布均匀(图2),可以进行GST pull-down 试验。对试验得到的蛋白沉淀复合物进行SDS-PAGE 电泳分析,与GST 阴性对照相比,PA-X 融合蛋白沉淀存在多条差异条带,该试验进行了2 次重复,蛋白条带型基本一致(图2)。

图2 GST pull-down 产物的SDS-PAGE 检测结果Fig.2 SDS-PAGE detection results of GST pull-down products
2.3 质谱鉴定与PA-X 互作的蛋白
将质谱鉴定出的肽段剔除空载体GST 对照中的非特异性蛋白,在UniProt 蛋白质信息数据库中进行检索,从而确定每组条带内含有的蛋白质种类。基于匹配肽段数≥2 的原则,筛选到39个可信度高的与PA-X 互作的蛋白(表1)。已有研究表明热休克蛋白Hsp70 可对多种病毒的复制发挥调控作用,因此本研究选取可信度最高的Hsp70 蛋白家族的Hsp70-2,对其与PA-X 的相互作用作进一步验证,以阐明Hsp70 调控病毒复制的机制。
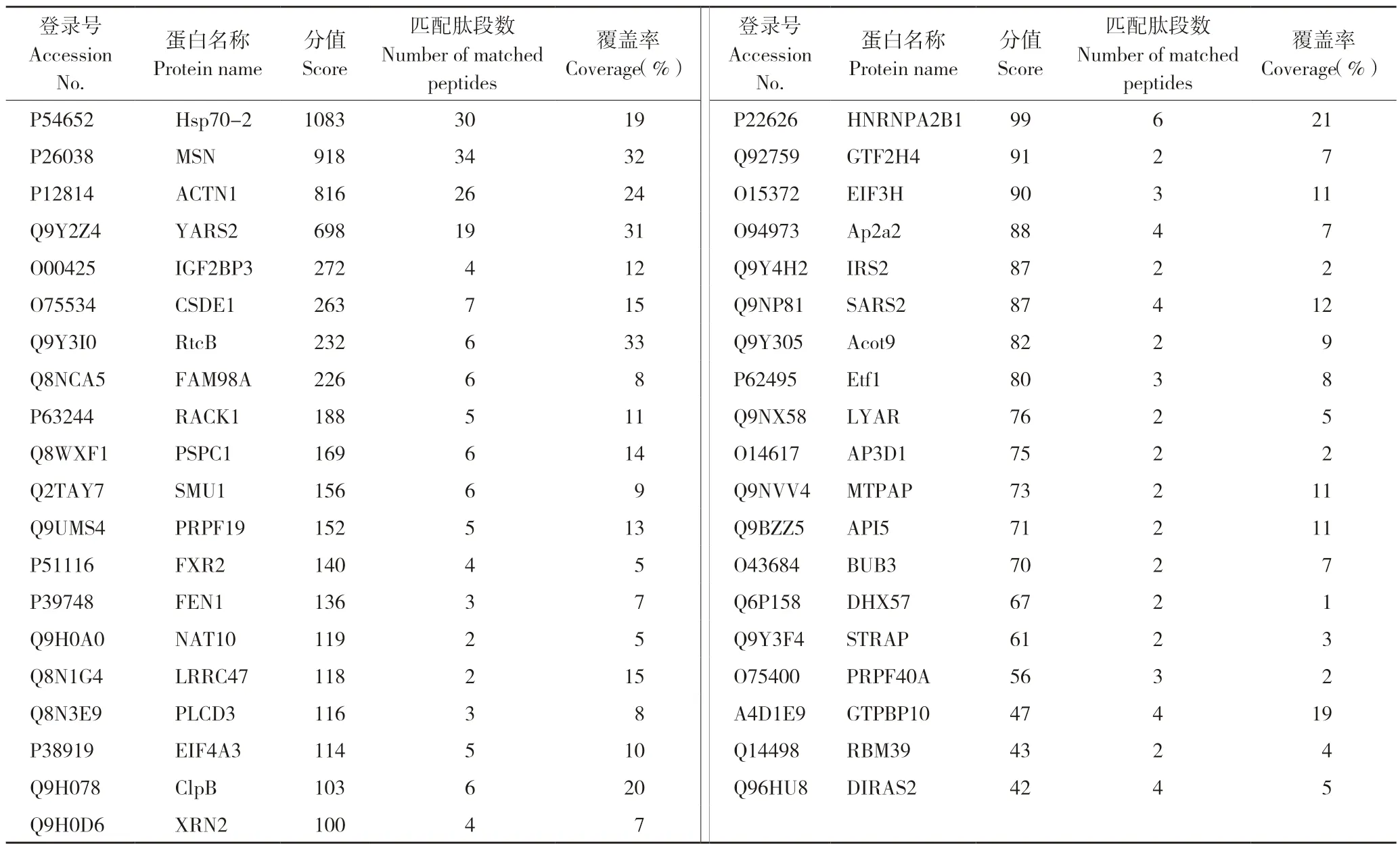
表1 与PA-X 互作的A549 细胞候选蛋白Table 1 Candidate proteins of A549 cell interacting with PA-X
2.4 PA-X 互作蛋白的生物信息学分析
2.4.1 GO 功能富集分析 采用PANTHER 在线数据库对PA-X 潜在的互作蛋白进行分类分析及功能注释。分析结果(图3)表明,39 种蛋白包括核酸代谢蛋白、翻译相关蛋白、代谢转换酶、蛋白修饰酶及骨架蛋白等,其中27.5%的蛋白属于核酸代谢蛋白类,17.5%的蛋白属于翻译过程相关蛋白类。此外,从分子功能角度来看,筛选到的这些蛋白主要发挥翻译调节活性、大分子结合活性、分子功能调节活性、催化活性等分子功能(图3)。
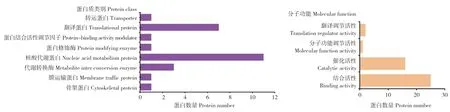
图3 潜在PA-X 相互作用蛋白的GO 富集分析Fig.3 GO enrichment analysis of potential PA-Xinteracting proteins
2.4.2 生物过程及信号通路富集分析 利用DAVID 在线分析软件进一步对鉴定的PA-X 潜在互作蛋白进行生物学过程分析,结果(图4)表明,这些蛋白主要参与mRNA、ncRNA 的分解代谢,RNA 加工、翻译,细胞周期调控、多肽生物合成和基因表达的转录后调控等生物过程。KEGG 通路分析结果表明,这些PA-X 互作蛋白主要参与剪接体、RNA 运输、核糖体生物合成、麻疹病毒感染等通路。
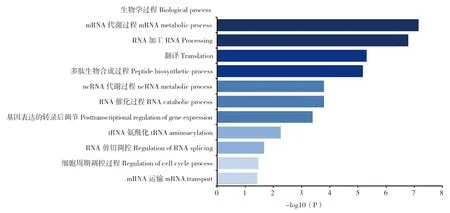
图4 潜在PA-X 相互作用蛋白的生物学过程分析Fig.4 Biological process enrichment analysis of potential PA-X interaction proteins
2.5 免疫荧光技术验证Hsp70-2 与PA-X 的相互作用
将质粒pcDNA3-HA-Hsp70-2 和pCAGGSFLAG-PA-X 共转染A549 细胞,荧光抗体染色后在荧光显微镜下观察蛋白共定位情况,结果(图5)显示,过表达的HA-Hsp70-2 主要集中在细胞浆,而FLAG-PA-X 在细胞浆和细胞核均有分布,这与已知文献报道相符[7]。两个蛋白的荧光图像重叠后呈现黄色荧光,说明二者可以共定位于细胞浆内,进一步证实了Hsp70-2 与PA-X 蛋白在哺乳动物细胞中互作的可能性。

图5 免疫荧光检测Hsp70-2 和PA-X 的相互作用Fig.5 Interaction of Hsp70-2 and PA-X by immunofluorescence examination
3 讨论
流感病毒PA-X 蛋白是甲型流感病毒基因组片段3 编码的非结构蛋白,被证实可以减弱1918 H1N1、2009 H1N1 和H5N1 等亚型流感病毒对小鼠的致病性,并能显著抑制宿主的先天性免疫应答。己有研究表明PA-X 在不同亚型流感病毒的致病性中发挥的作用不同。但目前国内外关于PA-X 蛋白对H7N9 亚型AIV 致病性影响的研究寥寥无几[18]。从整体上研究病毒蛋白与宿主细胞蛋白的相互作用及生物学功能,是揭示病毒蛋白功能及病毒致病机制的重要手段。目前对于流感病毒PA-X 与宿主蛋白的互作及作用机制仍不明确。Li 等[19]利用亲和纯化和质谱分析方法,在感染H5N1 亚型AIV 的鸡细胞中鉴定出56 种潜在与PA-X 互作的宿主蛋白。因此,筛选和鉴定出与H7N9 亚型AIV PA-X 蛋白互作的宿主因子对AIV 的致病机制研究具有重要价值。
本研究利用GST pull-down 和质谱技术相结合的方法,在哺乳动物细胞水平对与H7N9 亚型AIV PA-X 蛋白存在互作的宿主蛋白进行了鉴定及生物信息学分析。将质谱鉴定出的肽段在UniProt 蛋白质信息数据库中进行检索,并且按照匹配肽段数≥2 的原则,共筛选到39 个潜在的PA-X 互作蛋白质。对这些候选蛋白进行GO 富集分析,其分子功能主要是翻译调节活性、大分子结合活性、分子功能调节活性和催化活性等。大多数蛋白(55%)具有大分子结合活性,如mRNA 和各种蛋白质等。15 个蛋白(37.5%)具有催化活性,如聚合酶、核酸酶、连接酶、乙酰转移酶等。这些蛋白主要参与mRNA 及ncRNA 的代谢,RNA 加工、翻译,细胞周期调控,多肽生物合成和基因表达的转录后调控等生物过程。KEGG 通路分析结果表明,这些PA-X 的潜在互作蛋白中有4 个蛋白参与剪接体通路,4 个蛋白参与RNA 运输通路,2 个蛋白参与核糖体生物合成通路,4 个蛋白参与麻疹病毒感染等通路。这些候选互作蛋白的功能与PA-X的宿主细胞关闭和核酸内切酶活性相一致,提示PA-X 可能通过与多种宿主蛋白特异性互作而在病毒感染周期中执行其重要分子功能。
研究证实,一种通过RIG-I 样受体(RLR)信号途径而介导炎症反应的正调节宿主蛋白Ankrd17,能够直接与PA-X 相互作用[20]。而且PA-X 蛋白可以通过与Ankrd17 的互作而调控病毒感染后的天然免疫反应。本研究鉴定的PA-X候选互作蛋白中也包含Ankrd17(匹配肽段数=1),说明本研究方法有较好的可信度。
Hsp70蛋白家族是一类重要的分子伴侣蛋白,通过控制蛋白质构象而参与信号转导,发挥抗凋亡活性、血管生成、细胞器和分泌蛋白的跨膜转运等作用。Hsp70 蛋白家族至少包括14 个成员,进化上高度保守[21]。Hsp70 已被证实对多种病毒的复制发挥重要作用,包括A 型流感病毒、狂犬病毒、寨卡病毒、猪PRRSV 病毒、口蹄疫病毒和登革病毒等[22-27]。Hsp70 已经被证实可以通过阻止流感病毒RNP 复合体的核输出,或者阻断病毒聚合酶与病毒RNA 的结合而发挥抑制流感病毒复制的作用[28]。本研究对评分最高的宿主蛋白Hsp70-2 与PA-X 的相互作用作进一步验证,免疫荧光试验结果表明,Hsp70-2 与PA-X 可以在细胞浆中共定位,提示Hsp70-2 可能通过与病毒PA-X 蛋白相互作用而调控病毒复制。后续可对二者互作的生物学意义和分子机制作进一步研究。
4 结论
本研究利用GST pull-down 联合质谱技术的方法,在哺乳动物细胞A549 中筛选了与AIV PA-X 存在相互作用的宿主蛋白,质谱分析鉴定得到39 个高可信度的PA-X 候选互作蛋白。GO富集分析发现这些蛋白主要参与RNA 代谢、加工和转运等生物学过程,这与PA-X 的核酸内切酶活性密切相关,PA-X 蛋白很可能通过与这些宿主蛋白的相互关联而执行其宿主细胞关闭功能和抑制宿主的抗病毒反应功能。
