bFGF对3-硝基丙酸处理的小鼠受精卵体外发育能力的影响
2022-03-03方妍雅柳海星李钟淑
田 微,方妍雅,柳海星,李钟淑
(延边大学农学院,延吉 133000)
卵巢氧化应激通过影响卵母细胞发生、卵泡发育、卵泡成熟和卵泡破裂等影响卵母细胞质量及早期胚胎发育,最终导致雌性生殖机能下降[1]。卵巢中活性氧(ROS)的过量产生会引起氧化应激,从而影响卵母细胞质量和辅助生殖技术(ART)的结果。建立哺乳动物早期胚胎体外培养体系是人工辅助生殖技术的关键,如何获得大量且优质的胚胎是研究的热点问题。小鼠作为实验动物,在人工辅助生殖技术中发挥着重要作用。如何通过提高小鼠体外发育囊胚率而增加胚胎体外发育能力,是研究早期胚胎体外发育的重点。因此,建立相关氧化应激模型对开展该方面研究具有重要意义。
3-硝基丙基酸(3-nitroponic acid,3-NPA)能诱导线粒体产生和释放ROS,从而致使线粒体DNA发生损坏,进而线粒体功能会受到很大的影响[2]。细胞内三磷酸腺苷(adenosinetriphosphate,ATP)的产生主要发生在线粒体,线粒体的形态和位置发生改变出现在胚胎早期发育时期,线粒体氧化磷酸化能力被异常的线粒体分布所影响,线粒体内发生一系列异常变化而影响早期胚胎的发育。3-NPA是一种在动物生产中较为常见的对动物体有毒性的化合物,可诱导氧化应激从而降低生产力。研究表明,利用3-NPA构建小鼠氧化应激模型,具有时间短(7 d)、操作简单、效果显著等优点。张家庆[3]、王慧瑞等[4]研究结果表明,连续7 d、每天2次给小鼠注射12.5 mg/kg 3-NPA可使小鼠卵巢达到氧化应激状态,从而产生氧化应激的早期胚胎,在早期胚胎体外培养液中加入抗氧化剂可以调节线粒体损伤引起的氧化应激。说明在胚胎体外培养液中加入抗氧化剂是抵抗氧化剂引起的氧化应激最直接有效的方法之一。
碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是一种在细胞体外培养增殖、诱导分化以及体外组织再生领域均有较大应用潜力的生长因子之一[5]。研究表明,bFGF可通过提高超氧化物歧化酶的活性,增强对ROS的清除能力,在胚胎及细胞中发挥重要的作用[6]。据相关文献显示,bFGF具有一定的对抗氧化应激的作用[7],但bFGF在动物生殖系统特别是在卵母细胞和早期胚胎体外发育中的具体作用仍不清楚。本试验拟通过在体外培养液中添加bFGF,探讨bFGF对3-NPA处理的小鼠受精卵体外发育的影响,以期为提高氧化应激早期胚胎体外发育质量提供参考依据。
1 材料与方法
1.1 材料
1.1.1 试验动物 本试验中使用的繁殖雄鼠:7~8周龄、健康(单笼饲养,种用寿命为半年)、体重25 g以上;雌鼠:6~8周龄、体重25 g以上;均达到性成熟,均购自延边大学动物实验中心。在室内光暗周期为12 h∶12 h、温度为22~23 ℃的环境中饲养,保持良好通风。
1.1.2 主要试剂及仪器 CZB-HEPES、透明质酸酶(Hy)、磷酸盐缓冲溶液(PBS)均购自Sigma公司;JC-1、ROS(DCFH-DA)和谷胱甘肽(GSH)(CMF2HC)均购自Thermo Fisher Scientific公司;孕马血清促性腺激素(PMSG)、人绒毛膜促性腺激素(hCG)均购自宁波第二激素厂;bFGF购自Sino Biological公司;KSOM培养液购自南京爱贝生物公司。体视显微镜(TMS)和荧光显微镜(Lecia DM IRB)均购自Nikon公司;CO2培养箱(TH3111)购自ESCO公司。
1.2 方法
1.2.1 受精卵的采集 采用PMSG-hCG法对挑选的6~8周龄雌鼠进行超数排卵,即于第1天注射0.1 mL(10 IU) PMSG促进小鼠卵母细胞成熟,48 h后注射0.1 mL(10 IU) hCG诱导小鼠排卵,注射hCG后立即与成年公鼠1∶1合笼,在合笼20 h后采用颈部脱臼处死小鼠,无菌手术摘取输卵管,放入已经预平衡的CZB-HEPES中,体视显微镜下划破输卵管膨大部,收集受精卵。将受精卵移入0.1%透明质酸酶中消化2 min,吹打以去除卵丘细胞,将受精卵在CZB-HEPES中洗3次,收集含有双原核的受精卵。
1.2.2 最佳bFGF浓度筛选 将双原核受精卵放入已经预平衡的KSOM培养液中。 KSOM中分别添加0、20、50、100和150 ng/mL bFGF,于37.5 ℃、5% CO2培养箱中培养,分别于培养的24、48和96 h观察胚胎发育情况,并统计2-细胞率、4-细胞率和囊胚率,筛选出最佳bFGF处理浓度,以用于后续试验。
1.2.3 3-NPA氧化应激处理及受精卵的分组 小鼠适应饲养1周后,经腹腔注射12.5 mg/kg 3-NPA,2次/d,注射7 d,构建小鼠卵巢氧化应激模型[3]。3-NPA注射7 d后按照1.2.1的方法进行超数排卵、合笼及受精卵收集。将受精卵分为对照组(C)、bFGF组、3-NPA组和3-NPA+bFGF组,其中对照组和bFGF组为正常组小鼠的受精卵,3-NPA组和3-NPA+bFGF组为体内注射3-NPA小鼠的受精卵。 在体外培养时,bFGF组和3-NPA+bFGF组KSOM培养液中添加100 ng/mL bFGF,对照组和3-NPA组KSOM培养液中不添加bFGF,胚胎分别用相应培养液清洗3次后移入各组培养液微滴中,于37.5 ℃、5% CO2培养箱中培养96 h,得到的囊胚用于ROS、GSH和线粒体膜电位检测。
1.2.4 ROS水平的检测 将1.2.3获得的囊胚在PVA中洗3次,然后转移到DCFH-DA微滴中。 放入CO2恒温培养箱中孵育15 min,再用PVA洗3次,在荧光显微镜绿色荧光下拍照。操作全过程应避光进行。用ImageJ 1.48软件进行量化分析,每组试验重复5次。
1.2.5 GSH水平的检测 将1.2.3获得的囊胚在PVA中洗3次,然后转移到CMF2HC微滴中。 放入CO2恒温培养箱中孵育20 min,再用PVA洗3次,在荧光显微镜蓝色荧光下拍照。 操作全过程应避光进行。用ImageJ 1.48软件进行量化分析,每组试验重复5次。
1.2.6 线粒体膜电位的检测 将1.2.3获得的囊胚在PVA中洗3次,然后转移到JC-1的微滴中。放入CO2恒温培养箱中孵育25 min,再用PVA洗涤3次,在荧光显微镜红色、绿色荧光下拍照,通过红/绿荧光强度的比例来衡量线粒体膜电位强度。操作全过程应避光进行,用ImageJ 1.48软件进行量化分析处理,每组试验重复5次。
1.3 统计分析
用SPSS 16.0进行单因素方差分析,用LSD检验进行组间多重比较,结果用平均值±标准差表示。P<0.05表示差异显著。
2 结 果
2.1 最佳bFGF浓度筛选
由表1可知,各组2-细胞率无显著差异(P>0.05),150 ng/mL bFGF组4-细胞率和囊胚率均显著低于其他组(P<0.05),100 ng/mL bFGF组囊胚率显著高于其他组(P<0.05)。因此,小鼠胚胎的最适bFGF处理浓度为100 ng/mL。
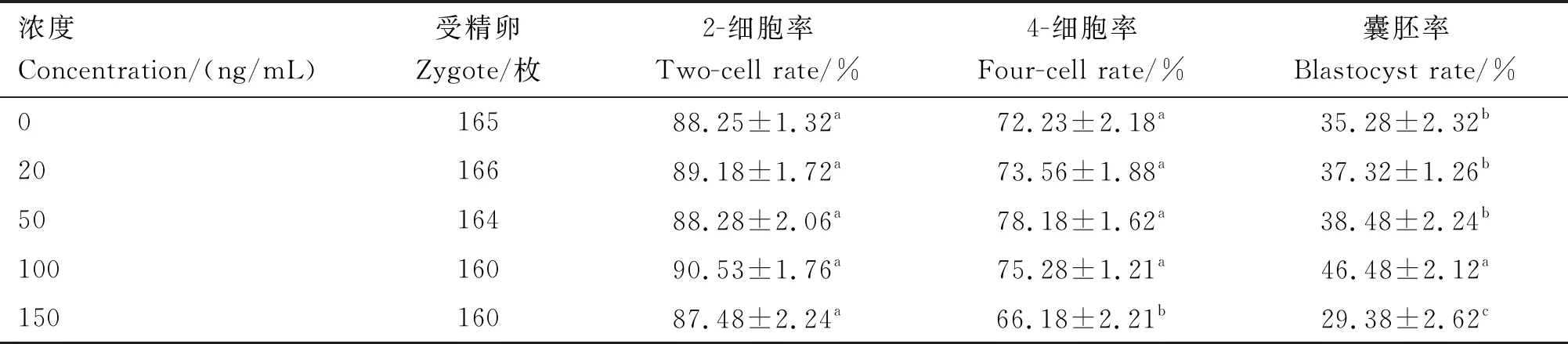
表1 各组小鼠早期胚胎体外培养的发育率
2.2 bFGF对3-NPA处理的小鼠受精卵体外发育的影响
由表2可知,各组间2-细胞率差异均不显著(P>0.05),3-NPA组4-细胞率显著低于其他组(P<0.05),bFGF组囊胚率显著高于其他组(P<0.05),3-NPA+bFGF组与对照组4-细胞率和囊胚率差异均不显著(P>0.05),且均显著高于3-NPA处理组(P<0.05)。
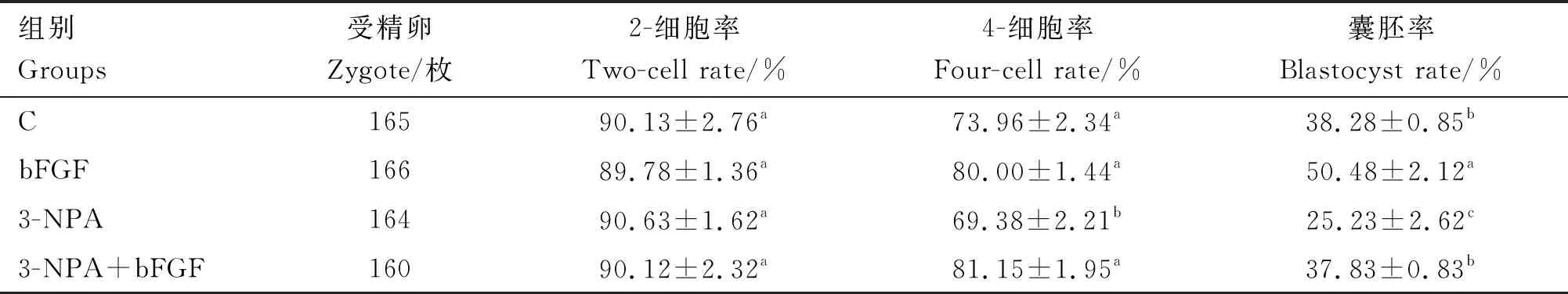
表2 bFGF对3-NPA处理的小鼠受精卵体外发育的影响
2.3 bFGF对3-NPA处理的小鼠囊胚ROS水平的影响
由图1可知,与对照组相比,3-NPA组ROS水平显著升高(P<0.05)。3-NPA+bFGF组与对照组差异不显著(P>0.05),并均显著低于3-NPA组(P<0.05)。
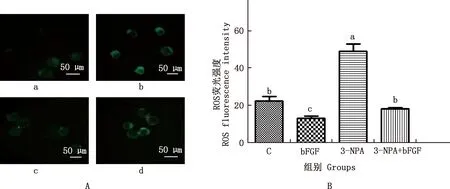
①A,DCHFDA染色结果(100×);B,量化结果。②a~d,分别代表C、bFGF、3-NPA和3-NPA+bFGF组。图2同
2.4 bFGF对3-NPA处理的小鼠囊胚GSH水平的影响
由图2可知,与对照组相比,3-NPA处理组的GSH水平显著降低(P<0.05),bFGF组GSH水平显著高于其他各组(P<0.05);3-NPA+bFGF处理组与对照组差异不显著(P>0.05),且显著高于3-NPA组(P<0.05)。
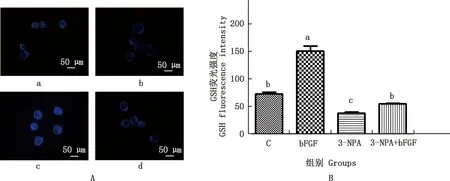
A,DCHFDA染色结果(100×);B,量化结果
2.5 bFGF添加对3-NPA处理的小鼠囊胚中线粒体膜电位水平的影响
由图3可知,与对照组相比,3-NPA组线粒体膜电位水平显著降低(P<0.05),bFGF组线粒体膜电位显著增加(P<0.05)。3-NPA+bFGF组与对照组线粒体膜电位差异不显著(P>0.05),并均显著高于3-NPA组(P<0.05)。
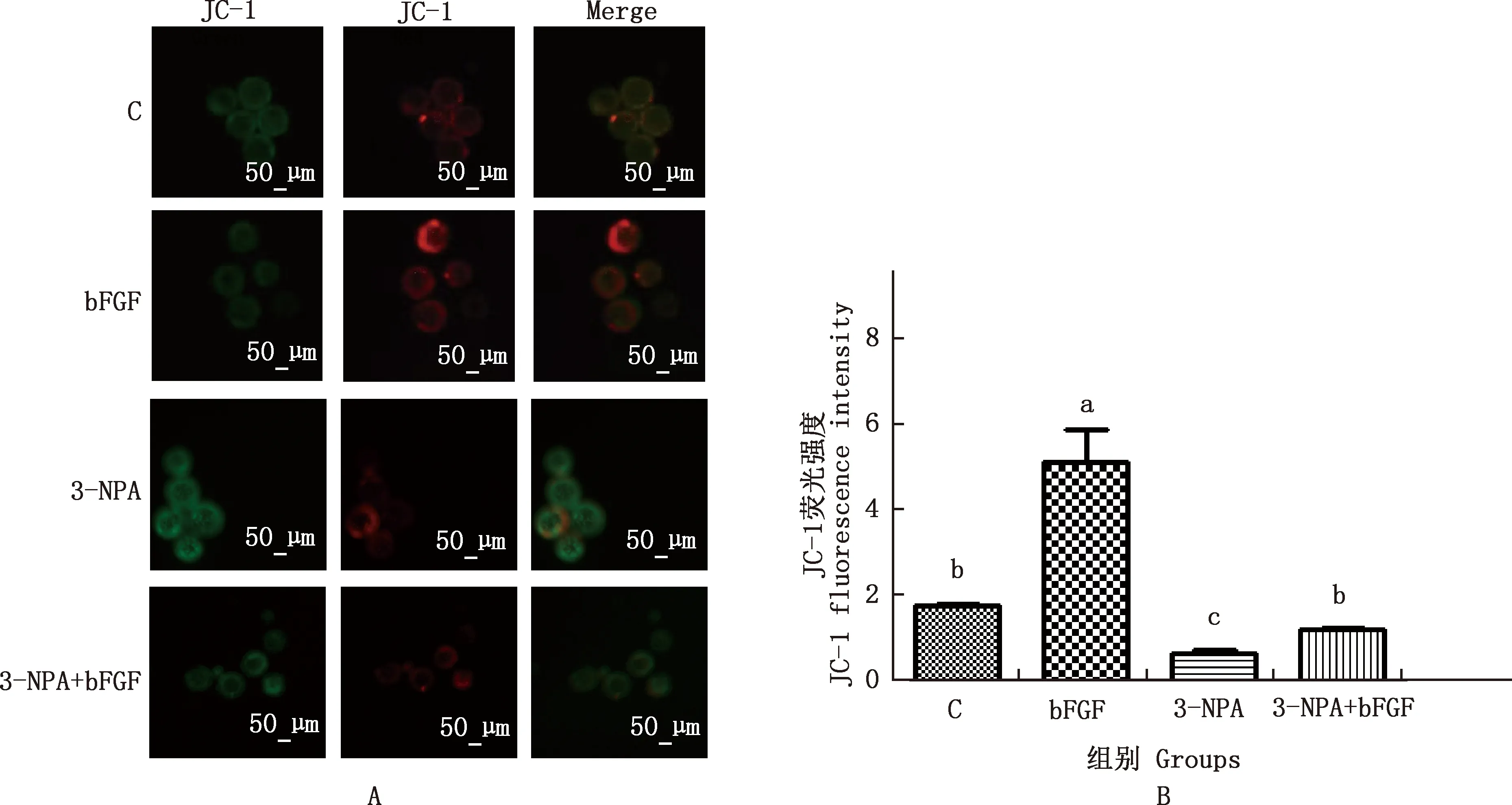
A,JC-1染色结果(100×);B,量化结果
3 讨 论
为了探究bFGF对3-NPA处理的小鼠受精卵体外发育能力的影响,本试验检测了不同浓度bFGF(0、20、50、100和150 ng/mL)对小鼠受精卵分裂率和囊胚率的影响。试验结果表明,在3-NPA处理的小鼠受精卵体外培养液中添加100 ng/mL bFGF可以显著提高囊胚率。研究表明,ROS和抗氧化物存在于卵泡液和输卵管中,在母鼠妊娠时期,氧化应激可直接调控发育相关基因的表达或通过间接氧化损伤细胞中的脂类和蛋白等成份,从而对胚胎发育和受孕造成严重危害[8-9]。本研究在培养液中添加bFGF可以降低胚胎发育过程中ROS的产生,从而提高小鼠受精卵的体外发育能力,这与毛挺挺等[10]研究结果一致。
已有研究表明,氧化剂3-NPA能特异地提高卵母细胞和颗粒细胞中ROS的水平,从而引起颗粒细胞凋亡与卵泡闭锁[11]。有研究报道,在卵母细胞和胚胎中产生过量的ROS会导致其发生氧化应激,卵母细胞和早期胚胎发育能力也会降低,在壁颗粒细胞和卵丘颗粒细胞中产生过量的ROS也会降低受精率和胚胎质量。此外,ROS还参与早期胚胎发育阻滞,如小鼠2-细胞胚胎发育阻滞与ROS的升高密切相关[12]。bFGF作为抗氧化修复剂能够促进多种神经细胞的增殖和分化[13]。本试验结果表明,与3-NPA组相比,bFGF+3-NPA组显著降低3-NPA处理小鼠囊胚ROS水平,说明bFGF能够克服3-NPA诱导小鼠早期胚胎氧化应激并增强了胚胎的体外发育能力。GSH带有的巯基(-SH)通过抗氧化作用能够清除内源和外源性有害物质对细胞的损伤[14]。同时,它在新陈代谢和调节全身稳态所必需的途径方面也具有至关重要的作用[15]。在体外培养过程中,胚胎内的GSH水平与细胞增殖、胚胎成熟发育等过程相关[16]。本研究结果表明,与3-NPA组相比,bFGF+3-NPA组显著提高了3-NPA处理小鼠囊胚的GSH水平,说明bFGF减轻了3-NPA处理小鼠胚胎的氧化应激并提高了胚胎的抗氧化能力。将不同试验组GSH与ROS水平比较发现,其处于一个动态平衡的过程,即胚胎内GSH水平高时其ROS水平较低。对排卵前卵泡的研究表明,FSH可以抑制培养48 h卵泡中GSH水平的下降,FSH诱导的GSH增加与谷氨酸半胱氨酸连接酶(GCLM)蛋白水平的增加和ROS产生的抑制有关[17]。本试验结果说明,在体外培养液中添加100 ng/mL bFGF可以有效提高3-NPA处理的小鼠囊胚GSH水平,进一步证实bFGF可以通过维持胚胎内GSH水平对抗氧化损伤,从而提高小鼠早期胚胎体外发育的能力。
3-NPA能够抑制细胞线粒体功能,从而导致细胞缺乏ATP[18],还可诱导线粒体产生和释放ROS,从而发生氧化应激[19]。线粒体通过氧化磷酸化产生供细胞周期分裂和代谢等生命活动所需的能量,参与ROS引起的细胞凋亡过程,调节细胞氧化应激,是消耗细胞内氧化物的主要场所,影响细胞的新陈代谢和生长,在胚胎发育的各个时期均起重要作用。早期胚胎发育的阻滞与早期细胞部分凋亡的现象均与线粒体功能障碍有关,发育的阻滞与早期凋亡会导致早期胚胎发育能力的降低[20]。胚胎内线粒体膜电位水平与胚胎的发育能力成正相关,即膜电位水平增高则胚胎的发育能力增强。本试验结果表明,100 ng/mL bFGF显著提高了3-NPA处理小鼠囊胚期胚胎的线粒体膜电位水平。说明在体外培养液中添加100 ng/mL bFGF可以有效维持3-NPA处理小鼠囊胚的线粒体膜电位稳定。
4 结 论
本研究结果表明,在小鼠受精卵体外培养液中添加100 ng/mL bFGF可以提高3-NPA诱导的小鼠受精卵的4-细胞率及囊胚率,显著提高囊胚的GSH和线粒体膜电位水平,降低ROS水平,从而提高氧化应激早期胚胎体外发育的能力。
