基于指纹图谱结合化学模式识别绿萼梅质量标志物的评价研究
2022-03-03赵宏苏乔金为金传山王灿灿吴德玲
赵宏苏,赵 茹,乔金为,金传山,王灿灿,张 伟,吴德玲
基于指纹图谱结合化学模式识别绿萼梅质量标志物的评价研究
赵宏苏1, 2, 3,赵 茹1#,乔金为4,金传山1, 2, 3,王灿灿1,张 伟1, 2, 3*,吴德玲1, 2, 3*
1.安徽中医药大学药学院,安徽 合肥 230012 2.新安医学教育部重点实验室,安徽 合肥 230012 3.中药饮片制造新技术安徽省重点实验室,安徽 合肥 230012 4.安徽中医药大学第二附属医院,安徽 合肥 230061
利用化学模式识别技术对绿萼梅药材指纹图谱数据进行分析,筛选特征性指标成分从而建立绿萼梅Q-Marker的定量分析策略,为绿萼梅质量评价提供科学依据。采用超高液相色谱法建立3个产地绿萼梅的指纹图谱,运用相似度分析、聚类分析、主成分分析和偏最小二乘判别分析等化学模式识别技术筛选出不同产地绿萼梅化学成分的特征成分作为绿萼梅Q-Marker,并定量分析。30批绿萼梅UPLC指纹图谱标定8个共有峰,相似度在0.816~0.969;通过聚类分析、主成分分析和偏最小二乘判别分析较好的区分各产地绿萼梅,综合分析筛选绿原酸、芦丁、金丝桃苷、异槲皮苷作为绿萼梅Q-Marker,质量分数分别在3.08%~4.71%、0.41%~0.71%、0.13%~0.25%、0.25%~0.38%。通过指纹图谱结合化学模式识别技术的分析策略可快速有效的筛选绿萼梅Q-Marker,为绿萼梅质量评价提供参考。
绿萼梅;质量标志物;定量指纹图谱;化学模式识别技术;绿原酸;芦丁;金丝桃苷;异槲皮苷
梅花为蔷薇科植物梅(Sieb.) Sieb.et Zucc.的干燥花蕾。《中国药典》2020年版收录药用梅花分别有红梅花和白梅花[1],其中花萼灰绿色花瓣为黄白色者为白梅花,又称绿萼梅,主产于安徽各地,为新安著名医家常用中药,收录于《全国中草药汇编》《中药大辞典》,为临床入药主要品种,具有疏肝和中、化痰散结之功效,主要用于唇上生疮、月经不调、肝胃气痛、郁闷心烦等症状[2-4]。近年来国内外学者对绿萼梅化学成分研究表明其化学成分包括挥发油类、黄酮类、酚苷类、酯苷类、苯丙素类,其中以绿原酸为代表的苯丙素类和以金丝桃苷为代表的黄酮类成分含量较高[5-6]。有关绿萼梅质量评价研究,目前文献报道较多的是多成分的含量测定,而筛选的定量指标成分依据并未说明[7-10]。因此如何获得区分不同产地绿萼梅质量差异、反映药材品质的质量标志物作为绿萼梅多指标成分含量的质量评价方法显得尤为重要[11-12]。本实验以绿萼梅为研究对象,通过UPLC指纹图谱对绿萼梅主要化学成分进行宏观整体表征,采用化学模式识别技术对指纹图谱中提取共有峰的面积进行整合分析,从而得到影响不同产地质量的特征化学成分并含量测定,从而建立绿萼梅质量标志物(Q-Marker)以期为绿萼梅的质量标准研究和资源开发利用提供参考。
1 材料
1.1 仪器
ACQUITY H-CLASS UPLC(美国Waters公司,真空脱气机、包括四元高压梯度泵、柱温箱、自动进样器、二极管阵列检测器、Empower2 色谱工作站);Milli-Q Advantage A10一体式超纯水机(美国Milipore公司);WL-100型打粉机(瑞安市威力制药机械厂);AB135-S型十万分之一天平(梅特勒-托利多有限公司);KQ-400KED型高功率数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试剂
对照品绿原酸(批号CFN99116)、芦丁(批号CFN99642)、异槲皮苷(批号CFN9875)均购自武汉天植生物技术有限公司;金丝桃苷(批号为MUST-20052210)购自成都曼思特生物科技有限公司,质量分数均≥98%。分析纯甲醇购自上海苏懿化学试剂有限公司,色谱纯甲醇、色谱纯乙腈均购自德国Merk公司,甲酸(色谱纯,美国Sigma公司),水为超纯水。
1.3 药材
绿萼梅药材采自安徽休宁、安徽庐江和安徽歙县,共30批次。经安徽省食品药品检验研究院刘军玲中药师鉴定为蔷薇科植物梅(Sieb.) Sieb.et Zucc.的干燥花蕾。绿萼梅样品来源见表1。

表1 绿萼梅样品信息
2 方法与结果
2.1 色谱条件
Acquity UPLC BEH C18(100 mm×2.1 mm,1.7 μm)色谱柱,流动相0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),流动相梯度洗脱程序为0~5 min,90%~85% A;5~15 min,85%~80% A;15~20 min,80%~75% A;20~21 min,75%~20% A;21~25 min,20%~20% A;25~26 min,20%~10% A;26~32 min,10%~90% A。体积流量0.2 mL/min;柱温30 ℃;进样量2 μL;检测波长355 nm。
2.2 溶液的制备
2.2.1 供试品溶液制备 取绿萼梅样品粉末(过四号筛)0.5 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇50 mL,密塞,称定质量,超声处理(250 W,40 kHz)30 min,静置冷却,称定质量,加50%甲醇补足失重,混匀后过0.22 μm的微孔滤膜,得续滤液作为供试品溶液。
2.2.2 对照品溶液制备 分别取对照品绿原酸、芦丁、金丝桃苷、异槲皮苷适量,精密称定,置量瓶中,加入50%的甲醇制成含绿原酸71.2 μg/mL、芦丁42.4 μg/mL、金丝桃苷61.6 μg/mL、异槲皮苷67.0 μg/mL的混合对照品溶液。
2.3 方法学考察
2.3.1 精密度试验 取同一绿萼梅供试品(S1)溶液,连续进样6次,进样量2 μL,以绿原酸为参照峰S,计算其他各个特征峰的相对保留时间和相对峰面积的RSD,考察仪器的精密度,各特征峰相对保留时间的RSD值分别为0.14%、0.37%、0.38%、0.50%、0.43%、0.42%、0.45%,各色谱峰相对峰面积的RSD值分别为0.25%、1.29%、0.13%、0.99%、1.47%、0.65%、1.33%,均小于2.0%。
2.3.2 重复性试验 取同一绿萼梅供试品(S1),按“2.2.1”项下制备6份供试品溶液,按“2.1”项下色谱条件分别进样测定,进样量2 μL,以绿原酸为参照峰S,计算其他特征峰的相对保留时间和相对峰面积的RSD,考察方法的重复性。各特征峰相对保留时间的RSD值分别为0.18%、1.43%、0.64%、0.59%、0.69%、1.68%、0.89%,各色谱峰相对峰面积的RSD值分别为0.16%、1.57%、0.36%、1.04%、0.92%、1.36%、1.24%,均小于2.0%。
2.3.3 稳定性试验 取同一绿萼梅供试品(S1)溶液,分别于配制后0、2、4、8、12、24 h进样测定,进样量2 μL,以绿原酸为参照峰,计算其他特征峰的相对保留时间和相对峰面积的RSD,考察供试品溶液的稳定性,各特征峰相对保留时间的RSD值分别为0.17%、0.72%、0.97%、1.01%、1.02%、1.12%、1.25%,各色谱峰相对峰面积的RSD值分别为0.22%、0.27%、0.15%、0.62%、1.31%、0.57%、1.21%,均小于2.0%。
2.4 绿萼梅指纹图谱的建立
2.4.1 绿萼梅对照指纹图谱的生成 分别取30批绿萼梅样品约0.5 g,精密称定,按“2.2.1”项下方法制备供试品溶液,按“2.1”项下色谱条件进行分析,将所得的30批绿萼梅样品UPLC图谱以AIA格式按产地分别导入国家药典委员会“中药色谱指纹图谱相似度评价系统(2012.130723版)软件”,以S1为参照图谱,采用中位数法,时间窗的宽度默认为0.1 min,经过多点校正之后进行自动匹配,生成30批绿萼梅药材的UPLC指纹图谱和对照图谱(R),见图1、2。
2.4.2 特征峰的指认 30批绿萼梅药材指纹图谱的共有峰有8个,经与混合对照品色谱图镜像比对(图3),指认其中4个主要特征峰:2号峰为绿原酸,6号峰为芦丁,7号峰为金丝桃苷,8号峰为异槲皮苷。
2.4.3 相似度评价 采用国家药典委员会“中药色谱指纹图谱相似度评价系统(2012.130723版本)软件”对30批绿萼梅样品的指纹图谱进行相似度计算分析,绿萼梅样品中绿原酸的出峰时间比较稳定,且分离度较好,因此选择绿原酸峰作为参照峰(S),其保留时间和峰面积为1,计算30批绿萼梅样品的共有峰的相对保留时间和相对峰面积,各共有峰的相对保留时间RSD值均小于2.0%,相对峰面积的RSD值均小于45%,说明不同批次样品中各成分含量差异较大,相对峰面积结果见表2。30批绿萼梅样品色谱图与对照指纹图谱的相似度在0.816~0.969,主要相似度小于0.9的样品为S4、S6、S8、S16、S24,表明各个产地绿萼梅质量具有不稳定现象,这可能与绿萼梅半野生状态种植有关。相似度结果见表3。
2.5 化学模式识别分析
2.5.1 聚类分析 以30批不同产地绿萼梅药材UPLC指纹图谱的8个共有峰的峰面积为原始数据,生成30×8的阶数据矩阵,运用IBM SPSS Statistics 24.0软件进行系统聚类分析(hierarchical clustering analysis,HCA),采用组间连接的聚类方法,以平方欧式距离作为测度,结果见图4。当分类距离10时,显示30批样品共聚为3类,其中来自休宁产地的S2、S7、S10单独聚为一类,其余休宁产地和庐江地产的绿萼梅可大致聚为一类,歙县绿萼梅样品单独聚为一类,说明通过聚类分析可大致区分产地。
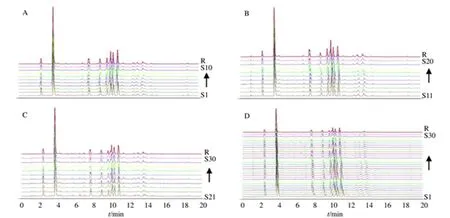
A-休宁绿萼梅指纹图谱 B-庐江绿萼梅指纹图谱 C-歙县绿萼梅指纹图谱 D-30批绿萼梅指纹图谱,下同
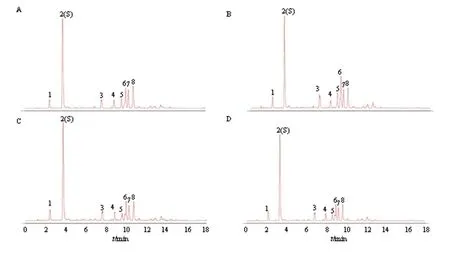
图2 绿萼梅UPLC对照图谱
2.5.2 主成分分析 为了更好地将各不同产地绿萼梅进行区分,另采用主成分分析(principal component analysis,PCA)方法进行进一步分析,PCA可实现高维数据的降维处理,少数几个主成分(综合变量)即可代原始数据的大部分信息。同样以30批不同产地绿萼梅药材UPLC指纹图谱的8个共有峰的峰面积为原始数据,生成30×8的阶数据矩阵,运用IBM SPSS Statistics 24.0软件进行标准化处理,通过降维因子分析,计算特征值和累计方差贡献率,结果显示KMO值为0.754,大于0.5,代表各变量相关性较好,提取到2个主要成分,特征值均大于1,累积方差贡献率为80.569%,能基本反映出样品的主要信息;以主成分因子变量绘制公因子碎石图,结果显示特征值较高的2个主成分因子的斜率更大,说明所提取的2个主成分可以最大程度地代表绿萼梅药材的整体质量特征。因此2个主成分因子可以作为绿萼梅药材的评价指标。将得到的成分矩阵进行正交旋转得到8个共有峰成分在2个主成分中的旋转矩阵,权重值越大表明该成分在决定样品区分中的作用越大。结果显示第1个主成分信息主要来自1号峰、2号峰(绿原酸)、7号峰(金丝桃苷)、8号峰(异槲皮苷),第2个主成分信息主要来自5号峰、6号峰(芦丁)。将绿萼梅样品的8个共有峰峰面积导入SIMCA 14.1软件绘制30批不同产地绿萼梅样品的主成分得分图,见图5,结果显示2个主成分能反映不同产地绿萼梅的主要特征,提示不同产地在化学成分含量上存在差异。2.5.3 偏最小二乘法-判别分析(partial least squares discriminant analysis,PLS-DA) 为了更好地观察不同产地样本间的组内差异,在PCA分析的基础上进一步采用SIMCA 14.1软件进行PLS-DA方法进一步分析。在建立的偏最小二乘判别分析模型中2X(cum)=8.847,2Y(cum)=0.737,2(cum)=0.721,均大于0.5,说明建立的PLS-DA模型解释率和预测力可靠、良好。PLS-DA得分图及3D图见图6、7。结果结果显示30批样品分为3组,3个产地各为一组,结合变量重要性投影值(variable importance in projection,VIP)(图8)可知VIP>1的色谱峰有1、5号峰(未知),说明1、5号峰代表的化学成分是不同产地绿萼梅样品的差异性标志物。

2-绿原酸 6-芦丁 7-金丝桃苷 8-异槲皮苷
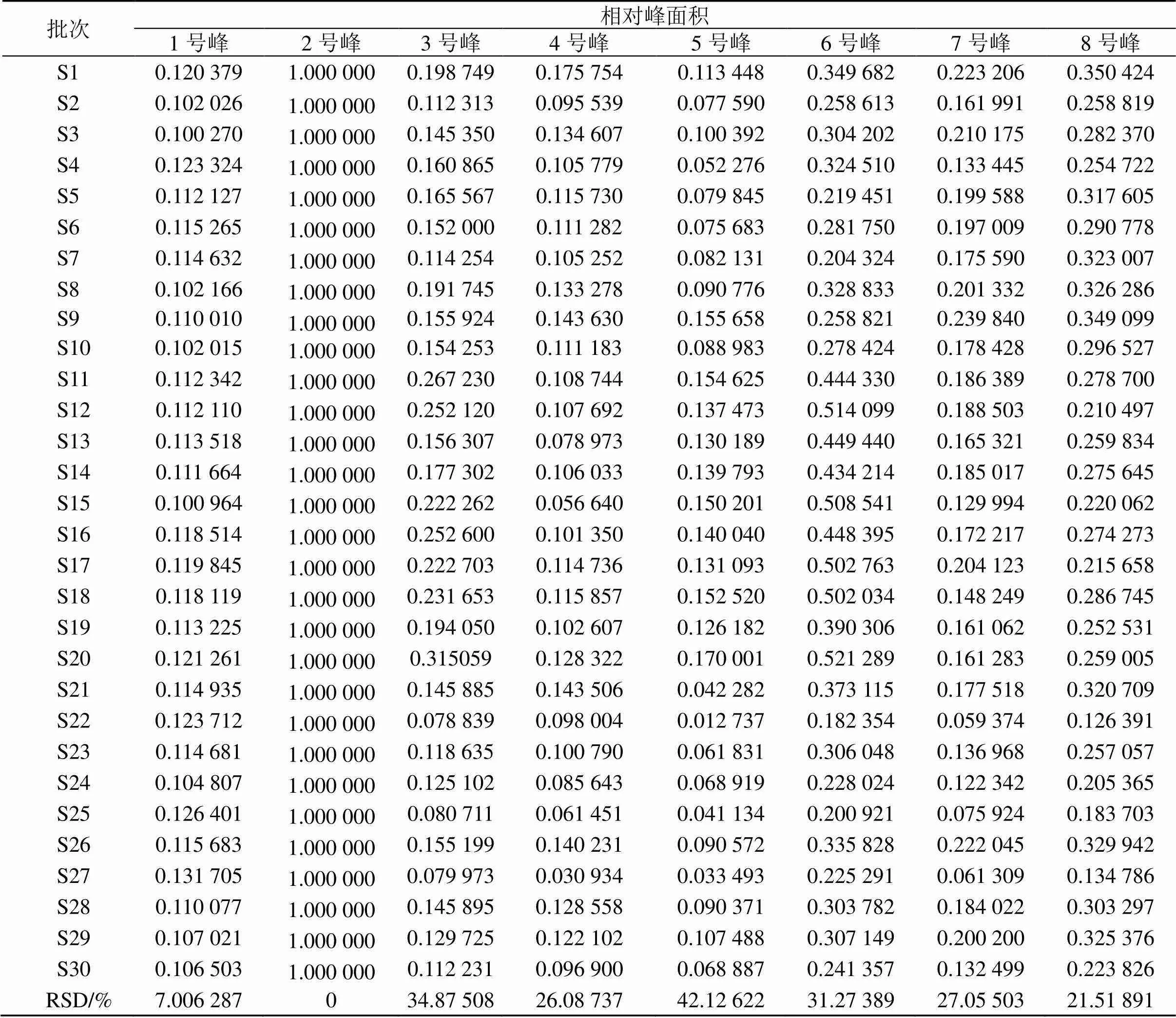
表2 绿萼梅样品指纹图谱共有峰的相对峰面积
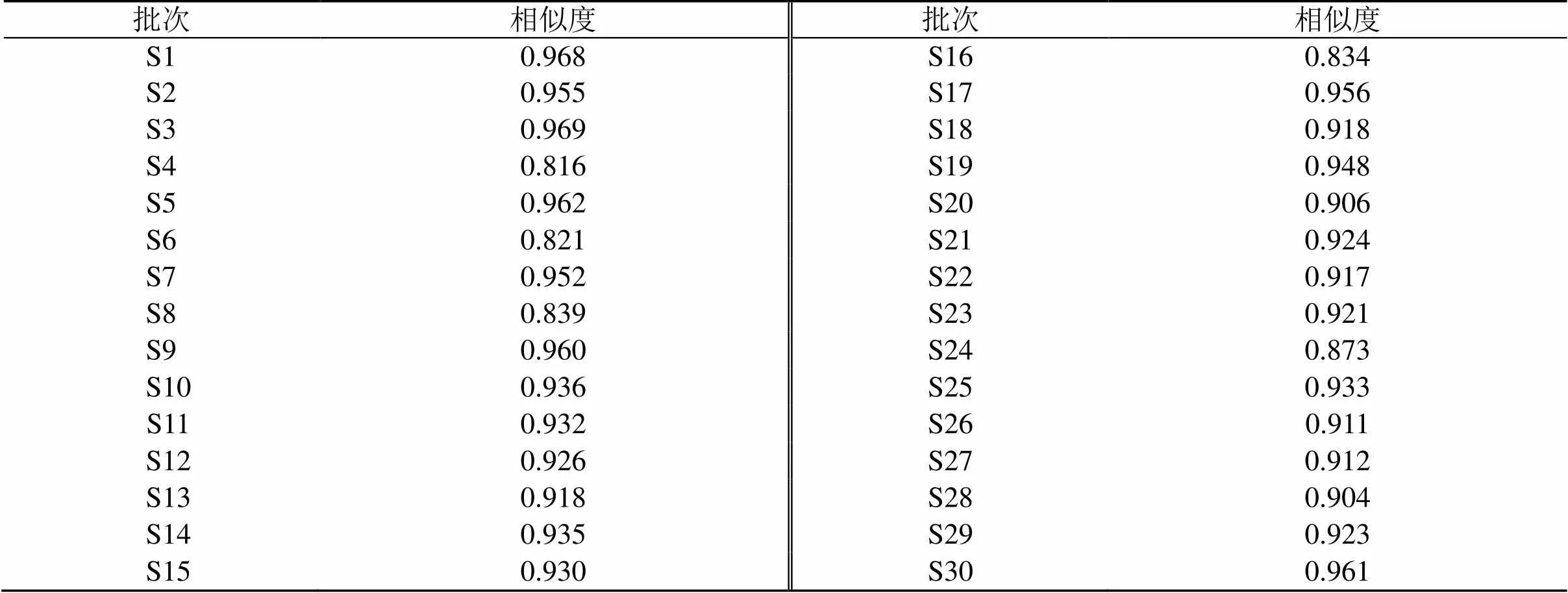
表3 30批绿萼梅指纹图谱相似度评价结果
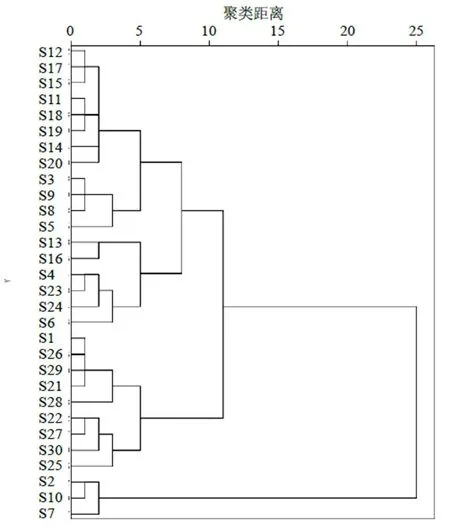
图4 绿萼梅样品聚类分析图
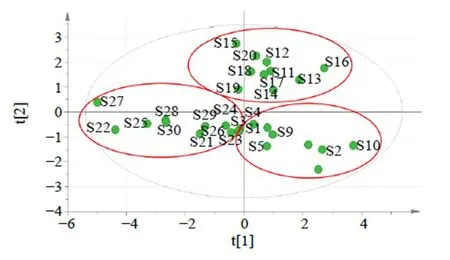
图5 绿萼梅PCA得分图
2.6 绿萼梅Q-Marker的含量测定
通过化学模式识别技术客观量化分析,由PCA 分析得知指纹图谱中1、2(绿原酸)、7(金丝桃苷)、8(异槲皮苷)以及5、6号峰(芦丁)是影响不同产地绿萼梅质量的特征化学成分。PLS-DA结果指示1、5号峰的VIP>1,说明不同产地该含量差异较大,是产地的差异性特征Q-Marker,根据Q-Marker的“五要素”要求,为体现中药成分的专属性、传递性[13-14],1、5号峰不适合作为绿萼梅质量标准控制的特征指标。再结合绿萼梅样品相对峰面积结果(表2)得知,绿原酸(2号峰)、芦丁(6号峰)、金丝桃苷(7号峰)、异槲皮苷(8号峰)在各产地绿萼梅样品中含量较高且稳定。综上,本实验筛选绿原酸、芦丁、金丝桃苷、异槲皮苷作为绿萼梅特征Q-Marker进行含量测定。
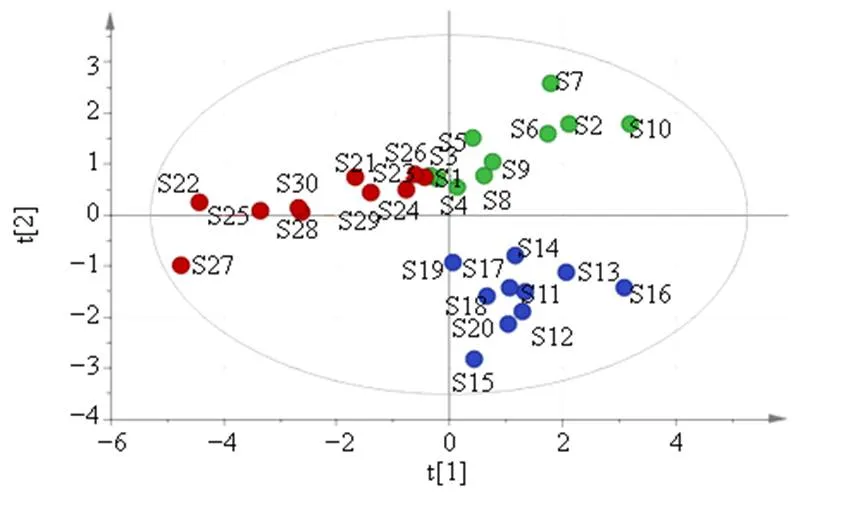
图6 绿萼梅样品PLS-DA得分图

图7 绿萼梅样品PLS-DA分析3D图

图8 30批绿萼梅样品的PLS-DA的VIP图
2.6.1 线性关系考察 精密吸取各对照品储备液适量,使用50%甲醇逐级稀释配制成6个对照品溶液,按“2.1”项下色谱条件测定绿原酸、芦丁、金丝桃苷、异槲皮苷的峰面积。以对照品质量浓度为横坐标(),峰面积为纵坐标(),绘制标准曲线,计算线性回归方程和相关系数。结果见表4。
2.6.2 精密度试验 取混合对照品,按“2.1”项色谱条件重复进样6次,测得绿原酸、芦丁、金丝桃苷、异槲皮苷峰面积的RSD值分别为1.7%、2.9%、1.8%、0.73%,结果表明仪器精密度良好。
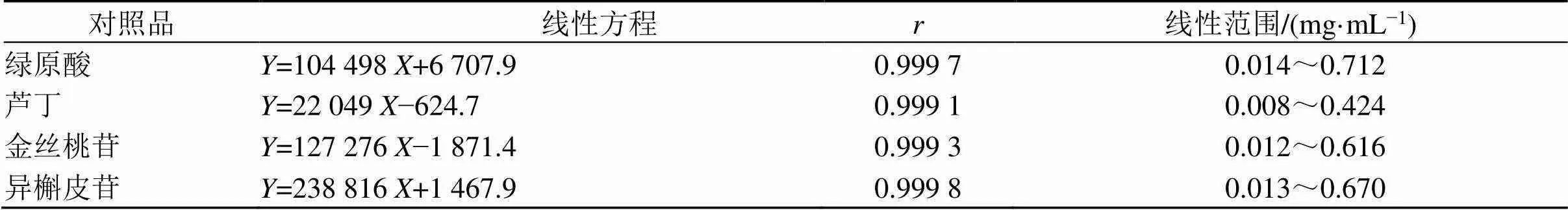
表4 对照品的线性方程、相关系数和线性范围
2.6.3 重复性试验 取S1样品共6份,按“2.2.1”项下制备供试品溶液,按“2.1”项下色谱条件分别进样测定,测得绿原酸、芦丁、金丝桃苷、异槲皮苷质量分数的RSD值分别为1.6%、2.6%、2.2%、1.0%,表明该方法的重复性良好。
2.6.4 稳定性试验 取混合对照品,分别于配制后0、2、4、8、12、24 h进样测定,按“2.1”项色谱条件重复进样6次,测得绿原酸、芦丁、金丝桃苷、异槲皮苷峰面积的RSD值分别为1.9%、2.9%、1.8%、0.73%,结果表明仪器精密度良好。
2.6.5 加样回收率试验 取测定的S1号梅花样品粉末6份各0.2 g,精密称定,分别加入等量的绿原酸、芦丁、金丝桃苷、异槲皮苷对照品溶液,按“2.2.2”项制备供试液,按“2.1”项色谱条件进行测定,绿原酸、芦丁、金丝桃苷、异槲皮苷加样回收率分别为88.73%、109.1%、87.34%、97.15%,RSD分别为3.1%、4.7%、4.3%、1.9%。
2.6.6 样品含量测定 根据“2.2.2”项下方法制备绿萼梅药材供试品溶液,按“2.1”项下色谱条件进样,记录数据,测得绿原酸、芦丁、金丝桃苷、异槲皮苷的百分含量,具体结果见表5。由结果可知,30批绿萼梅样品中绿原酸(大于3.0%)及金丝桃苷和异槲皮苷总量(大于0.35%)达到《中国药典》2020年版要求,通过比较3个产地绿萼梅样品中绿原酸、芦丁、金丝桃苷、异槲皮苷含量无显著性差异,说明这4种特征成分在绿萼梅中含量较高且稳定。
3 讨论
本实验在《中国药典》2020年版和文献的梯度洗脱方法[15]的基础上进行优化,考察了0.1%甲酸水-0.1%甲酸乙腈、0.05%磷酸水-0.05%磷酸乙腈、0.1%甲酸水-乙腈3种流动相体系,结果发现以0.1%甲酸水(A)-0.1%甲酸乙腈(B)为流动相时,样品的分离效果较好,因此选择0.1%甲酸水(A)-0.1%甲酸乙腈(B)作为流动相。实验参考文献对254、300、355 nm这3种波长进行考察,结果发现在355 nm波长下图谱的目标成分分离较好且较小峰金丝桃苷的响应值较高,因此选择355 nm作为检测波长。
近些年利用中药指纹图谱结合化学计量学方法分析中药样品的差异,在中药质量评价研究较为广泛应用[16-20]。本实验运用相似度评价、PCA、HCA和PLS-DA的化学计量学方法对不同产地绿萼梅质量进行研究。所建立的30批绿萼梅样品UPLC指纹图谱有8个共有峰,指认了绿原酸、芦丁、金丝桃苷和异槲皮苷4个特征峰。相似度评价结果显示30批样品的相似度在0.816~0.969,其中休宁有3个批次的样品相似度低于0.9,休宁的绿萼梅为半野生种植,存在地理分布差异,导致休宁绿萼梅质量不太稳定,部分相似度偏低。在聚类分析中,3个产地绿萼梅样品聚为3类,其中庐江绿萼梅大部分聚为一类,歙县绿萼梅大部分聚为一类,休宁的较为分散,质量不稳定,表明3个产地绿萼梅样品化学成分既有相似性又有差异性,造成差异性的原因可能与产地、环境、地理位置有关,与相似度结果一致。在PCA和PLS-DA分析中可看出3个产地的绿萼梅样品均位于空间的不同位置,表明不同产地绿萼梅化学成分存在一定的差异,同时筛选出绿原酸、芦丁、金丝桃苷、异槲皮苷作为绿萼梅药材的Q-Marker,其中绿原酸及金丝桃苷和异槲皮苷也是《中国药典》2020年版中梅花的含量测定检测指标,说明研究建立的筛选中药特征性标志物的方法比较全面科学,由含量检测结果可知绿萼梅中芦丁的含量比金丝桃苷、异槲皮苷黄酮总量高,可以将芦丁引入梅花的质量控制指标。

表5 30批绿萼梅样品中质量标志物的含量
4 小结
通过UPLC指纹图谱对绿萼梅主要化学成分进行宏观整体表征,可较为全面的反映绿萼梅化学信息,采用化学模式识别技术对指纹图谱中提取共有峰峰面积进行整合分析,同时结合中药Q-Marker “五要素”要求,筛选可作为绿萼梅质量评价的Q-Marker,为绿萼梅质量评价标准研究和资源开发利用提供参考,同时该分析策略可为中药质量标准研究提供研究思路。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S].一部.2020: 324.
[2] 张清华.白梅花化学成分研究及生物活性预试 [D].济南: 山东大学, 2008.
[3] 王灿灿, 张伟, 吴德玲, 等.白梅花化学成分及其药理作用研究进展 [J].广州化工, 2017, 45(24): 40-42.
[4] 陈明珠, 陈静, 黄幼霞, 等.绿萼梅总黄酮对小鼠抑郁的改善作用 [J].现代药物与临床, 2017, 32(2): 120-124.
[5] 王灿灿, 张伟, 吴德玲, 等.绿萼梅乙酸乙酯部位的化学成分研究 [J].中国中药杂志, 2020, 45(2): 347-351.
[6] Fujimoto K, Nakamura S, Matsumoto T,.Medicinal flowers.XXXVIII.structures of acylated sucroses and inhibitory effects of constituents on aldose reducatase from the flower buds of[J]., 2013, 61(4): 445-451.
[7] 张伟, 郭晶晶, 郑太华, 等.不同产地梅花中绿原酸含量测定 [J].安徽中医学院学报, 2013, 32(6): 89-91.
[8] 李国卫, 吴文平, 何民友, 等.一测多评法用于梅花多成分含量测定的适用性研究 [J].中医药导报, 2020, 26(11): 42-45.
[9] 张晓霞, 房经贵, 陈世忠, 等.高效液相色谱法测定中药梅花中绿原酸、芦丁、金丝桃苷和异槲皮苷的含量 [J].中国医院药学杂志, 2016, 36(2): 107-109, 156.
[10] 魏梅, 朱德全, 陈向东, 等.梅花配方颗粒中4种黄酮类成分含量测定 [J].中国实验方剂学杂志, 2015, 21(14): 49-51.
[11] 赵鸿鹏, 许浚, 张洪兵, 等.基于质量传递与溯源的中药质量标志物(Q-Marker) 的发现策略及应用 [J].中草药, 2021, 52(9): 2557-2565.
[12] 刘昌孝.基于中药质量标志物的中药质量追溯系统建设 [J].中草药, 2017, 48(18): 3669-3676.
[13] Liu C X, Cheng Y Y, Guo D A, et al.A new concept on quality marker for quality assessment and process control of Chinese medicines [J]., 2017, 9(1): 3-13.
[14] 刘耀晨, 许浚, 张洪兵, 等.基于化学成分特有性的质量标志物发现策略及应用 [J].中草药, 2021, 52(9): 2548-2556.
[15] 张铁军, 白钢, 刘昌孝.中药质量标志物的概念、核心理论与研究方法 [J].药学学报, 2019, 54(2): 187-196, 186.
[16] 王灿灿, 杨沫, 吴德玲, 等.绿萼梅药材超高效液相色谱指纹图谱研究 [J].安徽中医药大学学报, 2019, 38(1): 93-96.
[17] 陶晓赛, 龚海燕, 谢彩侠, 等.基于UPLC指纹图谱结合化学计量学评价不同产地盾叶薯蓣药材质量 [J].中草药, 2021, 52(1): 227-233.
[18] 戚华文, 徐鑫, 温柔, 等.基于化学模式识别技术的枳实HPLC定量指纹图谱研究 [J].分析测试学报, 2021, 40(1): 72-78.
[19] 林丽, 李欢欢, 谢辉, 等.基于HPLC指纹图谱结合化学计量学的旋覆花药材质量评价研究 [J].中草药, 2021, 52(6): 1751-1758.
[20] Meng Z, Huang Y, Wang L J,.Quality evaluation ofusing high-performance liquid chromatography with chemical pattern recognition [J]., 2020, 3(6): 200-206.
Evaluation of quality markers ofFlos based on fingerprint and chemical pattern recognition
ZHAO Hong-su1, 2, 3, ZHAO Ru1, QIAO Jin-wei4, JIN Chuan-shan1, 2, 3, WANG Can-can1, ZHANG Wei1, 2, 3, WU De-ling1, 2, 3
1.School of Pharmacy, Anhui University of Chinese Medicine, Hefei 230012, China 2.Key Laboratory of Xin'an Medicine, Ministry of Education, Hefei 230012, China 3.Anhui Key Laboratory of Traditional Chinese Medicine Decoction Pieces of New Manufacturing Technology, Hefei 230012, China 4.Second Affiliated Hospital of Anhui University of Chinese Medicine, Hefei 230061, China
To analyze the UPLC fingerprints data ofusing chemical pattern recognition technology, screen the characteristic components and perform quantitative analysis, so as to provide scientific basis for the quality evaluation of.A total of 30 batches ofsamples from three production areas were collected, and the UPLC fingerprint ofwas established.The main characteristic peaks were identified by comparison with reference materials, and similarity analysis, cluster analysis, principal component analysis (PCA) and discriminant analysis by partial least squaremethod (PLS-DA) were used to identify and analyze the characteristic components infrom three producing areas, and the quantitative analysis was carried out.Eight common peaks were calibrated from UPLC fingerprints of 30 batches of, and the similarity was between 0.816—0.969.Through clustering analysis, PCA and PLS-DA, each producing area ofwas better distinguished.Chlorogenic acid, rutin, hyperin and isoquercitrin were screened as Q-Markers by comprehensive analysis, and the mass fractions were 3.08%—4.71%, 0.41%—0.71%, 0.13%—0.25% and 0.25%—0.38%, respectively.The method of fingerprint combined with chemical pattern recognition technology can effectively screen the quality markers offrom different producing areas, and provide a reference for the quality evaluation of.
; quality marker; quantitative fingerprint; chemical pattern recognition technology; chlorogenic acid; rutin; hyperoside; isoquercitrin
R286.2
A
0253 - 2670(2022)05 - 1345 - 09
10.7501/j.issn.0253-2670.2022.05.008
2021-07-09
国家重点研发计划(2018YFC1707004);安徽省自然基金资助项目(2008085QH394)
赵宏苏,女,讲师,从事中药质量评价及物质基础研究。E-mail: hongsuzhao@ahtcm.edu.cn
通信作者:张 伟,男,副教授,硕士生导师,主要从事中药炮制及中药饮片质量标准研究。E-mail: zhangwei@ahtcm.edu.cn
吴德玲,男,教授,博士生导师,主要从事天然药物化学及中药物质基础研究。E-mail: dlwu7373@ahtcm.edu.cn
#并列第一作者:赵 茹,女,中药学专业,从事中药质量评价研究。E-mail: 3473170553@qq.com
[责任编辑 时圣明]
