基于D-Ser/NR1的变化探讨电针心包经穴促脑缺血模型大鼠神经修复机制*
2022-03-03周颖刘蕾袁柳媚蒋佳马雁鸿陈成潘江石文英章薇娄必丹
周颖,刘蕾,袁柳媚,蒋佳,马雁鸿,陈成,潘江,石文英,章薇,娄必丹
1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007
随着全世界人口老龄化程度日益加深,脑中风成为我国乃至世界面临的重大公共卫生问题之一[1-2]。近年来兴奋性神经毒性作为导致脑缺血后脑细胞坏死与凋亡的重要始因,已成为重点研究方向之一[3]。有文献报道,电针可抑制脑组织缺血区胞外兴奋性氨基酸水平,调控N-甲基-D-门冬氨酸(N-methyl-D-aspartic Acid,NMDA)受体不同亚基表达水平,降低细胞内Ca2+浓度,拮抗缺血导致的兴奋性神经毒性,促进神经功能恢复[4-5]。D-丝氨酸(D-serine,D-Ser)作为NMDA受体重要的协同激动剂,通过与NMDA受体亚单位NR1亚基位点结合,参与兴奋性神经毒性[6-7]。研究表明,电针心包经穴具有促进脑缺血后神经修复的作用[8-9]。本课题组前期表明,电针局灶性脑缺血损伤模型大鼠心包经、肺经后,大鼠缺血侧脑组织 D-Ser 含量、NR1蛋白表达下降[10-11],神经功能缺损症状明显改善,提示电针心包经穴可能对 D-Ser、NR1表达具有调节作用,而脑缺血后不同时期的神经损伤呈现不同程度的变化。故本研究拟进一步探讨电针心包经穴在局灶性脑缺血后不同时相点(1 d、3 d、7 d、14 d、21 d)调控脑缺血损伤模型大鼠缺血侧脑组织D-Ser含量、NR1蛋白表达的作用。
1 材料
1.1 动物SPF级SD雄性大鼠,体质量280~300 g,120只,由湖南斯莱克景达实验动物有限公司提供,实验动物许可证号:SCXK(湘)2016-0002。安静环境下饲养,室温22~26 ℃,相对湿度50%~70%。
1.2 试剂甲醇(美国Thermo Fisher公司,货号:67-56-1);乙腈(美国Thermo Fisher公司,货号:75-05-8);甲酸(美国Sigma Aldrich公司,货号:67-56-1),乙酸(美国Sigma Aldrich公司,货号:75-05-8);D-Ser(美国Sigma Aldrich公司,货号:312-84-5);硼酸缓释液(美国Sigma Aldrich公司);BCA蛋白定量试剂盒(康为世纪生物有限公司,货号:CW0014S);丙烯酰胺(阿拉丁,货号:J173005);Marker(美国Thermo Fisher公司,货号:#26617);PVDF膜(美国Millipore公司,货号:IPVH00010);一抗:Rabbit Anti NR1(江苏新科生物研究中心有限公司,货号:AF6407);二抗:辣根酶标记山羊抗兔IgG(H+L)(北京中杉金桥生物技术有限公司,货号:ZB-2301);内参一抗:MM Anti-Actin(北京中杉金桥生物技术有限公司,货号:TA-09);内参二抗:辣根酶标记山羊抗鼠IgG(北京中杉金桥生物技术有限公司,货号:ZB-2305)。
1.3 仪器尼龙线栓[头直径(0.38±0.02)mm,北京西浓科技有限公司];华佗牌毫针(0.2 mm×15 mm,苏州医疗用品厂有限公司);韩式电针治疗仪(型号:HANS-200A,苏州医疗用品厂有限公司);高效液相色谱仪[(配有荧光检测器),美国Waters公司];C18色谱柱(250 mm×4.6 mm,5 μm,Agilent ZROBAX);冷冻高速离心机(型号:TGL-16D,常州中捷实验仪器制造有限公司);紫外分光光度计(型号:UV-1600PC,上海美谱达仪器有限公司);蛋白垂直电泳仪(型号:DYY-6C,北京市六一仪器厂);超高灵敏度化学发光成像系统(型号:Chemi DocTM XRS+,美国Bio-Rad公司)。
2 方法
2.1 动物分组将120只大鼠随机分为2组,即模型组和电针组,每组60只,造模后每组再分为1 d、3 d、7 d、14 d和21 d五个时相点,每个时相点12只大鼠。
2.2 造模方法采用持久性脑缺血损伤模型大鼠模型,造模参考Zea Longa、Koizumi[12-13]报道的方法,并在实验过程中对具体操作进行适应性修改[14],大鼠麻醉后颈部正中作2 cm长切口,沿筋膜钝性分离左侧胸锁乳突肌与胸骨舌骨肌间肌间隙,直至充分暴露左侧颈总动脉、颈内动脉、颈外动脉,结扎颈外动脉及颈总动脉近心端,同时夹闭颈内动脉,在颈总动脉近分叉处剪口,将线栓插入,松开动脉夹,轻推使其沿颈内动脉入颅,至大脑中动脉,插入深度由分叉处计(18.5±0.5)mm,固定、间断线栓,缝合肌肉和皮肤。
2.3 造模成功标准参考Zea Longa[9]的5分制评分标准,待大鼠麻醉清醒后评分。无偏瘫肢体功能缺失,计0分;不能完全伸展右前肢,提尾悬吊时右前肢屈曲,计1分;爬行时向右转圈,追尾,计2分;爬行时向右倾倒,计3分;不能自主行走,意识障碍,计4分。1~3分纳入实验,其余剔除。
2.4 处理方法电针组:据参照《实验动物针灸穴位图谱》[15]及拟人比照法确定穴位定位,选取瘫侧心包经不同节段的四个穴位:天泉、曲泽、内关、大陵。定位如下:天泉:前肢内侧中央距腋前纹头约 3 mm 左右;曲泽:肘弯横纹偏尺侧凹陷中;内关:前肢内侧离腕关节3 mm左右的尺桡骨缝间;大陵:前肢内侧腕横纹之中央凹陷处。于造模成功24 h后开始行针刺治疗,每天1次。将大鼠捆绑后用毫针刺入穴位,深度3~4 mm,连接韩式电针治疗仪,取天泉、曲泽穴一组,内关、大陵一组,刺激参数:连续波,输出电流0.5~1 mA,频率15 Hz,强度以局部组织轻颤为度,时间30 min。模型组大鼠仅捆绑处理,每次30 min,每天1次。
2.5 观察指标及检测方法
2.5.1 神经功能缺损评分采用Feeney[16]提出的走横木实验(beam walking test,BWT),综合评价大鼠脑缺血后运动功能、平衡功能及身体协调功能。各组大鼠均于造模成功后6 h进行第一次评分,于最后一次处理后30 min进行第二次评分。大鼠完全不能爬过横木,且无法将后肢放在水平位,计1分;大鼠完全不能爬过横木,但可将瘫痪侧后肢放在水平位并保持平衡,计2分;大鼠不能爬过横木,跌倒概率>50%,计3分;大鼠不能爬过横木,跌倒概率<50%,计4分;大鼠能爬过横木,其患侧肢体起作用<50%,计5分;大鼠能爬过横木,其瘫痪侧肢体起作用>50%,计6分;大鼠顺利爬过横木,瘫痪肢体完全起作用,计7分。
2.5.2 检测大鼠脑组织D-Ser定量应用高效液相色谱仪荧光检测法(high performance liquid chromatography,HPLC)进行定量分析:操作结束后,断头取脑,切取缺血侧脑组织,冻存备用。统一称缺血侧脑组织质量,经过匀浆、样品前处理、上机检测。样品加入4倍体积盐酸缓冲液(0.1 mol·L-1),匀浆后,12 000 r·min-1离心5 min,取1 mL上清液,加入 3 mL 乙腈去除样品中的蛋白质和大分子物质后,再次离心,完成前处理后取10 μL样品,加入190 μL衍生化试剂(OPA和3-巯基丙酸溶于0.4 mol·L-1硼酸盐缓冲溶液中,各10 g·L-1),涡旋混匀后反应 5 min,过滤头上机检测,进样量为10 μL,流动相A(0.1%甲酸-水溶液),流动相B(乙腈),荧光检测波长为λex=345 nm,λem=435 nm。以标准溶液绘制标准曲线,以D-Ser含量(X)为横坐标,其峰面积(Y)为纵坐标,所得线性方程为:Y=3.79e+6×-1.07e+5(R=0.999668),将样品在高效液相色谱仪下测得的峰面积代入方程式,即可算出样品的D-Ser含量。
2.5.3 Western Blot法检测大鼠脑组织中NR1蛋白表达水平如前操作结束后,切取脑组织备用。液氮将研钵预冷,取0.2 g脑组织研钵研磨,加入500 μL细胞裂解液,研磨至匀浆无明显颗粒,12 000 r·min-1离心15 min,取上清液,用BCA法进行蛋白定量,计算蛋白浓度,加入缓冲溶液,煮沸5 min。样品丙烯酰胺凝胶电泳(60 V压缩蛋白,80 V 分离蛋白)后,转至PVDF膜(300 mA,2 h),将PVDF膜放入3%的脱脂牛奶封闭液,室温封闭1 h,加入一抗孵育过夜后,TBST浸洗3次,加入二抗孵育2 h,再次TBST浸洗3次,最后发光液浸湿PVDF膜后放置于超高灵敏度化学发光成像系统样品放置区运行显影成像。以NR1蛋白表达量与内参蛋白表达量的比值表示NR1的表达水平。
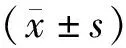
3 结果
3.1 各组大鼠神经功能缺损评分比较与处理前比较,模型组大鼠14 d、21 d神经功能缺损评分显著升高(P<0.05),电针组3 d、7 d、14 d、21 d大鼠神经功能缺损评分均显著升高(P<0.05)。与处理后同一时相点模型组比较,电针组大鼠神经功能缺损评分在3 d、7 d、14 d、21 d四个时相点均显著降低(P<0.05)。见表1。
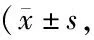
表1 各组大鼠BWT评分比较 分)
3.2 各组大鼠脑组织D-Ser含量比较与同一时相点模型组比较,电针组在3 d、14 d、21 d时大鼠脑组织D-Ser含量显著降低(P<0.05)。见表2。

表2 各组大鼠缺血侧脑组织D-Ser含量比较
3.3 各组大鼠脑组织NR1蛋白表达水平比较与同一时相点模型组比较,电针组大鼠在1 d、3 d、7 d、14 d、21 d时脑组织NR1蛋白表达均显著下调(P<0.05)。见表3、图1。
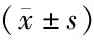
表3 各组大鼠缺血侧脑组织NR1蛋白表达水平比较

图1 各组大鼠缺血侧脑组织NR1蛋白表达
4 讨论
兴奋性神经毒性是脑缺血所引发的诸多神经损伤级联反应的重要始因之一,在脑缺血缺氧的病理状态下,兴奋性神经递质谷氨酸浓度异常升高,NMDA受体过度激活,造成细胞内Ca2+超载,从而产生神经毒性[17]。D-Ser作为NMDA受体重要的内源性协同激动剂[18],在哺乳动物脑内由丝氨酸消旋酶(serine racemase,SR)催化形成,其通过与NR1亚基上的位点结合,参与缺血发生后NMDA受体介导的兴奋性神经毒性。NR1亚基作为NMDA受体的主要功能单位[19],可单独调节NMDA受体离子通道的开闭[20]。因此,通过调控脑内D-Ser含量和NR1表达,可作为脑缺血发生后的一种神经保护和治疗策略[21-22]。
在本实验中,处理后电针组各时相点BWT评分均较模型组同时相点显著升高,其中3 d、7 d、14 d、21 d改善明显,表明电针心包经穴对大鼠的运动、平衡功能具有明显的改善作用,并随治疗时间增长效果更为显著。目前研究认为,脑缺血后急性期脑内D-Ser水平显著升高,加剧兴奋性神经毒性,SR基因敲除鼠或运用SR抑制剂均可使脑缺血损伤模型大鼠兴奋性神经毒性减轻[23-26],这是通过降低 D-Ser含量而对神经产生保护作用。本研究发现,模型组大鼠脑组织D-Ser含量呈现波动下降趋势,而电针组下降趋势更稳定,且3 d、7 d、14 d、21 d大鼠脑内D-Ser含量均较模型组低。大多数NMDA受体是NR1亚基(结合协同激动剂)和NR2A-D(结合谷氨酸)亚基不同组合构成的异四聚体[27-28],NR1可作为观测NMDA受体功能及状态的窗口。研究认为,NR1蛋白表达在缺血早期应激性升高,在1~3 d逐渐下降,针刺干预在早期即可显著降低NR1表达,从而减轻兴奋性神经毒性[29]。在本研究中,电针组大鼠缺血侧脑组织NR1蛋白表达均较模型组明显降低。这些结果与电针处理3 d、7 d、14 d、21 d后运动功能逐渐改善的趋势一致,说明电针心包经穴改善脑缺血损伤模型大鼠的神经功能缺损症状可能与其降低D-Ser含量、NR1蛋白表达有关。
本研究发现,模型组大鼠缺血侧脑组织D-Ser含量与NR1表达均呈现明显波动变化,D-Ser含量在1~3 d平稳,7 d明显降低,14 d有所回升,21 d又出现下降,同时NR1表达在1~3 d呈现下降,7 d、14 d呈现回升,21 d又出现小幅下降。D-Ser在7 d、14 d的变化与在永久脑缺血损伤模型小鼠观察到的D-Ser在6~10 d延迟性降低和10~15 d逐渐回升一致,其延迟性降低是对缺血后 NMDA 受体过度表达的一种保护性反馈,主要是由甘氨酸浓度升高[30],但D-Ser在缺血急性期后整体上呈现为下降趋势。本研究结果显示,D-Ser 在14 d有所回升,但并未超过急性期水平,且在21 d继续保持下降趋势。根据相关研究,NR1表达在早期应激性升高后会逐渐下降[29],但本研究发现模型组大鼠脑组织NR1蛋白表达在7 d、14 d反而呈现上调,并在21 d亦保持较高水平,这与Que等[31]研究大鼠在局灶性脑缺血后损伤侧脑组织NMDA受体增长延迟14 d相类似,还发现缺血发生后NMDA受体表达和功能上调状态可达30 d。NR1表达延迟性升高可能与D-Ser生成降低导致受体超敏性有关[23],这个观点支持在SR活性抑制导致D-Ser含量降低的基础上,刺激NR1表达增强。因此,认为D-Ser与NR1间存在一种双向反馈,这也证明了缺血后神经功能修复往往还取决于多环节间的相关作用,而与模型组比较,电针组有效抑制了D-Ser含量的波动变化,使其在1~21 d整体呈现稳定下降趋势,也降低了NR1蛋白表达水平。本研究电针组NR1表达在1~3 d下降趋势明显考虑为缺血急性期后电针心包经穴能迅速降低NR1表达,而7 d又呈现短暂回升趋势,一方面是对D-Ser含量下降的反馈,另一方面缺血后期NR1表达过低反而会影响信号传递,不利于神经恢复[32]。提示电针改善脑缺血损伤模型大鼠的神经功能缺损症状,可能也与其稳定缺血后D-Ser的波动以及调控NR1表达变化有关。
综上所述,本研究认为,对于脑缺血导致的兴奋性神经毒性,电针心包经穴可同时调控D-Ser/NR1这一损伤环节的两端,促使激动剂与受体同步下调,通过降低D-Ser含量、调控其与NR1的结合,从而达到降低神经毒性、保护神经功能的作用。
