玉米根毛单细胞类型转录组分析
2022-03-03王春霞曹子健许子洁陈立群
王春霞, 王 晶, 曹子健, 胡 宝, 许子洁, 陈立群
(1.河北工程大学园林与生态工程学院,河北邯郸 056038;2.中国农业大学生物学院植物生理学与生物化学国家重点实验室,北京 100193)
根毛是从根表皮细胞特异性分化来的长管状结构的单细胞,大约覆盖根表面积的77%左右,根毛通过扩大根的吸收面积从而促进水分和矿质营养的吸收。同时根毛是豆类如大豆中根瘤菌与根瘤形成的第一接触点,根毛还参与了病原体的防御。另外,根毛是典型的顶端生长的植物单细胞,是研究植物细胞极性生长发育、细胞分化很好的模式材料。
根毛的生长发育主要分为3个阶段:第1阶段为根毛细胞的命运决定;第2阶段为根毛的起始生长;第3阶段为根毛的顶端生长过程。根毛细胞的命运决定方式有3种不同类型,第1种类型是根表皮细胞随机分化发育成根毛,玉米和大豆的根毛是这种分化类型;第2种类型是根表皮原细胞经过不均等的细胞分裂,产生的较小的细胞分化发育成根毛,水稻根毛是这种分化类型;第3种类型是根表皮细胞的分化方式是由2类细胞所处的位置决定的,这2种细胞分别为生毛细胞 (trichoblast,H cells) 与非生毛细胞 (atrichblast,N cells),紧邻2个皮层细胞的生毛细胞将来能够分化发育成根毛,然而紧靠单个皮层细胞的非生毛细胞,是不能分化发育成根毛的,十字花科植物拟南芥的根毛是这种分化方式。
目前,关于模式植物拟南芥根毛生长发育分子机制的研究已经比较深入,由多个基因共同参与调控,其中()、()、()、()、()、() 和() 等基因参与根毛细胞的命运决定。其中基因是调控拟南芥根毛生长的关键基因,它编码亮氨酸拉链型转录因子,负调控拟南芥根毛的生长,突变体中根毛的生长发生严重紊乱,非生毛细胞也可以分化发育成根毛。基因的表达受到转录因子复合物WER-GL3-EGL3-TTG1和 CPC-GL3-EGL3-TTG1的调控。当根毛细胞的命运决定完成以后,根毛就进入快速的起始生长阶段,在数10 min内即可完成该过程。目前的研究已经鉴定到多个基因参与调控根毛的起始生长,已知拟南芥() 基因编码一种含DHHC-CRD结构域的锚蛋白,突变体根毛基部的直径大小增加约30%。() 基因参与根毛细胞壁的合成。根毛的伸长生长是一种典型的顶端生长过程,根毛的顶端生长受到多种因素的协同调控,如Ca、囊泡、细胞骨架、小G蛋白、活性氧等。
目前,对模式植物拟南芥根毛的研究较深入,但是对玉米根毛生长发育机制的研究却非常有限,仅报道了几个基因,其中包括()、()、()、()及。玉米作为一种单子叶植物,其根系类型、表皮细胞分化为根毛的方式与十字花科植物拟南芥有所不同,因此推测玉米根毛生长发育与拟南芥也可能存在一些不同的调控机制。本研究以玉米根毛为研究对象,收集生长3 d的玉米B73根毛进行单细胞类型的转录组分析,筛选在玉米根毛中特异表达的基因,挖掘参与玉米根毛生长发育的关键基因,分析玉米根毛基因主要参与的代谢通路及生物学过程,旨在为深入研究玉米根毛生长发育分子机制提供重要的依据。
1 材料与方法
1.1 试验材料
本试验于2019年在河北工程大学开展,试验材料为玉米 (L.) 自交系B73。
1.2 试验方法
1.2.1 材料处理与收集 玉米种子用10%的NaClO溶液消毒8 min,然后用去离子水清洗 5~8 次。将玉米种子铺在种子萌发培养纸上,然后将培养纸卷成筒状,垂直放入去离子水中进行培养,培养条件为避光,28 ℃。一部分玉米种子在72 h后根长达到约 3~4 cm时,用剪刀剪下玉米根迅速放入液氮中进行冷冻,然后在液氮中用细胞刮 (Coring,3010) 轻轻迅速刮下玉米根毛,随后将玉米根毛收集到50 mL离心管中,剥离根毛后剩下的玉米根也单独收集到50 mL离心管中,在-80 ℃冰箱中保存。另一部分玉米种子继续培养至6 d后,收集幼苗,存放于-80 ℃冰箱。每种试验材料进行2个生物学重复测序分析。
1.2.2 RNA的提取及质量检测 玉米组织RNA提取的步骤参照天根生物科技(北京)有限公司的RNAprep Pure Plant Kit (货号:DP441) 进行操作。然后用 NanoDrop ND-2000 (NanoDrop,Wilmington,DE,美国)对RNA 的浓度与纯度进行质控,再通过琼脂糖电泳进行验证。
1.2.3 RNA-seq文库构建及转录组测序 植物总RNA提取完成后,首先进行mRNA的纯化,具体操作步骤参考NEBNext® Poly(A) mRNA Magnetic Isolation Module (货号:7490S) 的说明书进行。mRNA的纯化完成后,将mRNA反转录成cDNA,然后回收cDNA产物。接下来进行cDNA末端修复、加接头及PCR扩增,最后再回收PCR产物,到此RNA-seq文库已经制备好,然后送北京贝瑞和康生物技术有限公司进行转录组测序。
1.2.4 转录组数据分析 转录组测序得到的原始数据 (raw data) 经过去除接头和低质量的数据后得到过滤后的数据 (clean data),然后将clean data用TopHat2比对到玉米基因组中,基因的表达水平采用 reads per million (RPKM) 的方法进行计算,用R package edgeR进行差异表达基因 (DEGs) 分析,表达倍数变化至少是2倍且-value小于0.05的基因才被视作差异表达基因。用interProScan和blast2go进行Gene Ontology (GO) 富集分析。通过 Pearson correlation 计算样品重复之间的转录组测序数据的相关性。
1.2.5 实时荧光定量PCR (qRT-PCR) 分析 以转录组测序使用的RNA为模板,反转录成cDNA,通过Primer5软件设计引物,引物序列见表1。使用2×RealStar Green Power Mixture with ROX Ⅱ反应液,反应体系50 μL:cDNA模板1 μL,正向引物(10 μmol/L) 1 μL,反向引物(10 μmol/L) 1 μL,2×RealStar Green Power Mixture 25 μL,ROX Reference Dye (50×) 1 μL,去离子水 21 μL。在ABI 7500 Real-time PCR仪中按照以下程序进行反应,反应程序:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 1 min,72 ℃ 30 s,40个循环。

表1 qRT-PCR引物
1.2.5 玉米根毛中可变剪切的琼脂糖凝胶电泳分析 以转录组测序使用的RNA为模板,反转录成cDNA,通过Primer5软件设计基因和的引物,引物序列见表2。反应体系为20 μL:cDNA模板1 μL,正向引物(10 μmol/L) 1 μL,反向引物(10 μmol/L) 1 μL,2×PCR StarMix 10 μL,去离子水7 μL。扩增程序:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 40 s,35个循环,72 ℃ 5 min,20 ℃保存。

表2 可变剪切引物
2 结果与分析
2.1 转录组数据产出
根毛是根表皮细胞分化生长出的具有管状结构的单细胞,大约覆盖根表面积的77%左右,对植物水分和矿质营养的吸收具有重要的作用。在 28 ℃ 黑暗条件下,玉米自交系B73的种子在萌发纸中培养3 d后,玉米根能长到 5~7 cm(图1-A),将玉米根快速剪下放入液氮中进行冷冻,然后用细胞刮轻轻迅速刮下初生根上的根毛(图1-B)。分离出的根毛用4′,6-二脒基-2-苯基吲哚(DAPI)染色后,可以观察到完整的细胞核(图1-C),说明可以用于后续的 RNA-seq 分析。

大量收集单细胞根毛后,提取根毛RNA,建立根毛RNA-seq文库。同时以剥离根毛的初生根及生长6 d幼苗的地上部分为材料,同样也提取RNA,分别建立初生根和幼苗RNA-seq文库。首先从 5 μg 的总RNA中将mRNA分离纯化出来,然后反转录为cDNA,进而经过末端修复,dA-Tailing加尾,加接头及PCR扩增后构建好RNA-seq文库。每个样品设置2个生物学重复,共产生6个RNA-seq文库。通过北京贝瑞和康生物技术有限公司的Illumina Hiseq2500平台进行测序,共得到43.17 Gb数据,具体每个样品的测序数据产出量见表3。转录组测序得到的原始数据 (raw data) 经过去除接头和低质量的数据后,每个RNA-seq文库得到约 20~40 million的125 bp的clean reads。大约 85% 的clean reads能够比对到玉米基因组 (ZmB73_RefGen_v3),共得到约23 000个基因。为检测 RNA-seq数据的可靠性,首先检测每个样品的2个生物学重复之间的相关性,结果发现它们的皮尔森相关系数均在 0.98~0.99 之间,表明RNA-seq数据具有较高的可靠性,可以用于后续的分析。
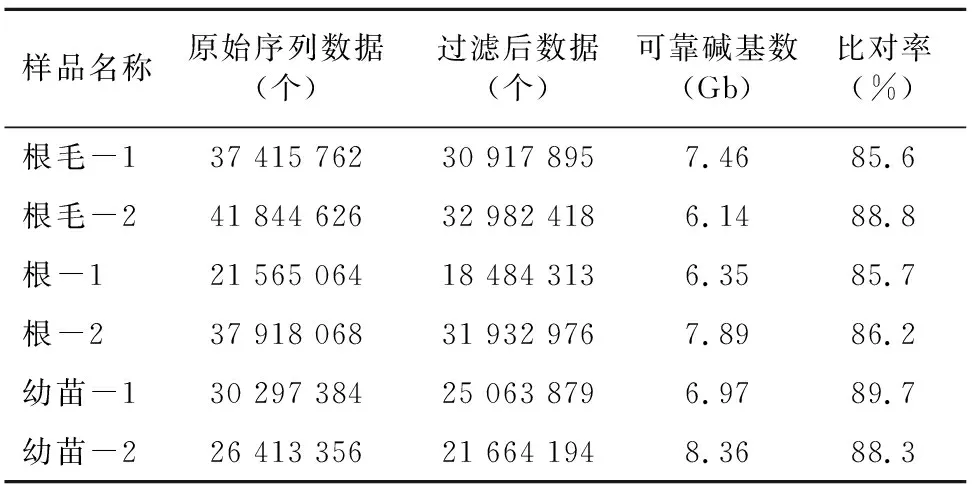
表3 各个转录组文库的RNA-seq数据量
2.2 玉米根毛特异表达基因
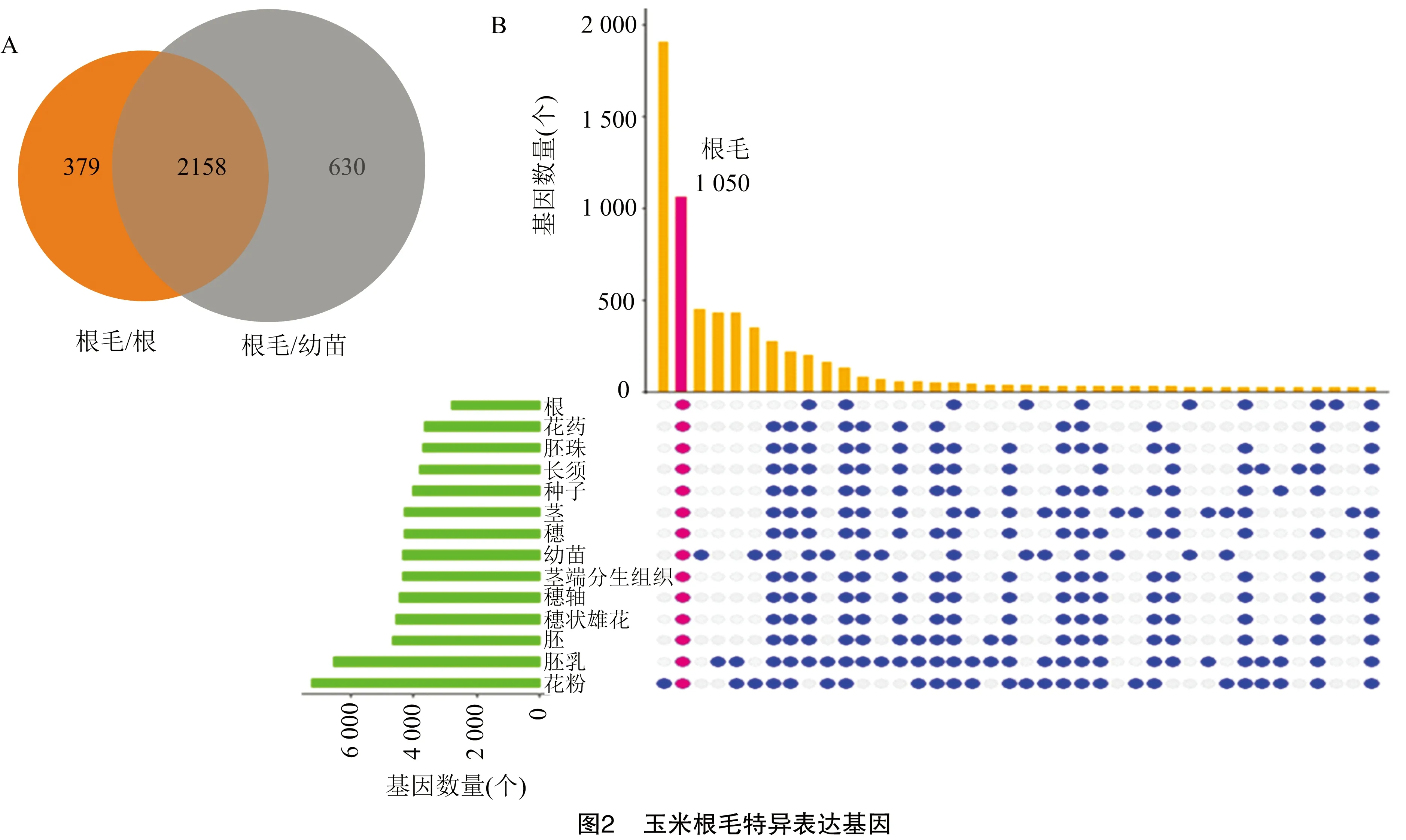
为了筛选在玉米根毛中特异表达的基因,用R package edgeR进行差异表达基因 (DEGs) 分析。根毛转录组数据与玉米初生根 (剥离根毛) 的转录组数据比较,发现2 768个基因 (RPKM≥1,Fold change≥2,FDR≤0.05) 在根毛中的表达水平升高。与6 d幼苗地上部分的转录组数据比较,发现 4 521个基因 (RPKM≥1,Fold change ≥2,FDR≤0.05) 在根毛中的表达量升高。同时与初生根 (剥离根毛) 及6 d幼苗的地上部分比较,分析得到 2 389 个在玉米根毛中特异表达的基因 (RPKM≥1,Fold change≥2,FDR≤0.05) (图2-A)。为了进一步筛选在根毛中特异表达的基因,从NCBI SRA下载了玉米其他12种组织的转录组数据,与这12种组织的转录组数据进一步比较,筛选到1 050个基因 (RPKM≥1,Fold change≥2,FDR≤0.05) 在玉米根毛细胞中特异表达(图2-B)。
2.3 玉米特异表达基因的qRT-PCR
为了验证RNA-seq数据的可靠性,进一步从 1 050 个根毛特异表达基因中随机挑选9个基因,分别为、、、、、、、和,用于检测差异表达基因的准确性。qRT-PCR试验所使用的RNA与用于 RNA-seq 分析的RNA是相同的。qRT-PCR结果显示这9个基因的表达趋势与RNA-seq数据基本符合(图3),证明分析得到的1 050个根毛特异表达基因是准确的。可以用于后续的研究。

2.4 玉米根毛特异表达基因的Gene Ontology (GO) 富集
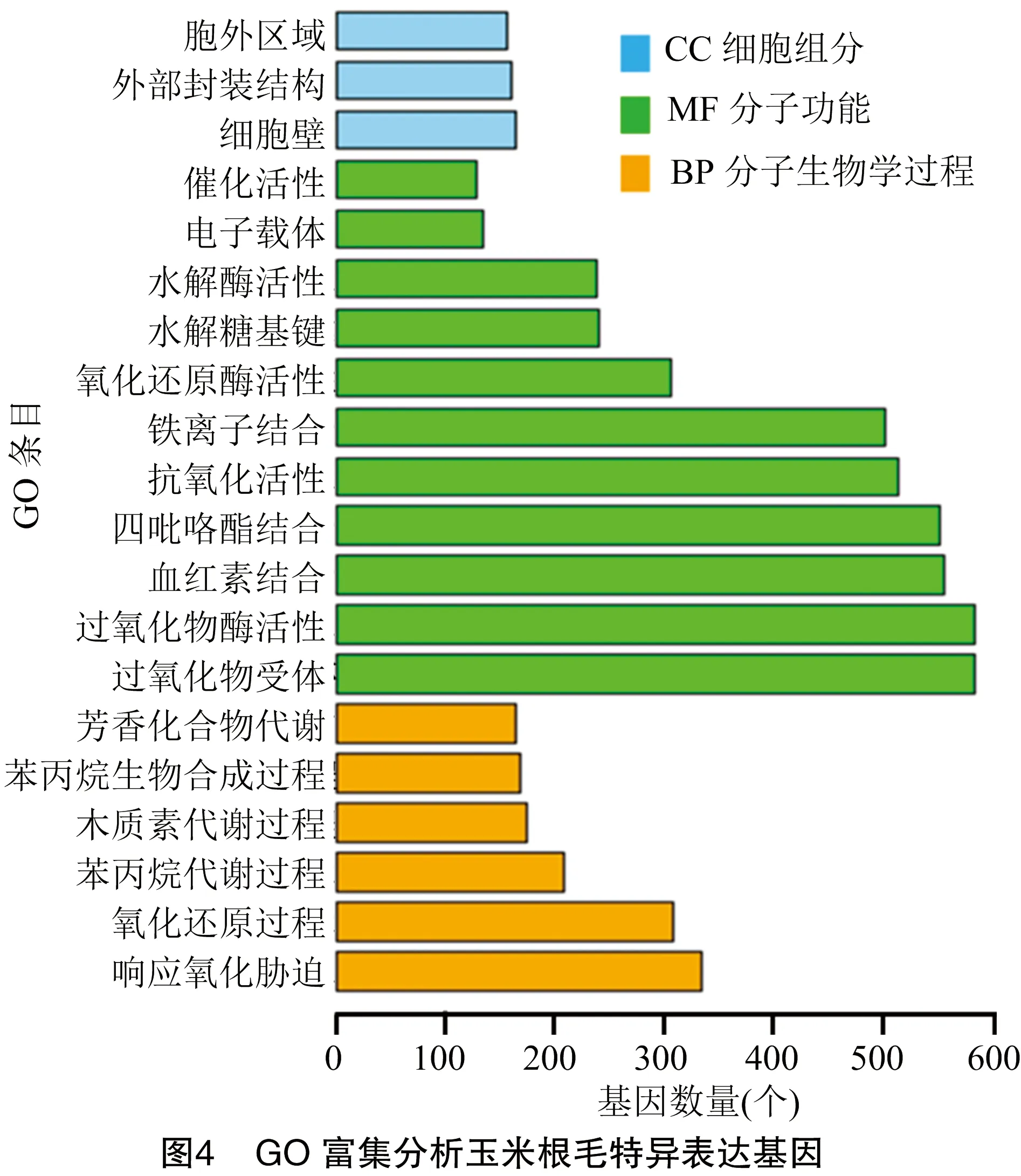
为了研究根毛特异基因的功能及参与的生物学过程,使用FuncAssociate 3.0 (http://llama.mshri.on.ca/funcassociate_client/html/) 对1 050个玉米根毛特异表达基因进行GO富集分析,结果发现这些根毛特异表达基因在细胞组分方面主要参与细胞壁的合成 (234个基因) 和细胞外部组分的组装 (189个基因);在分子功能方面主要参与离子结合 (615个基因)、氧化反应 (609个基因) 及铁离子集合(550个基因);在分子生物学过程方面主要参与氧化还原反应 (328个基因) 及应答氧化胁迫过程 (562个基因) (图4)。已有的研究表明细胞壁组分、Ca及活性氧(ROS)对根毛的生长发育具有重要的作用,本研究的GO分析结果进一步说明了这些因素对根毛生长的重要性。
2.5 根毛发育基因同源性
目前,对拟南芥根毛生长发育机制的研究已经比较深入,发现许多基因参与调控拟南芥根毛的分化,起始生长和顶端生长。将1 050个玉米根毛特异表达基因与已知参与调控拟南芥和水稻根毛生长发育的基因进行同源比对,鉴定到23个同源基因(表4),包括3个水稻基因。其中、()、()、、、、()、() 和() 基因参与根毛细胞壁的合成。、、和() 基因编码bHLH家族转录因子,参与调控根毛的伸长生长。()、() 和() 基因可能通过细胞骨架来影响根毛的生长。()()、和基因编码鸟苷酸交换因子,()基因编码RhoGDP解离抑制因子,它们可能通过调节ROP蛋白的活性参与根毛的生长。SEC6是Exocyst蛋白的一个亚基,Exocyst蛋白参与胞吐过程,囊泡运输对根毛的生长同样具有重要的作用。

表4 玉米根毛特异表达基因的同源基因
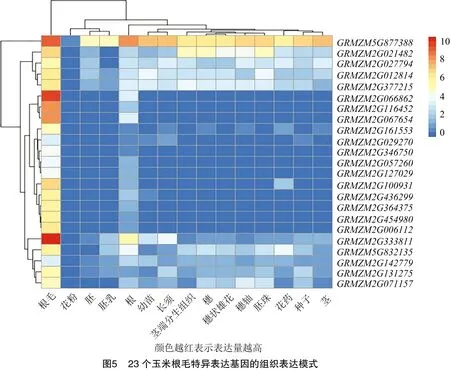
对这23个基因的组织表达水平进行分析,从图5可以看出,这些基因在玉米根毛中的表达水平高于其他组织。上述分析结果暗示,这些玉米根毛特异表达基因可能与它们在拟南芥或水稻中的同源基因一样在根毛的生长发育过程中起到重要作用,并且它们的功能在物种间是保守的。
2.6 玉米根毛中特异表达转录因子
转录因子能够与下游调控的靶基因启动子区域中顺式作用元件结合,进而抑制或激活靶基因的表达。对1 050个玉米根毛特异表达基因进行功能注释,筛选到68个转录因子,这些转录因子可以被划分到19个家族,其中属于WRKY家族、bHLH家族及ERF家族的转录因子数量最多,包括14个WRKY家族转录因子、12个bHLH家族转录因子及8个ERF家族转录因子(表5)。已知bHLH家族中的LRL转录因子参与调控根毛的生长发育,拟南芥中的5个LRL转录因子都参与调控根毛的生长发育;拟南芥中WRKY75转录因子通过抑制() 和基因的表达来调控根毛的生长。推测玉米根毛中这些转录因子可能也参与调控玉米根毛的生长发育。

表5 玉米根毛特异表达基因中的转录因子
2.7 玉米根毛中的可变剪切
可变剪切是调节基因表达和产生蛋白质组多样性的重要机制,是导致真核生物基因和蛋白质数量较大差异的重要原因。使用Trimmomatic V0.32软件去除通用接头,同时截去碱基质量低于30的reads。再用Tophat2将过滤后的reads比对到参考基因组 (ZmB73_RefGen_v3),选择唯一比对位置的reads进行下一步分析。用Diffsplice识别可变剪接事件,根毛与不同组织进行比较,选择-value<0.01的可变剪切事件,作为2个组织不同的差异剪切事件。为了减小偏差,存在非典型剪切位点的转录本和表达丰度较低的转录本被移除,另外比对到非已知基因区域的转录本也被移除。最终,玉米根毛RNA-seq数据分析的结果表明,根毛细胞中存在内含子保留这一可变剪切形式 (图6-A)。
进一步通过PCR试验证明,根毛中存在内含子保留这一可变剪切形式,分别用引物扩增基因和的CDS序列,结果显示在根毛中扩增的CDS序列显著大于根与地上部分扩增的CDS序列,进一步证明了根毛中内含子保留的存在 (图6-B)。

3 结论与讨论
玉米是一种单子叶植物,其根系类型、根毛细胞分化方式等与拟南芥和水稻存在差异,因此推测玉米根毛生长发育可能存在一些不同的调控机制,并且目前对玉米根毛生长发育的研究也非常有限,只报道了几个基因参与玉米根毛的生长发育,因此对玉米根毛的发育调控机制进行深入研究很有必要。
转录组测序能够从整体水平研究基因表达量以及基因结构,揭示特定生物学过程中的分子机制。通常转录组测序的研究对象是某种组织的多种细胞转录出来的mRNA,得到的是多种细胞中信号的平均值。然而单细胞类型转录组测序的研究对象是某种特定细胞的转录信息,获得的基因表达水平更加精确。笔者研究分析了生长3 d的玉米自交系B73根毛单细胞类型的转录组数据,筛选到1 050个在根毛中显著高表达的基因。同时与Hey等发表的玉米根毛转录数据相比较,发现有1 604个基因是相同的,进一步说明笔者根毛转录组数据的准确性,因此,该结果可以为玉米根毛发育分子机制的研究提供非常重要的理论指导。
本研究大量收集生长3 d的玉米自交系B73的根毛,提取根毛RNA,建立RNA-seq文库,进行玉米根毛单细胞类型的转录组分析。通过Illumina Hiseq2500平台进行测序,共得到43.17 Gb数据,每个RNA-seq文库得到约 20~40 million的clean reads。大约85%的clean reads能够比对到玉米基因组 (ZmB73_RefGen_v3),一共得到约23 000个基因。用R package edgeR进行差异表达基因 (DEGs) 分析,鉴定到1 050个基因在玉米根毛特异表达。使用FuncAssociate 3.0对1 050个玉米根毛特异表达基因进行GO富集分析,结果发现这些根毛特异表达基因在细胞组分方面主要参与细胞壁的合成,在分子功能方面主要参与氧化反应及铁离子结合,在分子生物学过程方面主要参与氧化还原反应及应答氧化胁迫过程。细胞壁在根毛的生长过程中发挥了关键作用,其中纤维素是细胞壁的主要组成成分,拟南芥中的() 基因同样编码一种类纤维素合酶,在根毛中的表达量很高,突变体细胞壁中纤维素和木葡聚糖的分布发生紊乱,根毛在刚形成时就发生破裂。() 基因同样编码一种类纤维素合酶,在根毛中的表达量也较高,突变体根毛生长出较小的一部分后就发生破裂。钙离子也是影响根毛生长发育的关键因素之一,Molendijk等研究发现,拟南芥中的小G蛋白 RHO-LIKE GTP BINDING PROTEIN 4 (ROP4) 和RHO-RELATED PROTEIN FROM PLANTS 6 (ROP6) 功能缺失,破坏了正在进行顶端生长的根毛细胞中的钙离子浓度梯度,导致钙离子浓度梯度消失,进而影响了根毛的顶端生长,根毛形态变得肿胀膨大。活性氧是生物体在有氧代谢过程中NADPH氧化酶 (NOXs) 利用氧气作为电子供体产生的一种副产物,活性氧在根毛的生长发育过程中发挥了重要的调节作用,研究发现拟南芥中的() 基因同样编码一种NADPH氧化酶,能将电子从NADPH转移到电子受体,从而形成活性氧,突变体具有根毛短小的表型。
转录因子 (transcription factor,简称TF)能够与下游调控的靶基因启动子区域中的顺式作用元件结合,进而调控靶基因的表达,转录因子在根毛的生长发育过程中发挥重要的作用。对1 050个玉米根毛特异表达基因进行功能注释,筛选到68个转录因子,这些转录因子被划分到19个家族,其中WRKY家族、bHLH家族及ERF家族的转录因子数量最多。WRKY转录因子是植物所特有的一类转录因子,也是最大的一类转录因子。WRKY 转录因子因为N末端具有保守的WRKYGQK序列和锌指结构而命名。拟南芥中() 基因编码WRKY44转录因子,TTG2转录因子能直接调控表达,突变体根毛的生长发生异常。从低等植物到高等植物,bHLH家族转录因子均参与了根毛的生长发育。低等植物小立碗藓 () 中的PpLRL1和PpLRL2转录因子在假根的生长发育过程中发挥了重要的作用。和单突变体假根的数量减少,约为野生型的40%左右,假根的长度也比野生型短,双突变体假根的表型加重,无假根生成。拟南芥bHLH家族中的5个转录因子:AtLRL1~AtLRL5,都参与调控根毛的生长发育。
本研究通过对玉米根毛进行单细胞类型的转录组分析,鉴定到1 050个基因在玉米根毛中特异表达,这些根毛特异表达基因中包含68个转录因子,分析结果还显示,根毛细胞中存在内含子保留这一可变剪切形式。该研究结果能够为后续挖掘与玉米根毛生长发育相关的候选基因提供重要的数据支撑。
