肾原位抑制miR-146b-5p 表达改善UUO 小鼠肾纤维化
2022-03-02谢柯欢郭怀英韩壤乐王丽
谢柯欢郭怀英韩壤乐王丽
(中西医结合研究中心,西南医科大学附属中医医院,四川 泸州 646000)
近年来,以肾间质纤维化为特征的慢性肾病(chronic kidney disease,CKD)发病率显著增加,全球发病率超过10%,其中70 岁以上患者占50%以上,目前尚缺乏有效的临床治疗手段[1]。 深入挖掘CKD 潜在的发病机制,并开发新颖的治疗方法,对于防治CKD 的发生发展至关重要[2]。 microRNA(miRNA) 是一类由内源基因编码的长度约为22 个核苷酸的非编码单链RNA 分子,它们在动植物中广泛参与转录后基因表达调控。 多项研究已证实,miRNA 在包括糖尿病肾病、肾小球病变、肾囊肿和肾癌等多种肾疾病的发生和发展中起调控作用[3]。本课题组前期通过转录组测序,在小鼠UUO 模型中筛选出包括miR-146b-5p 在内的多个miRNA 在肾组织中高表达。 有研究报道,miR-146b-5p 可调节肾细胞癌的发生,阻断其表达可长期负向调节肿瘤生长,但miR-146b-5p 在肾纤维化中的作用和功能未知[4-5]。 电转技术是一种高效的细胞转染技术,其通过脉冲电流在细胞膜上打孔后将目的核酸导入细胞内[6]。 电转不仅用于体外培养细胞的转染,还被广泛用于敲除小鼠的生产、肿瘤治疗、基因治疗和基于细胞的治疗中[7]。 值得注意的是,电转技术已被证明可用于体内组织原位的高效基因转染。为探索miR146b-5p 在肾纤维化中的作用,本研究建立UUO 小鼠模型,观察miR-146b-5p 在小鼠肾纤维化模型中的表达情况,并通过原位电转技术在肾抑制miR-146b-5p 的表达,探讨下调其表达对小鼠肾纤维化的改善作用,为CKD 肾纤维化的防治研究提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级雄性C57BL/6 小鼠24 只,8 周龄,体重22~25 g,购自重庆腾鑫生物有限公司【SCXK(川)2020-030】,饲养于西南医科大学实验动物中心【SYXK(川)2020-065】。 小鼠均自由摄食饮水,环境温度20 ~ 24℃,相对湿度50% ~ 60%,12 h/12 h明暗交替,适应性饲养1 周开始实验。 研究获得西南医科大学动物伦理委员会的批准(2021DW027)。
1.1.2 主要试剂与仪器
TRIzol 试剂(天根生化科技有限公司,Lot#P5207,中国),无内毒素质粒大提试剂盒(天根生化科技有限公司,Lot#W9623,中国),兔抗小鼠α-SMA抗体(proteinch,00096457),兔抗小鼠Gapdh 抗体(Abways,AB0037),兔抗小鼠College-1(Col-1)抗体(Cell Signaling Technology, 4060), 兔抗小鼠Fibronectin(FN)抗体(Abmart,334482)小鼠抗小鼠IL-1β 抗体(Santa cruz,sc-52012)、小鼠抗小鼠IL-6抗体(Santa cruz,sc-32296)、小鼠抗小鼠TNF-α 抗体(Santa cruz,sc-52746)、兔抗小鼠Wnt-5a 抗体(Affinity biosciences,DF-6856),兔抗小鼠β-catenin抗体(Affinity biosciences,AF6266),荧光定量PCR染料试剂(Promega,LS2068),HE 染色试剂盒(Beyotime Biotechnology,C0105),中杉金桥免疫组化试剂盒(ZSGB-BIO,PV-6000),Masson 染色试剂盒(贝索生物公司,BA-40798)。 LightCycle 96 荧光定量PCR 仪(Roche,瑞士),正置光学显微镜(尼康,Nikon Eclipse E100,日本),电泳槽和湿转转膜系统(Bio-Rad, 美国), 质粒电转仪器(Pulse Generator CUYEDITⅡ,美国)。
1.2 方法
1.2.1 动物分组及实验干预
实验分为正常组(WT)、假手术组(sham)、模型组(UUO)和UUO+miR-146b-5p 靶向电转敲低组(UUO-KD),及sham+miR-146b-5p 靶向电转敲低组( KD-1day )、 绿 色 荧 光 质 粒 电 转 组(Electrotransfection)。 假手术组仅切开右侧背部皮肤,暴露且游离右侧肾输尿管,不做结扎或离断处理。 模型组按参考文献[8]建立单侧输尿管梗阻小鼠模型,方法如下:腹腔注射1%戊巴比妥钠成功麻醉小鼠后,在小鼠右侧背部脊柱旁约1 cm 处切开背部皮肤,分离暴露右肾,游离右侧近端输尿管,于靠近肾门处和输尿管下1/3 水平分别以4-0 号丝线结扎输尿管后离断输尿管,缝合腹腔。 UUO-KD 组,首先对小鼠进行质粒注射及肾原位电转操作,24 h后建立单侧输尿管梗阻小鼠模型,具体如下:麻醉小鼠后分离暴露右肾,游离小鼠肾静脉、肾动脉,于近心端处夹闭肾动静脉后,用36 G 针头注入已提取的质粒约100 μL(质粒浓度=1 μg/μL),观察肾膨胀且色泽变苍白,即为注射成功。 将无菌纸剪成约肾面积大小,浸生理盐水湿润后,覆于肾两侧,用电极轻夹住湿无菌纸包裹的肾,观察电阻< 500 Ω 时,即可开始电转(参数:电转电压(Pd V)= 50 V,电转电流(Pd A)= 300 mA,瞬时电转持续时长(Pd on)= 50.0 ms,瞬时电转休息时长(Pd off)= 1000 ms,总电转次数(Pd N)= 4 次。 常规饲养24 h 后,观察状况良好,按模型组构建方法,建立肾间质纤维化模型。 KD-1 day 组仅对小鼠进行质粒注射及肾原位电转操作,Electrotransfection 组仅进行肾原位电转绿色荧光质粒。 造模1 d 或7 d 后处死小鼠,取出手术侧肾组织,将1/4 肾组织置于4%多聚甲醛中固定,用于后期病理染色,剩余肾组织迅速置于-80℃冰箱中冻存,用于提取组织蛋白及RNA。
1.2.2 CRISPR/RfxCas13 d 敲除载体构建
取构建好的质粒10 μL 加入DH5α 感受态细胞,间歇振荡每次5 min,共6 次,置于42℃水浴锅中热激90 s,加入LB 培养基500 μL,于摇床中震摇50 min ( 100 r/min、 37℃), 后 离 心 5 min(3000 r/min),倒掉上清液,留100 μL 进行重悬后铺板于AMP 抗性平板上,倒置培养过夜。 筛选阳性菌株,培养收集菌液,按质粒提取试剂盒要求提取、纯化质粒(sgRNA 序列(5’ →3’):ATGGAATTC AGTTCTCAGAGCCA)。
1.2.3 Real-time PCR 检测各组小鼠肾组织中miR-146b-5p 的表达
取冻存肾组织,TRIzol 法提取肾组织中总RNA,Nanodrop 测定总RNA 浓度。 取1 μg 总RNA,按照逆转录试剂盒说明书操作逆转录合成cDNA。以cDNA 为模板,用miR-146b-5p 引物参照PCR 试剂盒说明书构建PCR 体系后进行PCR 反应,PCR反应条件: 95℃,30 s;95℃,3~10 s;60℃,10~30 s;40 个循环后结束。 以U6 作为miR-146b-5p 的内参基因,GAPDH 作为IL-1β、IL-6、TNF-α、α-SMA 的内参基因。 根据内参表达量检测计算目标基因的相对表达,相对表达量通过2-ΔΔCT法算。 序列见表1。

表1 引物信息Table 1 Information of primers
1.2.4 小鼠肾HE 染色及Masson 染色
HE 染色:将小鼠肾组织取出后用4%多聚甲醛溶液固定48 h,经梯度乙醇脱水,二甲苯透明后,石蜡浸润包埋,并用切片机制备4 μm 切片,行HE 染色,镜下观察肾组织的病理改变。
Masson 染色:染色前对切片进行常规脱腊复水后,铁苏木素染色5 min,水洗,1%盐酸酒精分色,0.5%氨水促黑2 min,水洗,丽春红染色8 ~ 10 min,磷钼酸分色1 ~ 5 min,加入甲苯胺蓝后水洗,1%冰醋酸1 min 后脱水封片,观察镜下肾组织间质纤维化程度。
1.2.5 蛋白免疫印迹法(Western Blot)检测肾组织纤维化相关蛋白表达
采用蛋白印记法检测α 平滑肌肌动蛋白(α-SMA),取肾组织0.1 g 置于裂解液中,并将其置于冰上碾碎,裂解20 ~ 30 min,后离心取上清液,采用考马斯亮蓝测蛋白浓度法,测出蛋白浓度,并将每个样本蛋白浓度调整为10 μg/μL,后加入8 μL,到12% SDS 聚丙烯酰胺凝胶中进行电泳,转膜至PVDF 膜后按1 ∶1000 的稀释比例加入多克隆抗体α-SMA 于4℃孵育过夜,后加入HRP 偶联二抗常温孵育1 h。 加入ECL 显色,凝胶成像分析仪成像,结果以目标蛋白/内参相对灰度值表分析。
1.2.6 小鼠肾组织免疫组化
将小鼠肾组织取出后用4%多聚甲醛溶液固定48 h,经梯度乙醇脱水,二甲苯透明后,石蜡浸润包埋,并用切片机制备4 μm 厚度石蜡切片。 经脱蜡复水,抗原修复后,封闭,滴加多克隆抗体α-SMA、Col-1、FN 并按1 ∶200 稀释比例,4℃过夜,再滴加生物素化二抗,室温敷育15 min,DAB 显色,苏木素复染,流水冲洗反蓝15 min,脱水透明后,封片,镜下观察α-SMA、Col-1、FN 表达。
1.2.7 基于全转录组的miRNA 测序
测序工作由广州基迪奥生物公司完成,提取高质量RNA 后采用Illumina HiSeq 测序仪进行测序。
1.3 统计学分析
采用SPSS 21.0 对数据进行统计分析,计量资料若符合正态分布采用平均值±标准差(±s)表示,若不符合正态分布采用中位数表示。 两组间差异性的比较,服从正态分布且方差齐则采用非配对t检验,方差不齐采用Welch’s 校正非配对t检验。多组间差异性的比较,各组均符合正态分布且方差齐则采用单因素ANOVA 检验,组间多重比较采用LSD 法,各组资料不符合正态分布或方差不齐,采用Kruskal-WallisH检验,若提示组间存在差异,进一步采用独立样本的非参数检验进行组间两两比较,P< 0.05 为差异具有统计学意义。
2 结果
2.1 测序分析UUO 部分miRNA 表达,miR-146b-5p 在UUO 中显著增高
HE 染色结果显示UUO 小鼠较sham 组小鼠肾小管扩张明显,肾小球变形破坏严重,肾间质增宽。免疫组化结果显示UUO 组较sham 组肾间质α 平滑肌肌动蛋白(α-SMA),FN 纤维蛋白沉积显著增多与免疫印记、PCR 结果一致(P< 0.0001)。 采用全转录组测序发现多种miRNA 在UUO 小鼠肾中高表达,其中miR-146b-5p 的上升幅度最为明显,PCR 结果验证miR-146b-5p 在UUO 小鼠体内表达增加与测序结果一致,较sham 组显著增加(P< 0.0001),见图1。
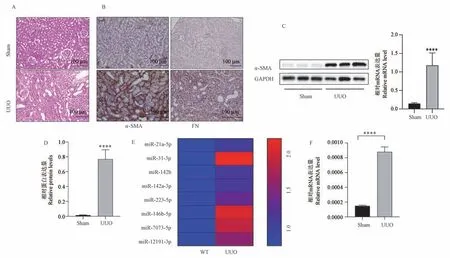
图1 miR-146b-5p 在UUO 小鼠肾中显著增高Note. A. HE staining result. B. Immunohistochemistry result. C. Western Blot result of α-SMA protein. D. PCR result of α-SMA. E. Sequencing result. F. PCR result of miR-146b-5p. Compared with sham group,****P < 0.0001.Figure 1 miR-146b-5p is significantly increased in UUO mice kidney
2.2 原位肾电转效率检测
采用肾原位电转的方式将绿色荧光质粒电转染至肾中,并观察到了大量荧光信号,说明肾原位电转效率高,可为后续miRNA 敲低质粒的原位电转染提供良好的实验基础。 其有效电转参数为:正反向电转模式,电转电压(Pd V)= 50 V,电转电流(Pd A)= 300 mA,瞬时电转持续时长(Pd on)= 50.0 ms,瞬时电转间隔时长(Pd off)= 1000 ms,总电转次数(Pd N)= 2,见图2。

图2 原位肾电转流程Note. A. Schematic diagram of mouse electroporation process. B. Luorescence image of kidney in situ electroporation under light microscope. C.Schematic diagram of CRISPR/RfxCas13 d vector sequence.Figure 2 Process of renal electroporation
2.3 电转抑制miR-146b-5p 对UUO 肾病理改变的影响
正常小鼠肾电转miR-146b-5p 敲低质粒1 d 后,通过Real-time PCR 检测到miR-146b-5p 表达量显著下降(P< 0.01);且电转7 d 后肾功能变化差异无显著性,证实电转不会对肾造成病理损伤。 电转7 d 后,免疫印记结果显示UUO-KD 组α-SMA 蛋白表达显著下降(P< 0.01),且与PCR 结果显示一致(P< 0.001),HE 染色结果及Masson 染色结果显示UUO 组小鼠肾组织中,肾小管明显扩张,肾小球破坏明显,且间质增宽,经电转靶向敲低后,小鼠肾病理损伤显著好转。 且经miR-146b-5p 靶向电转敲低后小鼠肾间质损伤明显减轻,胶原成分减少,间质纤维化面积显著降低,见图3。

图3 电转抑制miR-146b-5p 对UUO 肾病理改变的影响Note. A. One day after electroporation, the PCR results of miR-146b-5p mRNA expression in mouse kidney. B. Urea nitrogen results. C. Creatinine test results. D. Western Blot results of α-SMA, protein quantification results. E. PCR results after electroporation of UUO mice. F. HE staining results. G. Masson staining results. Compared with UUO group,*P < 0.01,**P < 0.001. (The same in the following figures)Figure 3 Effect of electrotransduction inhibition of miR-146b-5p on the pathological changes of UUO kidney
2.4 电转抑制miR-146b-5p 后可降低UUO 小鼠炎症及纤维化改变
UUO-KD 组较UUO 组可显著下调IL-6、TNF-α、IL-1β 炎症指标mRNA 表达量,且差异具有显著性(P< 0.01);免疫组化结果显示:UUO-KD 组较UUO 组肾间质α-SMA、Col-1 沉积显著减少,且肾组织结构完整,损伤轻微,Western Blot 结果发现,UUO组中wnt5a、β-catenin 在蛋白水平上均高表达,UUOKD 组wnt5a、β-catenin 表达均显著下降,说明电转抑制miR-146b-5p 后可显著下调UUO 小鼠炎症及纤维化,见图4。

图4 电转抑制miR-146b-5p 后可降低UUO 小鼠炎症及纤维化改变Note. A. PCR results of inflammation indexes. B. Immunohistochemistry results of α-SMA and Col-1. C. Western Blot results of wnt5a, βcatenin, protein quantification results.Figure 4 Electrotransduction inhibition of miR-146b-5p can reduce inflammation and fibrosis in UUO mice
3 讨论
肾小管间质纤维化是一个慢性进行性的疾病过程,是慢性肾疾病发展为终末期肾病的必经途径,其机制复杂多样。 纤维化是正常伤口愈合过程的病理性扩展,特征为组织损伤及炎症,成纤维细胞活化和迁移以及基质沉积和重塑[8]。 在CKD 的发病过程中,肾小管间质纤维化基质沉积进行性加重,最终破坏器官结构,减少血液供应导致肾衰竭。目对于肾纤维化的治疗及控制,在临床上的进展仍然十分缓慢,除了部分支持治疗可提高患者的生存质量外,尚且缺乏有效的治疗措施。
国内外大量研究表明,microRNA 与多种器官的纤维化相关,且是参与器官纤维化的一个重要成分[9-10]。 microRNA 是小型非编码RNA,具有巨大潜力的生物学功能,参与各种生理和病理过程[11]。且miRNA 介导mRNA 的抑制或去稳定作用,并导致翻译抑制,是基因表达的重要调节剂[12],参与了多种肾疾病的纤维化进程。 本团队通过前期转录组测序筛选出多个miRNA 在肾纤维化UUO 小鼠模型中高表达,通过前期实验验证后发现miR-146b-5p 的表达变化尤为显著。 目前国内外的相关研究已证实miR-146b-5p 参与多种肾病理过程。 研究表明,miR-146b-5p 在狼疮性肾病中激活NF-κB 的表达加重了肾炎症表型[13]。 Ichii 等[14]和Paterson等[15]报道,慢性肾病肾中miR-146b 的表达及其尿液排泄与肾间质病变的发展相关,并与炎症细胞浸润相关,镉肾毒性与大鼠肾皮质miR-146b-5p 的表达改变有密切关系。 然而miR-146b-5p 在肾纤维化中的作用未知。 为此,本团队计划探索miR-146b-5p 在肾纤维化中的作用。 本研究发现,肾纤维化病理状态时,miR-146b-5p 显著升高,电转敲低miR-146b-5p 会明显减轻UUO 模型肾纤维化程度。 这些结果提示miR-146b-5p 可能促进肾纤维化的进程。
为了研究miR-146b-5p 在小鼠肾纤维化中的作用,我们计划采用肾原位转染敲低质粒的方法下调miR-146b-5p 在UUO 小鼠肾中的表达。 目前肾原位转染技术主要包括病毒转染、超声微泡转染、电转染等方法。 其中电转染是目前一种新型基因转染技术,早在1982 年,Neumann 等[16-17]第一次利用电转脂质双分子层理论对小鼠进行基因转染。 电转染是指在外加电场的作用下,使细胞膜具有高通透性,从而将基因导入细胞或组织中的方法,较传统的病毒载体编辑基因的方法具有成本低、效率高、方便安全的优点[18],相比较超声靶向微泡技术而言,超声微泡所需试剂价格昂贵,且超声过程中探头易产热对组织造成二次损伤,加重组织病理损伤改变[19]。 本研究在前期实验中验证了电转染与超声微泡转染技术的转染效率,其中电转染体现了优良的转染效率,特别是在摸索出合适的电转参数后,电转染较超声微泡法的效率高,经HE 染色及肾功能检测后发现经原位电转的肾较模型组比,组织结构完整,形态规则,无明显病理损伤,血肌酐、尿素氮测试显示经电转后,小鼠肾功能与假手术组基本一致,无明显变化,证明经电转后,对小鼠肾无特别损伤。 经过前期摸索测试,我们发现采用电转染法可以成功敲低小鼠肾miR-146b-5p,且明显抑制UUO 小鼠肾小管间质纤维化的病理改变,进而揭示:靶向电转敲低miR-146b-5p 后可抑制miR-146b-5p 的表达从而改善小鼠单侧肾输尿管结扎诱导的肾纤维化。
目前,对于肾纤维化机制及通路的探讨存在多样性,本研究前期我们通过测序发现miR-146b-5p在UUO 小鼠肾中显著增加,并验证了肾纤维化模型中miR-146b-5p 表达结果与前期预测一致,大量研究显示,wnt/β-catenin 信号通路参与肾损伤及各种损伤后的修复,激活肾小管中的wnt/β-catenin 可防止肾小管细胞死亡和AKI 的发生,而肾小管中Wnt/β-catenin 的持续激活可能导致进行性肾纤维化[20-21],通过Western Blot 结果发现,模型组中wnt5a、β-catenin 在蛋白水平上均高表达,经靶向电转敲低后,wnt5a、β-catenin 表达均显著下降,我们猜想miR-146b-5p 可能是通过此机制调控了小鼠肾纤维化的进程及转变,并产生了以α-SMA、Col-1 为标志的纤维化改变,后期我们将在肾小管上皮细胞中下调miR-146b-5p 表达,检测纤维化相关mRNA 的变化,预测其信号通路证实相关的纤维化机制。
综上所述,miR-146b-5p 在小鼠单侧肾输尿管结扎诱导的肾纤维化模型中高表达,肾原位抑制miR-146b-5p 的表达可改善小鼠单侧肾输尿管结扎诱导的肾纤维化。 表明miR-146b-5p 可能是肾纤维化的治疗靶标,从而为肾纤维化的治疗提供新的研究方向。
参考文献(References)
[ 1] Cho MH. Renal fibrosis [J]. Korean J Pediatr, 2010, 53(7):735-740.
[ 2] Ruiz-Ortega M, Rayego-Mateos S, Lamas S, et al. Targeting the progression of chronic kidney disease [J]. Nat Rev Nephrol,2020, 16(5): 269-288.
[ 3] Petrillo F, Iervolino A, Zacchia M, et al. MicroRNAs in renal diseases: a potential novel therapeutic target [J]. Kidney Dis(Basel), 2017, 3(3): 111-119.
[ 4] Meng G, Li G, Yang X, et al. Inhibition of miR146b-5p suppresses CT-guided renal cell carcinoma by targeting TRAF6[J]. J Cell Biochem, 2018, 10: 11-16.
[ 5] Matis S, Recchia AG, Colombo M, et al. MiR-146b-5p regulates IL-23receptorcomplexexpression inchronic lymphocytic leukemia cells [J]. Blood Adv, 2022, 6(20):5593-5612.
[ 7] Kobayashi R, Endo K, Ohmori Y, et al. A novel method of gene transduction tothemurineendometriumusinginvivoelectroporation [J]. J Vet Med Sci, 2017, 79(9): 1573-1577.
[ 8] Humphreys BD. Mechanisms of renal fibrosis [J]. Annu Rev Physiol, 2018, 80: 309-326.
[ 9] Zhao Z, Lin CY, Cheng K. siRNA- and miRNA-based therapeutics for liver fibrosis [J]. Transl Res, 2019, 214: 17-29.
[10] Conserva F, Barozzino M, Pesce F, et al. Urinary miRNA-27b-3p and miRNA-1228-3p correlate with the progression of kidney fibrosis in diabetic nephropathy [ J]. Sci Rep, 2019, 9(1): 11357.
[11] Li ML, Li RN, Ma YM, et al. MiRNA-1297 inhibits myocardial fibrosis by targeting ULK1 [J]. Eur Rev Med Pharmacol Sci,2020, 24(4): 2070-2076.
[12] Fan Y, Chen H, Huang Z, et al. Emerging role of miRNAs in renal fibrosis [J]. RNA Biol, 2020, 17(1): 1-12.
[13] Zhang LH, Xiao B, Zhong M, et al. LncRNA NEAT1 accelerates renal mesangial cell injury via modulating the miR-146b/TRAF6/NF-κB axis in lupus nephritis [J]. Cell Tissue Res, 2020, 382(3): 627-638.
剧场里变得静悄悄的,没有人理睬我,我恐惧地发现,有几个人已经悄悄地拿起了匕首,不知是谁先踏出第一步,这些人已经慢慢地向坐在座位上的人围了起来。
[14] Ichii O, Otsuka S, Sasaki N, et al. Altered expression of microRNA miR-146a correlates with the development of chronic renal inflammation [J]. Kidney Int, 2012, 81(3): 280-292.
[15] Paterson MR, Geurts AM, Kriegel AJ. miR-146b-5p has a sexspecific role in renal and cardiac pathology in a rat model of chronic kidney disease [J]. Kidney Int, 2019, 96(6): 1332-1345.
[16] Neumann E, Schaefer-Ridder M, Wang Y, et al. Gene transfer into mouse lyoma cells by electroporation in high electric fields[J]. EMBO J, 1982, 1(7): 841-845.
[17] Neumann E, Judex M, Kullmann F, et al. Inhibition of cartilage destruction by double gene transfer of IL-1a and IL-10 involves the activin pathway [J]. Gene Ther, 2002, 9(22): 1508-1519.
[18] Qin S,CaskeyCF,FerraraKW.Ultrasoundcontrast microbubbles in imaging and therapy: physical principles and engineering [J]. Phys Med Biol, 2009, 54(6): R27- R57.
[19] Dauba A, Goulas J, Colin L, et al. Evaluation of capacitive micromachined ultrasonic transducers for passive monitoring of microbubble-assisted ultrasound therapies [J]. J Acoust Soc Am, 2020, 148(4): 2248.
[20] Feng Y, Ren J, Gui Y, et al. Wnt/β-catenin-promoted macrophage alternative activation contributes to kidney fibrosis[J]. J Am Soc Nephrol, 2018, 29(1): 182-193.
[21] 严颖, 谭睿陟, 赵长英, 等. 姜黄素对5/6 肾结扎诱导的慢性肾病小鼠模型肾纤维化的保护作用 [J]. 中国实验动物学报, 2019, 27(1): 52-58.Yan Y, Tan RZ, Zhao GY, et al. Protective effect of curcumin on renal fibrosis induced by 5/6 kidney ligation in the mouse model of chronic renal disease [J]. Acta Lab Animalis Sci Sin,2019, 27(1): 52-58.
