高血压和衰老为主要危险因素的脑小血管病动物模型的建立
2022-03-02刘彤彤张熙王枭冶方锐葛金文孟盼
刘彤彤张熙王枭冶方锐葛金文*孟盼*
(1. 湖南中医药大学科技创新中心,长沙 410208;2. 湖南省中医药研究院,长沙 410006;3. 湖南省脑科医院,长沙 410007)
脑小血管病(cerebral small vessel disease,CSVD)是一系列影响脑小血管(包括毛细血管、小动脉和小静脉)结构或功能的神经影像学、病理和相关临床综合征[1]。 据研究统计,CSVD 导致了全球25%的中风及45%的痴呆,且其已成为我国居民首位死因[2]。 流行病学调查显示,69% ~ 75%的中风患者患有高血压[3]。 而长期的高血压是导致颅内小动脉和小静脉管壁增厚的主要因素,可致使管腔直径减小,引起脑内低灌注,进而形成CSVD[4]。研究表明,CSVD 多发于老年群体,是引起老年认知功能障碍的最常见原因之一[5],其中,67.92%的老年CSVD 认知障碍患者患有长期高血压[6]。 近年来,针对CSVD 可能发病机制构建了脑低灌注损伤、微小栓子栓塞、慢性高血压损伤、高脂饮食动脉硬化以及遗传基因突变等CSVD 动物模型。 然而,有关CSVD 的生物学机制至今尚无相关实验研究,仅局限于临床领域[7-8]。 究其根本,是因为缺乏一种可最大限度模拟人类CSVD 临床发病特征的动物模型,且基于某一因素构建的CSVD 动物模型可能与人类疾病状态下的CSVD 存在差异。 目前年龄和高血压被公认为CSVD 的高危因素,且二者并非独立危险因素,而是联合作用导致疾病的发生[8]。 因此,复合动物模型比单一的躯体应激或药物刺激更能模拟CSVD 的临床表征。 本实验拟基于衰老和高血压为主要危险因素,为CSVD 的机制研究构建一种相对可靠的两因素复合动物模型。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级14 周龄雄性SHR 大鼠18 只和WKY 大鼠6 只,体重260 ~ 280 g,由北京维通利华实验动物技术有限公司提供【SCXK(京)2021-0006】,饲养于湖南中医药大学动物会【SYXK(湘)2019-0009】,饲养条件:室温(25 ± 2)℃,光暗周期为12 h/12 h环境中适应性喂养5 d,自由获取饲料与水。 实验经湖南中医药大学实验动物伦理委员会批准(LLBH-202011090001)。
1.1.2 主要试剂与仪器
D-半乳糖(Sigma-Aldrich,V900922),髓鞘染液试剂盒(Servicebio,G1030),T-SOD、GSH-Px、MDA、ALB、NEFL 试剂盒(武汉伊莱瑞特生物科技股份有限公司,E-BC-K020-M、E-BC-K096-M、E-BC-K025-M、E-EL-R0362c、E-EL-R2536c)。 大小鼠智能无创血压计(北京软隆生物技术有限公司,BP-2010A)、多功能酶标仪(Thermo Scientific,MK3)、生物组织包埋机(湖北孝感宏业医用仪器有限公司,BM-I)、生物组织切片机(美国THERMO SCIENTIFIC,HM430)、光学显微镜(德国ZEISS,Stemi 508)、数字玻片扫描系统( 匈牙利 3DHISTECH 公司,Pannoramic MIDI)。
1.2 方法
1.2.1 动物分组及造模
18 只SHR 大鼠随机分为3 组:D-半乳糖(Dgalactose,D-gal)150 mg/(kg·d) + 4 周组、D-gal 150 mg/(kg·d) + 8 周组、D-gal 150 mg/(kg·d) +12 周组,另设WKY 组作为对照。 每组6 只。
SHR 大鼠背部皮下注射D-gal 150 mg/(kg·d)4 周、8 周、12 周,建立以衰老和高血压为危险因素的CSVD 大鼠模型(D-gal 注射液浓度为80 mg/mL)。 WKY 大鼠背部皮下注射0.9% NaCl。
1.2.2 大鼠鼠尾血压监测
每周测量SHR 大鼠和WKY 大鼠收缩压、舒张压。 血压测量采用大小鼠智能无创血压计测量大鼠鼠尾血压,每次血压测量时间相对固定(8:00 ~14:00)。 在5 min 内,重复测量5 次,舍去离群值,取剩余数值均数作为血压测量值。 每次血压测量均保证测量数据的可重复性和可对照性。
1.2.3 大鼠一般情况观察
每天观察记录大鼠体重及注射D-半乳糖后饮食、活动、毛色等情况。
1.2.4 Morris 水迷宫检测
造模结束后,对各组大鼠进行水迷宫学习训练。 从同一位置将大鼠面壁放入水中,若1 min 未找到平台,则将其牵引至平台处停留20 s,学习持续4 d。 于第5 天将大鼠从平台正对的象限处面壁放入后,记录其在2 min 内爬上平台的时间,即逃避潜伏期;第6 天撤除平台,由同一入水点将大鼠面壁放入水中,记录其2 min 内在目标象限的游动时间和目标象限的潜伏时间。
1.2.5 脏器指数检测
大鼠麻醉后,完整剥离出脑组织、胸腺、脾、肝组织,见图1。 称取脏器质量,计算脑指数、胸腺指数、脾指数、肝指数。 各脏器指数=脏器重量(mg)/体重(g)。

图1 大鼠的脑组织、胸腺、脾、肝Figure 1 Brain tissue, thymus, spleen and liver of rats
1.2.6 ELISA 法检测各组大鼠血清中T-SOD、GSHPx、MDA、NEFL 含量及CALB/SALB 指数
大鼠麻醉后,腹主动脉采集血液,3000 r/min 离心15 min 后取上清。 根据比色试剂盒中的说明书进行操作,检测各组大鼠血清中T-SOD、GSH-Px、MDA、NEFL、脑脊液/血清白蛋白(CALB/SALB)含量变化。
1.2.7 脑组织病理检测
HE 染色:取4%多聚甲醛固定的脑组织,包埋,4 μm 切片后进行染色。 脱蜡、复水、苏木素染色、盐酸乙醇分化、伊红复染、无水乙醇脱水、二甲苯透明,中性树胶封片。 玻片晾干后,显微镜下观察各组大鼠脑组织病理变化。
LFB 染色:取4 μm 脑组织石蜡切片,根据髓鞘染液试剂盒说明书进行操作。 脱蜡、水化、染色、分化、脱水、透明,中性树胶封片。 玻片晾干后,显微镜下观察各组大鼠脑组织髓鞘损伤情况。
1.3 统计学分析
采用SPSS 20.0 统计软件进行统计分析,计量资料采用平均值±标准差(±s)表示,组间比较采用单因素方差分析,组间多重比较采用LSD 和Dunett 法,以P< 0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况观察
实验过程中发现,SHR 大鼠连续背部皮下注射D-半乳糖后,随着注射时间的增加,大鼠毛色失去光泽,变得灰暗杂乱、行动缓慢、饮食量减少、精神萎靡不振、体重增长幅度减小(见表1)。

表1 各组大鼠体重变化Table 1 Changes of weight of rats in each group
2.2 各组大鼠学习记忆能力变化
与WKY 组比较,D-gal 150 mg/(kg·d) + 8、12周组大鼠逃避潜伏期和目标象限潜伏期明显延长,在目标象限的游动时间显著缩短(P< 0.05,P<0.01)。 即随着D-gal 注射时间的增加,大鼠的学习记忆能力下降,认知功能发生障碍(见图2,3)。

图2 各组大鼠逃避潜伏期、目标象限游动时间和目标象限潜伏期Note. Compared with WKY group,*P < 0.05,**P < 0.01.Figure 2 Escape latency, retention time in target quadrant and target quadrant latency of rats in each group
2.3 各组大鼠血压变化
与WKY 组比较,各模型组大鼠收缩压和舒张压均显著升高(P< 0.05,P< 0.01),其中,随着Dgal 注射时间的增加,大鼠的收缩压和舒张压均有不同程度的上升(见图4)。
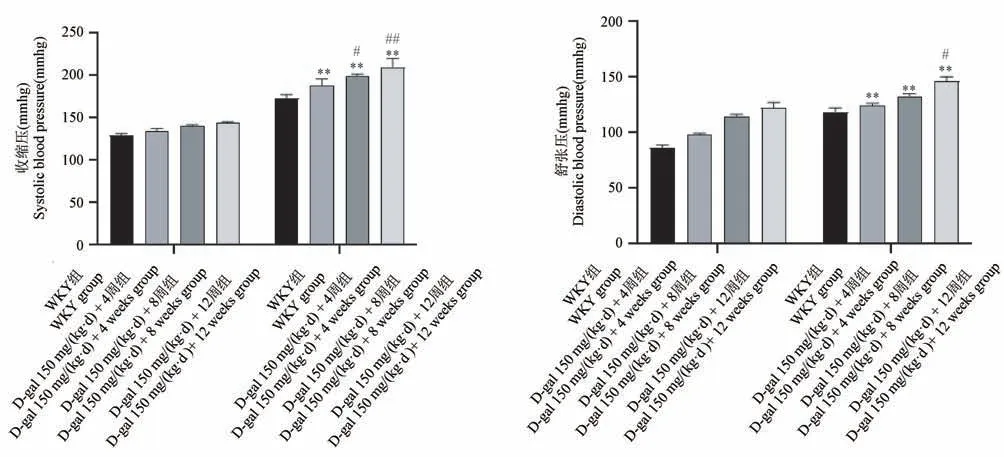
图4 各组大鼠血压变化Note. Compared with WKY group,*P < 0.05,**P < 0.01. Compared with D-gal 150 mg/(kg·d) 0 weeks,#P < 0.05,##P < 0.01. (The same in the following figures)Figure 4 Changes of blood pressure in each group

图3 各组大鼠水迷宫游动轨迹图Note. A. WKY group. B. D-gal 150 mg/(kg·d) + 4 weeks group. C. D-gal 150 mg/(kg·d) + 8 weeks group. D. D-gal 150 mg/(kg·d) +12 weeks group. Upper left quadrant is target quadrant.Figure 3 Swimming track of morris water maze of rats in each group
2.4 各组大鼠脏器指数变化
随着D-gal 注射时间的增加,各组大鼠的脑指数、胸腺指数、脾指数、肝指数下降。 其中,与WKY组比较,D-gal 150 mg/(kg·d) + 8、12 周组大鼠的脑指数、胸腺指数、脾指数、肝指数的降低具有显著性(P< 0.05,P< 0.01)(见图5)。

图5 各组大鼠脑指数、胸腺指数、脾指数、肝指数变化Figure 5 Changes of brain index, thymus index, spleen index and liver index in each group
2.5 各组大鼠血清中T-SOD、GSH-Px、MDA、NEFL 含量以及CALB/SALB 指数变化
与WKY 组比较,D-gal 150 mg/(kg·d) + 8、12周组大鼠血清中T-SOD、GSH-Px 含量明显下降(P< 0.05,P< 0.01);MDA、NEFL 含量和CALB/SALB比值显著上升(P< 0.05,P< 0.01)(见图6)。

图6 各组大鼠血清中T-SOD、GSH-Px、MDA、NEFL 含量及CALB/SALB 指数变化Figure 6 Contents of T-SOD, GSH-Px, MDA, NEFL and CALB/SALB index in serum of rats in each group
2.6 各组大鼠脑组织病理变化
镜检脑组织病理切片可见,WKY 组大鼠的前额皮质细胞形态呈现正常圆球形、细胞核轮廓清晰,三脑室背侧无明显微出血状况,胼胝体区域髓鞘结构清晰完整;而各模型组造模后随着时间的增加,大鼠前额皮质细胞形态变化为锥形、核固缩;三脑室背侧出现大量微出血状况;血管周围间隙增大;胼胝体发生不同程度的髓鞘结构疏松,并伴空泡样改变。 其中D-gal 150 mg/(kg·d) + 12 周组大鼠脑组织损伤与WKY 相比最为显著(见图7)。

图7 各组大鼠脑组织病理变化Note. Ⅰ. Morphological changes of prefrontal cortex cells. Ⅱ. Changes in dorsal blood loss of the third ventricle. Ⅲ. Expansion of perivascular space. Ⅳ. Injury of myelin sheath in corpus callosum.Figure 7 Pathological changes of brain tissue in each group
3 讨论
CSVD 是老年人中常见的一种慢性脑血管疾病,临床上常表现为脑白质高信号、腔隙性脑梗死、近期皮质下小梗死、血管周围间隙扩大、脑微出血及脑萎缩等影像学特征,具有起病隐匿、早期症状不典型、易被忽视等特点,一旦发展为痴呆或中风将不可逆[9]。 然而,CSVD 动物模型的建立尚未统一,严重阻碍了CSVD 研究进程。 因此,建立简便、可靠、稳定的CSVD 动物模型,对于研究CSVD 的发病机制及临床诊疗具有重要意义。
SHR 大鼠可在自然条件下产生高血压状态且其病理生理改变与人类原发性高血压病极度相似[10]。 D-半乳糖可通过氧化应激导致脑部细胞结构发生改变,使模型近似于人类自然衰老或产生相近的生理生化功能改变[11]。 本实验以SHR 大鼠为研究对象,背部皮下注射D-半乳糖诱导SHR 大鼠衰老,基于衰老和高血压为主要危险因素建立CSVD 动物模型,可最大程度模拟人类CSVD 认知障碍、轻度卒中等临床表征。
Morris 水迷宫是一种检测大鼠学习记忆能力的经典行为学考察,能系统全面地考察动物空间认知功能[12]。 临床研究表明,CSVD 患者发生认知功能障碍的概率极高。 本实验对各组模型大鼠进行水迷宫测试,结果显示,随着D-半乳糖时间的增加,大鼠神经功能损伤加重,学习记忆能力下降,其中以D-半乳糖150 mg/(kg·d)注射12 周的SHR 大鼠认知障碍最显著。
脑是人体最复杂的器官,可调节人体多种重要生理功能;胸腺和脾是中枢免疫器官,为免疫反应提供重要场所;肝是机体最重要的代谢器官之一,随着年龄的增长,各器官结构和生理功能发生改变,如体积缩小、功能紊乱等[13]。 本实验结果显示,D-半乳糖可降低SHR 大鼠的脑指数、胸腺指数、脾指数和肝指数,且随着D-半乳糖注射时间的增加,各脏器指数逐渐下降,其中以D-半乳糖150 mg/(kg·d)注射12 周的SHR 大鼠脏器指数的降低最显著。
氧化应激损伤发生在衰老过程中, T-SOD、GSH-Px 可调节机体的氧化和抗氧化平衡,而MDA可间接反映脂质过氧化程度[14]。 氧化应激被认为是CSVD 的主要病理机制之一[15]。 研究表明,脂质过氧化产物CSVD 患者血浆中的含量显著高于正常人群[16],且氧化应激标志物与CSVD 认知功能损伤密切相关,随着认知功能损伤的加重,血清中TSOD、GSH-Px 等水平明显降低[17]。 本实验结果显示,D-半乳糖可诱发SHR 大鼠氧化应激,引起TSOD、GSH-Px 水平下降和MDA 水平升高,且随着D-半乳糖注射时间的增加,大鼠氧化损伤加重,其中以D-半乳糖150 mg/(kg·d)注射12 周的SHR大鼠氧化损伤最显著。
血脑屏障损伤是CSVD 的始动病理环节。Zhang 等[18]利用动态增强磁共振检测CSVD 血脑屏障渗透率发现,CSVD 患者血脑屏障渗透率增强区域多,面积广,且其通透性随白质高信号程度的增加而增加。 血脑屏障损伤程度一般以脑脊液白蛋白与血清白蛋白的比值(cerebrospinal fluidalbumin/serumalbumin,CALB/SALB)变化来评价,比值越大,提示血脑屏障损伤越严重[19]。 轻肽神经丝蛋白(neurofilament light,NEFL)主要存在于轴突白质中,可维持神经细胞形态和促进髓鞘轴突再生。 研究表明,颅脑损伤患者血清中NEFL 水平显著高于正常组[20],而损伤后血清中NEFL 含量的增加可能是由持续的血脑屏障破坏引起的[21]。 本实验结果显示,给予D-半乳糖注射的SHR 大鼠,随着注射时间的增加,CALB/SALB 比值逐渐增大,血清中NEFL水平上升,其中以D-半乳糖150 mg/(kg·d)注射12 周的SHR 大鼠CALB/SALB 比值和NEFL 水平变化最显著。
脑微出血、血管周围间隙扩大以及白质高信号是CSVD 的重要表现。 脑微出血是指血管周围少量含铁血黄素沉积引起脑实质损伤。 研究表明,脑深部出现微出血病灶与高血压相关,且其发生率随着年龄增长而增加[22]。 Renard 等[23]和Lyu 等[24]将研究对象按照不同年龄和高血压水平分组,通过比较各组微出血病灶数量,进一步证实,高血压和高龄是影响脑微出血的重要因素。 血管周围间隙扩大是CSVD 的早期影像学标志之一,与年龄密切相关[25]。 研究显示,老年人群较青年人的血管腔更细,慢性脑缺血和血管周围间隙扩大的发生率更高[26]。 Zhang 等[27]证实随着年龄的增加,高血压等基础疾病可加速小血管老化过程,促进血管周围间隙扩大。 脑白质高信号分布于脑室周围、胼胝体、深部和皮层下白质,与脱髓鞘、脑内低灌注等病理相关[28]。 纵向研究显示,随着年龄增长,脑白质高信号风险增加,CSVD 患病率升高[29]。 此外,高血压患者易发生脑内低灌注,并促使少突胶质细胞功能异常,引起广泛脱髓鞘,从而导致脑白质病变[30]。本实验病理结果显示,给予D-半乳糖注射的SHR大鼠,随着注射时间的增加,大鼠前额叶皮质细胞死亡数量增多,血管周围间隙扩大,脑室微出血严重,胼胝体区髓鞘空泡化加重,其中以D-半乳糖150 mg/(kg·d)注射12 周的SHR 大鼠脑组织病变最显著。
综上所述,采用SHR 大鼠注射D-半乳糖150 mg/(kg·d) 12 周的方法可复制与人类CSVD 疾病状态较相似的动物模型,为人类CSVD 机制的进一步研究奠定基础。
参考文献(References)
[ 1] Pinter D, Ritchie SJ, Doubal F, et al. Impact of small vessel disease in the brain on gait and balance [J]. Sci Rep, 2017, 7:41637.
[ 2] Uiterwijk R, van Oostenbrugge RJ, Huijts M, et al. Total cerebral small vessel disease MRI score is associated with cognitive decline in executive function in patients with hypertension [J]. Front Aging Neurosci, 2016, 8: 301.
[ 3] Lorius N, Locascio JJ, Rentz DM, et al. Vascular disease and risk factors are associated with cognitive decline in the Alzheimer disease spectrum [J]. Alzheimer Dis Assoc Disord, 2015, 29(1): 18-25.
[ 4] 刘春燕, 李勇, 唐茜茜. 脑小血管病患者认知功能障碍与H型高血压及脑血流动力学相关性分析 [J]. 神经损伤与功能重建, 2021, 16(2): 86-89.Liu CY, Li Y, Tang QQ. Correlation analysis of cognitive impairment of cerebral small vessel disease and H-type hypertension and cerebral hemodynamics [J]. Neural Inj Funct Reconst, 2021, 16(2): 86-89.
[ 5] 陈玮琪, 潘岳松, 陈霞, 等. 脑小血管病治疗药物临床试验设计规范专家共识 [J]. 中国卒中杂志, 2021, 16(3): 288-297.Chen WQ, Pan YS, Chen X, et al. Design specifications for clinical trials of testing drugs for cerebral small vessel disease: a consensus statement [J]. Chin J Stroke, 2021, 16(3): 288-297.
[ 6] 计畅, 杨云红, 刘彬. 影响老年脑小血管病患者发生认知功能障碍的危险因素分析 [J]. 中国老年保健医学, 2020, 18(1): 44-47.Ji C, Yang YH, Liu B. Risk factors affecting cognitive impairmentin patients with cerebral small vessel disease [J].Chin J Geriatr Care, 2020, 18(1): 44-47.
[ 7] 崔明愚, 王丽娟, 刘荧, 等. 近期皮质下小梗死患者的磁敏感血管征与脑小血管病的相关性研究 [J]. 中华老年心脑血管病杂志, 2022, 24(4): 347-350.Cui MY, Wang LJ, Liu Y, et al. Association between susceptibility vessel sign and cerebral small vessel disease in patients with recent small subcortical infarction [J]. Chin J Geriatr Heart Brain Vessel Dis, 2022, 24(4): 347-350.
[ 8] 吴睿, 甄娜, 王欣丽, 等. 老年脑小血管病患者认知障碍发生率及影响因素分析 [J]. 中国神经免疫学和神经病学杂志, 2022, 29(2): 89-92, 97.Wu R, Zhen N, Wang XL, et al. Analysis of incidence and influencing factors of cognitive impairment in elderly patients with cerebral small vessel disease [J]. Chin J Neuroimmunol Neurol,2022, 29(2): 89-92, 97.
[ 9] 中华医学会老年医学分会老年神经病学组, 脑小血管病认知功能障碍诊疗指南中国撰写专家组. 脑小血管病相关认知功能障碍中国诊疗指南(2019) [J]. 中华老年医学杂志,2019, 38(4): 345-354.Geriatric Neurology Group, Chinese Society of Geriatrics;Clinical Practice Guideline for cognitive impairment of cerebral small vessel disease writing group. Clinical practice guideline for cognitive impairment of cerebral small vessel disease of China(2019) [J]. Chin J Geriatr, 2019, 38(4): 345-354.
[10] 夏晓莉. 自发性高血压大鼠代谢综合征动物模型的建立及其特征分析 [A]. 2011 中国医师协会中西医结合医师分会学术会议论文汇编 [C]; 2011.Xia XL. Establishment and characteristic analysis of metabolic syndrome animal model in spontaneously hypertensive rats [A].2011 chinese medical doctor association integrated traditional Chinese and Western medicine branch academic conference papers [C]; 2011.
[11] Kong SZ, Li JC, Li SD, et al. Anti-aging effect of chitosan oligosaccharide on d-galactose-induced subacute aging in mice[J]. Mar Drugs, 2018, 16(6): 181.
[12] Bromley-Brits K, Deng Y, Song W. Morris water maze test for learning and memory deficits in Alzheimer’s disease model mice[J]. J Vis Exp, 2011,53: 2920.
[13] Kim IH, Xu J, Liu X, et al. Aging increases the susceptibility of hepatic inflammation, liver fibrosis and aging in response to highfat diet in mice [J]. AGE, 2016, 38(4): 291-302.
[14] Lin L, Zhu Q, Zhao M, et al. Purification of peptide fraction with antioxidant activity fromMoringaoleiferaleaf hydrolysate and protective effect of itsinvitrogastrointestinal digest on oxidatively damaged erythrocytes [J]. Int J Food Sci Technol, 2019, 54(1): 84-91.
[15] Litak J, Mazurek M, Kulesza B, et al. Cerebral small vessel disease [J]. Int J Mol Sci, 2020, 21(24): 9729.
[16] Bir LS,DemirS,RotaS,etal.Increasedserum malondialdehyde levels in chronic stage of ischemic stroke [J].Tohoku J Exp Med, 2006, 208(1): 33-39.
[17] 王雅楠, 姚琳, 毛文静, 等. 脑小血管病患者氧化应激标志物、磁共振总负担与血管性认知障碍的相关性 [J]. 中华行为医学与脑科学杂志, 2020, 29(10): 898-903.Wang YN, Yao L, Mao WJ, et al. Association of oxidative stress markers and MRI overall burden with vascular cognitive impairment in patients with ischemic cerebral small-vessel diseases [J]. Chin J Behav Med Brain Sci, 2020, 29(10): 898-903.
[18] Zhang CE, Wong SM, van de Haar HJ, et al. Blood-brain barrier leakage is more widespread in patients with cerebral small vessel disease [J]. Neurology, 2017, 88(5): 426-432.
[19] 顾可梁. 脑脊液检查的几个新问题 [J]. 临床检验杂志,1998, 16(3): 187-188.Gu KL. Several new problems in cerebrospinal fluid examination[J]. J Clin Lab Sci, 1998, 16(3): 187-188.
[20] 李全春. 血清神经丝蛋白轻链多肽水平预测急性颅脑损伤患者临床预后的研究 [J]. 神经损伤与功能重建, 2019, 14(2): 104-106.Li QC. Study on the level of serum neurofilament protein light chain polypeptide in predicting the clinical prognosis of patients with acute craniocerebral injury [ J]. Neural Inj Funct Reconstruct, 2019, 14(2): 104-106.
[21] 吴纪霞, 温振东, 梁友宝, 等. 血清神经丝蛋白轻链对卒中后认知障碍的临床意义 [J]. 蚌埠医学院学报, 2021, 46(9): 1187-1191.Wu JX, Wen ZD, Liang YB, et al. Clinical significance of serum neurofilament protein light chain on post-stroke cognitive impairment [J]. J Bengbu Med Coll, 2021, 46(9): 1187-1191.
[22] Poels MMF, Vernooij MW, Ikram MA, et al. Prevalence and risk factors of cerebral microbleeds: an update of the Rotterdam scan study [J]. Stroke, 2010, 41: S103-S106.
[23] Renard D, Tatu L, Thouvenot E. Infratentorial cerebral microbleeds in patients with cerebral amyloid angiopathy [J]. J Stroke Cerebrovasc Dis, 2018, 27(9): 2534-2537.
[24] Lyu L, Shen J, Zeng C, et al. Cerebral microbleeds are associated with blood pressure levels in individuals with hypertension [J]. Clin Exp Hypertens, 2020, 42(4): 328-334.
[25] Wardlaw JM, Benveniste H, Nedergaard M, et al. Perivascular spaces in the brain: anatomy, physiology and pathology [J]. Nat Rev Neurol, 2020, 16(3): 137-153.
[26] Brown R, Benveniste H, Black SE, et al. Understanding the role of the perivascular space in cerebral small vessel disease [J].Cardiovasc Res, 2018, 114(11): 1462-1473.
[27] Zhang C, Chen Q, Wang Y, et al. Risk factors of dilated Virchow-Robin spaces are different in various brain regions [J].PLoS One, 2014, 9(8): e105505.
[28] Fowler JH, McQueen J, Holland PR, et al. Dimethyl fumarate improves white matter function following severe hypoperfusion:involvement of microglia/macrophages andinflammatory mediators [J]. J Cereb Blood Flow Metab, 2018, 38(8): 1354-1370.
[29] Basile AM, Pantoni L, Pracucci G, et al. Age, hypertension,and lacunar stroke are the major determinants of the severity of age-related white matter changes. The LADIS (Leukoaraiosis and Disability in the Elderly) Study [J]. Cerebrovasc Dis, 2006, 21(5-6): 315-322.
[30] 陈亚丽, 刘红霞, 王娟, 等. 替米沙坦联合瑞舒伐他汀对老年高血压患者脑白质损害的影响 [J]. 中华老年心脑血管病杂志, 2018, 20(2): 145-148.Chen YL, Liu HX, Wang J, et al. Effect of telmisartan combined with rosuvastatin on white matter lesion in elderly hypertensive patients [J]. Chin J Geriatr Heart Brain Vessel Dis, 2018, 20(2): 145-148.
