苓术菟丝子丸抑制IKKβ/NF-κB/MCP-1 通路减少阿霉素诱导的大鼠肾性蛋白尿
2022-03-02龙雯明瑶李茗西沈宏春
龙雯明瑶李茗西沈宏春*
(1.西南医科大学中西医结合学院,四川 泸州 646000;2.西南医科大学附属中医医院内分泌科,四川 泸州 646000;3.西南医科大学附属中医医院肾病科,四川 泸州 646000)
慢性肾病(CKD)是全球性公共卫生问题[1]。其患病群体庞大,且在全球造成的生命损失仍在逐年增加[2]。 不但给患者带来疾病困扰,给社会造成的经济负担更加不容小觑,尤其在发展中国家[3]。肾性蛋白尿几乎是所有类型CKD 的共同临床表现[4],伴随炎症反应[5],表现为炎症因子IL-6、TNFα、CRP 及MCP-1 增多[4,6-7],与NF-κB 通路激活密切相关[4,8]。 目前临床治疗CKD 的西药疗效常常受限,因此中国医学的独特优势值得我们深入挖掘和发扬。 中医认为蛋白尿的本质为“脾肾亏虚,精微不固”[9],治当补肾固精,且此法指导临床收效明显[10]。 苓术菟丝子丸作为该法代表方。 本文意在探究其对肾性蛋白尿的影响。 同时基于NF-κB 探究其发挥作用的可能机制。 以期为祖国医学补肾固精法减少CKD 蛋白尿提供部分实验支撑。
1 材料与方法
1.1 材料
1.1.1 实验动物
36 只6~8 周龄SPF 级雄性SD 大鼠(210 ~240 g)。 采购并饲养于西南医科大学实验动物中心【SCXK(川)2018-17】、【SYXK(川)2018-065】。 水和食物充足,昼夜各半交替。 环境温度19 ~ 22℃,湿度45% ~ 60%。 适应性饲养1 周。 实验获西南医科大学实验动物伦理中心审批(201903-210)。
1.1.2 主要试剂与仪器
盐酸阿霉素(纯度≥98%,索莱宝,D8740,中国北京);PDTC(纯度>99%,碧云天,S1809,中国北京)。 苓术菟丝子丸原方组成[11]:莲肉(四两)、盐杜仲(三两)、盐菟丝子(十两)、茯苓(四两)、白术(四两)、人参(二两)、山药(二两)、五味子(二两)、炙甘草(五钱)。 灌胃药物为免煎颗粒(四川新绿色药业科技发展有限公司,中国成都)。 IL-6、TNF-α ELISA 试剂盒(Cloud-clone:SEA079Ra 中国武汉、SCA133Ra 美 国)。 NF-κB 抗 体(CST,8242 T,美国); p-NF-κB、 IKKβ、 p-IKKβ、 NPHS2、 Nephrin、MCP-1 抗体(Abcam:ab86299、ab124957、ab59195、ab50339、ab216341、ab7202,英国);GAPDH 抗体(Thermo Fisher Scientific,MA5-15738,美国)。 电泳、 转 膜 仪(Bio-Rad: Mini PROTEAN ® Tetra System,美国);石蜡切片机(Leica:RM2245,德国)。
1.2 方法
1.2.1 动物分组与阿霉素肾病模型构建
共分6 组,每组6 只。 苓术菟丝子丸低、中、高剂量组(阿霉素+苓术菟丝子丸);PDTC 组(阿霉素+PDTC);空白组(蒸馏水);模型组(阿霉素+蒸馏水)。 模型和药物干预组大鼠用阿霉素造模。 经尾静脉先后2 次(分别按4 mg/kg、2 mg/kg,间隔1 周)注射阿霉素[12-13]。 造模后,每周监测24 h 尿蛋白。 以正常组和其余组尿蛋白定量存在差异(P< 0.05)为造模成功的标志[14]。 本实验于第2 次尾静脉注射后1 周造模成功。 造模及实验过程中,各组动物无死亡。
1.2.2 实验干预
造模成功后干预6 周。 大鼠给药量按人-大鼠体表面积折算系数换算。 换算后免煎颗粒的1、2、4倍分别作为低、中、高剂量组(14、28、56 g/kg),灌胃前30 min 用蒸馏水将免煎颗粒制成混悬液,水量按3 mL/只计算,1 日1 次。 PDTC 组腹腔注射给药,按100 mg/kg 计算,1 日1 次。 PDTC 组另在2 次造模前1 h 预给药,剂量同前。 空白、模型组蒸馏水灌胃,水量和频率同前。
1.2.3 记录大鼠一般状态
观察精神状态、摄食饮水情况。 测量并记录体重。 观察比较肢体水肿等情况。
1.2.4 标本采集与检测
大鼠24 h 尿液收集:禁食不禁饮情况下,将其置于代谢笼1 昼夜。 血液肾标本收集:1%戊巴比妥钠麻醉大鼠,采血针连负压管行腹主动脉采血。 部分血清、肾冻存于-80℃;4%多聚甲醛、2.5%戊二醛固定肾。 尿液及部分血液标本送西南医科大学附属中医医院检验科,测24 h 尿蛋白、BUN、Scr、CRP和Alb。
1.2.5 各组大鼠肾病理学改变
多聚甲醛固定肾组织24 h,冲水过夜。 先经乙醇、二甲苯处理。 然后浸蜡、包埋成石蜡块。 切片、脱蜡、复水后,按文献及说明书做HE[15]、Masson、PAS 染色。 封片后光镜观察并拍照。 透射电镜标本制作参见[16]。
1.2.6 ELISA 检测血清IL-6、TNF-α
按说明书稀释标准品制作标准曲线,然后每孔加入100 μL 血清样品,按说明书进行孵育洗板显色操作。 终止反应后用酶标仪测IOD 450 的值,最后计算分析。
1.2.7 Western Blot 检测肾IKKβ/NF-κB/MCP-1通路蛋白及足细胞标志蛋白水平
先将肾组织提取的蛋白液变性备用。 每梳孔加入蛋白样品电泳后转膜。 将膜封闭后一抗过夜。 次日孵育二抗、显影拍照。 最后用Image J 定量统计。
1.3 统计学分析
用SPSS 23.0 进行ANOVA 单因素方差分析,采用LSD 方法进行组间比较,定量资料用平均值±标准差(±s)表示,P<0.05 为差异具有显著性。 用GraphPad Prism 8 作图。
2 结果
2.1 苓术菟丝子丸改善阿霉素肾病大鼠一般生命体征
空白组大鼠体征无异常。 模型组大鼠精神困倦、食少迟钝。 眼眶、鼻、牙龈及消化道均有出血表现,毛发干枯脱落,腹部鼓胀、后肢水肿,日渐消瘦。给药组大鼠除高剂量组外病情缓解;状态良好,纳食可,反应迅速,无出血表现,毛发光滑浓密,腹部无鼓胀,后肢水肿减轻。 大鼠体重记录见图1。
由图1 知,药物干预第0 周,大鼠体重无差异。随药物干预时间延长,给药组大鼠体重持续增长。模型组无增长。 第2 周时,模型组大鼠体重轻于其他组,差异有统计学意义(P< 0.05)。 第4、6 周时体重差异明显(P< 0.01)。 表明苓术菟丝子丸改善阿霉素肾病大鼠一般生命体征,保持体重增长。

图1 各组大鼠体重记录Note. Compared with the model group,*P < 0.05,**P < 0.01.(The same in the following figures)Figure 1 Body weight records of rats in each group
2.2 苓术菟丝子丸使阿霉素肾病大鼠尿蛋白丢失减少,血浆白蛋白升高
2.2.1 苓术菟丝子丸减少阿霉素肾病大鼠24 h 尿蛋白
第2 次尾静脉注射后1 周,各组24 h 尿蛋白较空白组显著升高(P< 0.01),此时计为药物干预第0 周(图2A)。 药物干预6 周后,给药组24 h 尿蛋白显著降低(P< 0.01)(图2B)。 提示阿霉素肾病大鼠尿蛋白丢失被苓术菟丝子丸部分逆转。 给药后,Scr、BUN(图2C,2D)较模型组降低,差异无统计学意义。
2.2.2 苓术菟丝子丸升高阿霉素肾病大鼠血浆白蛋白
图2E 为血浆白蛋白。 模型组显著低于正常组(P< 0.01),药物干预后血浆白蛋白较模型组明显升高(P< 0.01)。 提示阿霉素肾病大鼠血浆白蛋白降低,可被苓术菟丝子丸缓解。

图2 大鼠肾功能相关检测Note.Compared with the blank group, ##P<0.01. (The same in the following figures)Figure 2 Detection of renal function in rats
2.3 苓术菟丝子丸使阿霉素肾病大鼠肾病变减轻
2.3.1 HE 染色
空白组肾未见异常改变。 模型组肾小管肿胀挤压变形,边界融合界限不清,小管间质炎性细胞浸润。 肾小球皱缩塌陷,球囊粘连。 中剂量组和PDTC 组,小管改善明显,炎性细胞浸润减少,小球结构清晰。 低剂量组小管病变部分改善,少量蛋白管型。 高剂量组无明显改善(图3)。

图3 大鼠肾HE 染色Figure 3 HE staining of kidneys in rats
2.3.2 Masson 染色
空白组未见异常。 模型组肾小球肾小管均见大量纤维蓝染,且小球小管结构严重破坏。 与模型组相比,低、中剂量组纤维化程度明显减轻,PDTC组纤维化部分减少。 高剂量组改善不明显(图4)。

图4 大鼠肾Masson 染色Figure 4 Masson staining of kidneys in rats
2.3.3 PAS 染色
空白组未见异常。 模型组血管袢紊乱增厚,基底膜明显增厚,小管间可见大量细胞外基质沉积伴炎性细胞弥漫分布。 低、中剂量组和PDTC 组,肾小球血管袢清晰而薄,基底膜正常,管间边界清晰协调。 高剂量组基本无改善(图5)。

图5 大鼠肾PAS 染色Figure 5 PAS staining of kidneys in rats
2.3.4 透射电镜
空白组无异常。 模型组呈典型微绒毛改变,足细胞足突融合。 伴足细胞剥落,足细胞数量减少。PDTC 组足突未见明显融合。 低剂量组毛细血管襻开放,足突部分融合。 中剂量组,足突清晰可见,少量融合。 高剂量组足突融合无改善(图6)。
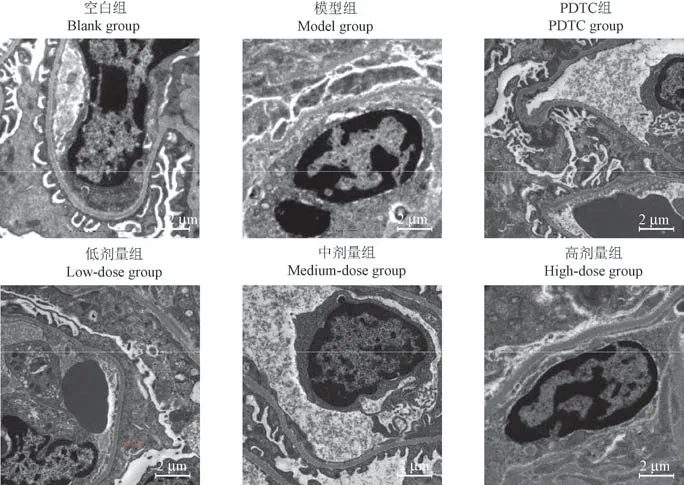
图6 大鼠肾电镜图Figure 6 Electron microscopic pictures of kidneys in rats
2.4 苓术菟丝子丸使循环炎症因子减少
模型组炎症因子普遍升高(P< 0. 01)。 给药后TNF-α 有所下降(图7A)。 其中,中剂量组和PDTC 组显著减少(P< 0. 01);低剂量组减少(P< 0. 05)有统计学意义;高剂量组无统计学意义。 给药后各组IL-6 均显著减少(P<0. 01),有统计学意义(图7B)。 中剂量组CRP减少(P< 0. 05),PDTC 组CRP 显著减少(P<0. 01),有统计学意义(图7C);其余组无统计学意义。

图7 大鼠循环炎症因子水平Figure 7 Levels of circulating inflammatory cytokines in rats
2.5 苓术菟丝子丸抑制阿霉素肾病大鼠IKKβ/NF-κB/MCP-1 通路并上调足细胞标志蛋白
IKKβ、NF-κB 总体表达水平组间无统计学意义(图8)。 与空白组相比,模型组p-IKKβ、p-NF-κB、MCP-1 表达增多(P< 0.01);p-IKKβ/IKKβ、p-NFκB/NF-κB 比值上升(P< 0.01);nephrin、podocin 表达减少(P< 0.01),有统计学意义。 与模型组相比,苓术菟丝子丸低剂量组,pNF-κB/NF-κB 比值、MCP-1 表达水平降低(P< 0.05);nephrin、podocin 表达增多(P< 0.05),有统计学意义;p-IKKβ/IKKβ 比值降低,无统计学意义。 苓术菟丝子丸中剂量组,pNF-κB/NF-κB 比值、p-IKKβ/IKKβ 比值、MCP-1 表达均显著降低(P< 0.01);nephrin、podocin 表达显著增多(P< 0.01),有统计学意义。 PDTC 组,p-NF-κB/NF-κB 比值及MCP-1 表达显著减少(P<0.01); p-IKKβ/IKKβ 比 值 降 低(P< 0.05);nephrin、podocin 表达增多(P< 0.05),有统计学意义。 苓术菟丝子丸高剂量组,pNF-κB/NF-κB 比值减少(P< 0.05),有统计学意义,其余指标无明显改善。

图8 大鼠肾组织IKKβ/NF-κB/MCP-1 通路相关蛋白表达水平Figure 8 Protein expression level of IKKβ/NF-κB/MCP-1 signaling pathway related in kidney tissue of rats
2 讨论
NF-κB 作为CKD 的潜在药物靶点和生物标志物,IKKβ 是其经典上游[17]。 一项阿霉素损伤足细胞的体外实验表明,NF-κB/MCP-1 信号通路与之相关[4]。 足细胞受损时MCP-1 增多[18],足细胞损伤缓解时MCP-1 减少[19]。 蛋白尿的主要原因是足细胞损伤[4]。 由此可知,IKKβ/NF-κB/MCP-1 通路与CKD 蛋白尿息息相关。
苓术菟丝子丸出自《景岳全书》[11]。 治脾肾虚损之滑脱。 “气虚神倦,不能收摄,加人参三四两。”脾肾亏虚,化源与固摄失度,则精失且无以为继。方中菟丝子补益肝肾而固精。 白术、茯苓补脾气而助健运。 加人参大补元气,增益气之固涩之功。 携诸药行脾肾双补固精填髓之效。 体现了开源节流、标本兼治的治法。
尿蛋白作为肾损伤的标志物,对肾小管间质损伤有直接毒性作用,可加强肾局部微炎症,降低尿蛋白是缓解CKD 的有效措施[5]。 NF-κB 是足细胞损伤产生蛋白尿的关键介质[20]。 Nephrin、podocin均为足细胞标志蛋白,对维持肾滤过功能至关重要[21]。 抗MCP-1 治疗可减轻肾小管间质炎症[5]。Boels 等[22]发现,在糖尿病持续损伤的情况下,抑制MCP-1 可以恢复肾小球内皮细胞糖基化和屏障功能,并减少组织炎症。 一定程度抑制NF-κB 对足细胞有保护作用,但NF-κB 过度抑制会导致足细胞死亡[4]。 因而苓术菟丝子丸高剂量组肾病理表现出肾小球结构无改善、足突融合成片的现象,可考虑该组药物剂量过大,对NF-κB 产生了过度抑制,导致足细胞死亡。 加快了疾病进程,使肾小球几近失去滤过功能,提前进入肾衰竭少尿期,尿液减少,故该组24 h 尿蛋白减少,血浆白蛋白升高。 这与临床急性肾衰竭少尿期病人的表现相符合。
本实验结果表明,阿霉素肾病大鼠体重减轻。24 h 尿蛋白升高,炎症因子IL-6、TNF-α、CRP 增多。肾组织中IKKβ/NF-κB/MCP-1 通路激活,足细胞受损,足突成片融合呈绒毛样改变。 Nephrin、podocin表达减少。 除高剂量组外,低、中剂量给药组大鼠肾p-IKKβ、p-NF-κB、MCP-1 蛋白表达减少,下游炎性因子降低。 Nephrin、podocin 蛋白表达增多。 足突融合改善,24 h 尿蛋白减少。 表明阿霉素肾病蛋白尿和炎症因子增多可被苓术菟丝子丸部分逆转。可能与IKKβ/NF-κB/MCP-1 信号通路的抑制,和保护足细胞有关。
在适宜的剂量下,祖国医学补肾固精法改善肾性蛋白尿疗效显著由此可见一斑。 CKD 治疗周期长费用高,特别是低收入国家的肾衰患者常因无法获得肾替代疗法而过早死亡[3]。 祖国医学的适当应用可延缓病情。 也在一定程度上减轻患者医疗负担。 本研究没有连续检测药物干预期间的24 h尿蛋白定量,因此不能就药物对24 h 尿蛋白的影响做动态评估。 此外本研究的总时长为8 周,故而未能对长期的药效走向进行把控。
参考文献(References)
[ 1] Glassock RJ, Warnock DG, Delanaye P. The global burden of chronic kidney disease: estimates, variability and pitfalls [J].Nat Rev Nephrol, 2017, 13(2): 104-114.
[ 2] Luyckx VA, Cherney DZ, Bello AK. Preventing CKD in developed countries [J]. Kidney Int Rep, 2019, 5(3): 263-277.
[ 3] Yang C, Wang HB, Zhao XJ, et al. CKD in China: evolving spectrum and public health implications [J]. Am J Kidney Dis,2020, 76(2): 258-264.
[ 4] Bao H, Ge Y, Peng A, et al. Fine-tuning of NF-κB by glycogen synthase kinase 3β directs the fate of glomerular podocytes upon injury [J]. Kidney Int, 2015, 87(6): 1176-1190.
[ 5] Liu D, Lv LL. New understanding on the role of proteinuria in progression of chronic kidney disease [J]. Adv Exp Med Biol,2019, 1165: 487-500.
[ 6] Amdur RL, Feldman HI, Gupta J, et al. Inflammation and progression of CKD: The CRIC study [J]. Clin J Am Soc Nephrol, 2016, 11(9): 1546-1556.
[ 7] Kaysen GA. The microinflammatory state in uremia: causes and potential consequences [J]. J Am Soc Nephrol, 2001, 12(7):1549-1557.
[ 8] Sun HJ, Xiong SP, Cao X, et al. Polysulfide-mediated sulfhydration of SIRT1 prevents diabetic nephropathy by suppressing phosphorylation and acetylation of p65 NF-κB and STAT3 [J]. Redox Biol, 2021, 38: 101813.
[ 9] 王娟, 刘蕊, 韩世盛, 等. 基于足细胞损伤探讨益气补肾固涩药对蛋白尿的作用及其机制 [J]. 亚太传统医药, 2020,16(8): 189-193.Wang J, Liu R, Han SS, et al. Function and mechanism of Yiqi Bushen guse drugs on proteinuria based on study of podocyte damage [J]. Asia Pac Tradit Med, 2020, 16(8): 189-193.
[10] 沈翀奇. 补肾益精法治疗蛋白尿55 例 [J]. 中西医结合心血管病电子杂志, 2019, 7(32): 159, 161.Shen CQ. Treatment of 55 cases of proteinuria with the method of tonifying kidney and nourishing essence [J]. Cardiovasc Dis Electron J Integr Tradit Chin West Med, 2019, 7 (32):159, 161.
[11] 李志庸. 张景岳医学全书 [M]. 北京: 中国中医药出版社; 2015.Li ZY. Zhang Jingyue’ s complete book of medicine [M].Beijing: China Press of Traditional Chinese Medicine; 2015.
[12] de Fátima Pereira W, Brito-Melo GEA, de Almeida CAS, et al.The experimental model of nephrotic syndrome induced by Doxorubicin in rodents: an update [J]. Inflamm Res, 2015, 64(5): 287-301.
[13] Ma HL, Wu YJ, Zhang WF, et al. The effect of mesenchymal stromal cells on doxorubicin-induced nephropathy in rats [J].Cytotherapy, 2013, 15(6): 703-711.
[14] 张勇, 张蓓, 宁华英, 等. 单次尾静脉注射法阿霉素大鼠肾病模型的建立 [J]. 中国实验动物学报, 2013, 21(1): 1-4,107.Zhang Y, Zhang B, Ning HY, et al. Establishment of a rat model of nephrosis induced by single tail vein injection of doxorubicin [J]. Acta Lab Anim Sci Sin, 2013, 21(1): 1-4, 107.
[15] Wick MR. The hematoxylin and eosin stain in anatomic pathology-an often-neglected focus of quality assurance in the laboratory [J]. Semin Diagn Pathol, 2019, 36(5): 303-311.
[16] Luan PP, Zhuang JH, Zou J, et al. NLRC5 deficiency ameliorates diabetic nephropathy through alleviating inflammation[J]. FASEB J, 2018, 32(2): 1070-1084.
[17] Rangan G, Wang YP, Harris D. NF-κB signalling in chronic kidney disease [J]. Front Biosci, 2009, 14(9): 3496-3522.
[18] Wang YH, Liu JX, Zhang QQ, et al. Human umbilical cord mesenchymal stem cells attenuate podocyte injury under high glucose via TLR2 and TLR4 signaling [J]. Diabetes Res Clin Pract, 2021, 173: 108702.
[19] Son SS, Kang JS, Lee EY. Paclitaxel ameliorates palmitateinduced injury in mouse podocytes [J]. Med Sci Monit Basic Res, 2020, 26: e928265.
[20] Ke GB, Chen XQ, Liao RY, et al. Receptor activator of NF-κB mediates podocyte injury in diabetic nephropathy [J]. Kidney Int, 2021, 100(2): 377-390.
[21] Tung CW, Hsu YC, Shih YH, et al. Glomerular mesangial cell and podocyte injuries in diabetic nephropathy [J]. Nephrology(Carlton), 2018, 23(4): 32-37.
[22] Boels MGS, Koudijs A, Avramut MC, et al. Systemic monocyte chemotactic protein-1 inhibition modifies renal macrophages and restores glomerular endothelial glycocalyx and barrier function in diabetic nephropathy [J]. Am J Pathol, 2017, 187(11): 2430-2440.
