外周血PLR 与乙肝相关肝硬化肝癌临床病理参数及预后的相关性*
2022-03-02张晓芳
王 娟,章 颖*,明 芳,张晓芳
(南通大学附属南通第三医院肝病科,南通 226006)
原发性肝癌居我国常见恶性肿瘤排名的第4 位,病死率位居第2 位,且有缓慢上升的趋势[1-2]。原发性肝癌最常见的病理类型为肝细胞型,占75%~85%,还包括胆管细胞型及混合细胞型,三者在发病机制及预后等方面存在明显差异[3]。研究[4]表明,乙型肝炎肝硬化是原发性肝癌的主要发病因素。在乙型肝炎肝硬化进展过程中有多种炎性细胞参与并相互作用,这种持续存在的慢性炎症反应可能是导致正常肝细胞癌变的重要催化剂。慢性炎症参与了肿瘤的发生发展[5],慢性炎症的持续性作用导致病变部位聚集产生大量的炎症细胞因子,进一步激发了细胞的氧化应激反应,致使DNA 损伤修复基因功能丧失,引发肿瘤。外周血血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)是一种新兴的反映炎症反应的标志物,与机体许多部位的恶性肿瘤预后相关,如咽癌、小细胞肺癌、胃癌、肝细胞癌等[6-9]。尽管近年来PLR 与肿瘤预后的关系是临床研究的热点,但PLR 与乙型肝炎相关肝硬化肝癌的研究少见。本研究旨在通过观察乙型肝炎相关肝硬化肝癌患者治疗前PLR 的水平,探讨其与患者临床病理参数及预后的相关性。
1 资料与方法
1.1 一般资料 回顾性分析2016 年1 月—2019年12 月南通大学附属南通第三医院收治的86 例乙型肝炎相关肝硬化肝癌患者的临床资料,纳入标准:(1)均经手术或穿刺病理明确诊断为原发性肝癌;(2)有明确的乙型肝炎肝硬化病史;(3)有完整的治疗前血细胞分析结果。排除标准:(1)合并其他部位肿瘤;(2)合并血液、免疫系统疾病;(3)急性感染;(4)合并酒精性肝病或丙型肝炎病毒感染;(5)重要脏器功能不全;(6)随访资料缺失。另选取同期40 例肝硬化患者作为对照。
1.2 观察指标 收集86 例乙型肝炎相关肝硬化肝癌患者的临床资料,主要包括:年龄、性别、TNM 分期、组织分化程度、肿瘤直径、甲胎蛋白(alpha fetoprotein,AFP)水平、淋巴结转移及腹水情况,登记每例患者治疗前外周血血小板及淋巴细胞计数,计算PLR。相同方法计算出40 例肝硬化对照组患者的PLR 水平。电话随访记录患者的生存情况,时间截止到2021 年12 月31 日。
1.3 统计学方法 采用SPSS 24.0 软件进行统计分析,非正态性分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U 检验;绘制受试者操作特征(receiver operating characteristic,ROC)曲线,并将最大约登指数值所对应的PLR 值作为截断值进行分组;计数资料以频数表示,组间比较采用χ2检验;单因素及多因素分析采用二元Logistic 回归模型。检验水准α=0.05。
2 结果
2.1 乙型肝炎相关肝硬化肝癌组与肝硬化对照组患者PLR 水平的比较 入组的86 例乙型肝炎相关肝硬化肝癌组患者PLR 水平为141.99(112.37,263.40),40 例肝硬化对照组患者PLR 水平为103.73(58.09,201.08),乙型肝炎相关肝硬化肝癌组PLR 水平明显高于肝硬化对照组(Z=-2.759,P=0.006)。
2.2 乙型肝炎相关肝硬化肝癌患者PLR 截断值及分组 根据ROC 曲线,最大约登指数为0.356,所对应的PLR=141.99,敏感度为0.653,特异度为0.703,曲线下面积(area under curve,AUC)为0.703(95%CI 0.592~0.813,P=0.001),见图1。根据该截断值将患者分为:低PLR 组(PLR<141.99),共43 例;高PLR 组(PLR≥141.99),共43 例。
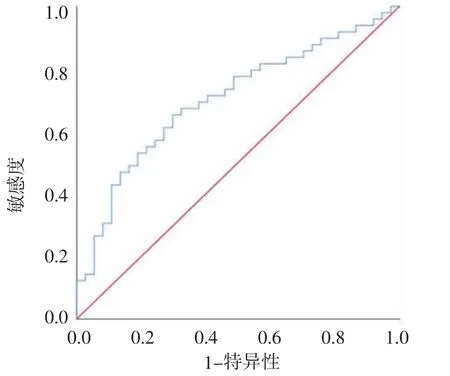
图1 确定PLR 最佳截断值的ROC 曲线
2.3 乙型肝炎相关肝硬化肝癌患者PLR 与临床病理参数的关系 在入组的86 例乙型肝炎相关肝硬化肝癌患者中,死亡49 例,存活37 例;年龄32~74岁,平均(54.12±11.43)岁。表1 结果显示,乙型肝炎相关肝硬化肝癌患者PLR 水平高低与TNM 分期、分化程度、淋巴结转移、AFP 相关(均P<0.05),而与年龄、性别、腹水、肿瘤直径无关(均P>0.05)。高PLR 组患者的TNM 分期更晚、分化程度更低,AFP 更高,且易出现淋巴结转移。
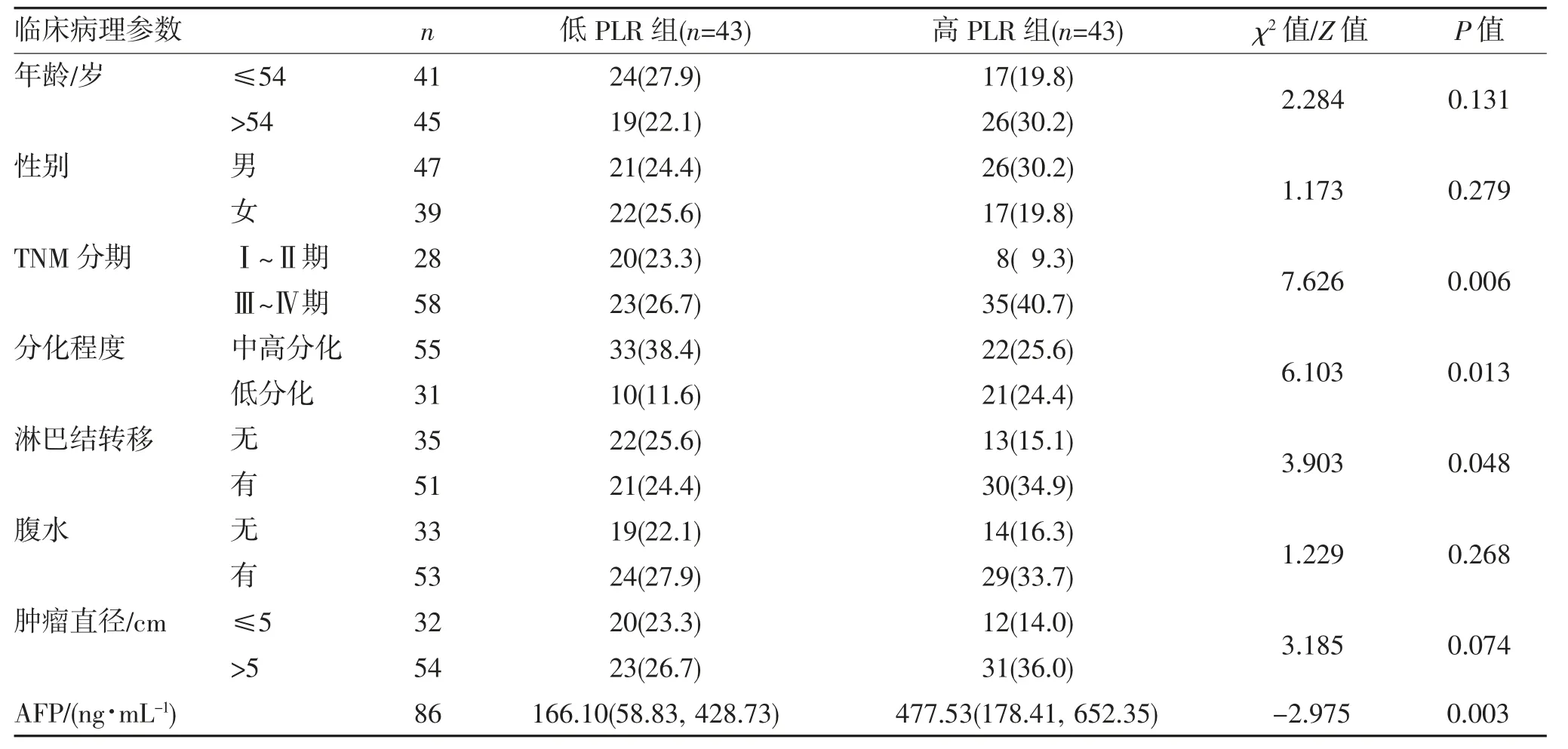
表1 乙型肝炎相关肝硬化肝癌患者PLR 与临床病理参数的关系[n,%,M(P25,P75)]
2.4 影响乙型肝炎相关肝硬化肝癌患者预后的单因素及多因素分析 单因素分析结果显示,TNM 分期、分化程度、淋巴结转移、腹水、肿瘤直径、AFP、PLR 均是影响乙型肝炎相关肝硬化肝癌患者预后的因素(均P<0.05),见表2。将单因素分析中有统计学意义的变量作为协变量进行Logistic 多因素分析,结果显示,TNM 分期Ⅲ~Ⅳ期、淋巴结转移、肿瘤直径>5 cm、AFP 及PLR 均是影响乙型肝炎相关肝硬化肝癌患者预后的独立危险因素(均P<0.05),见表3。
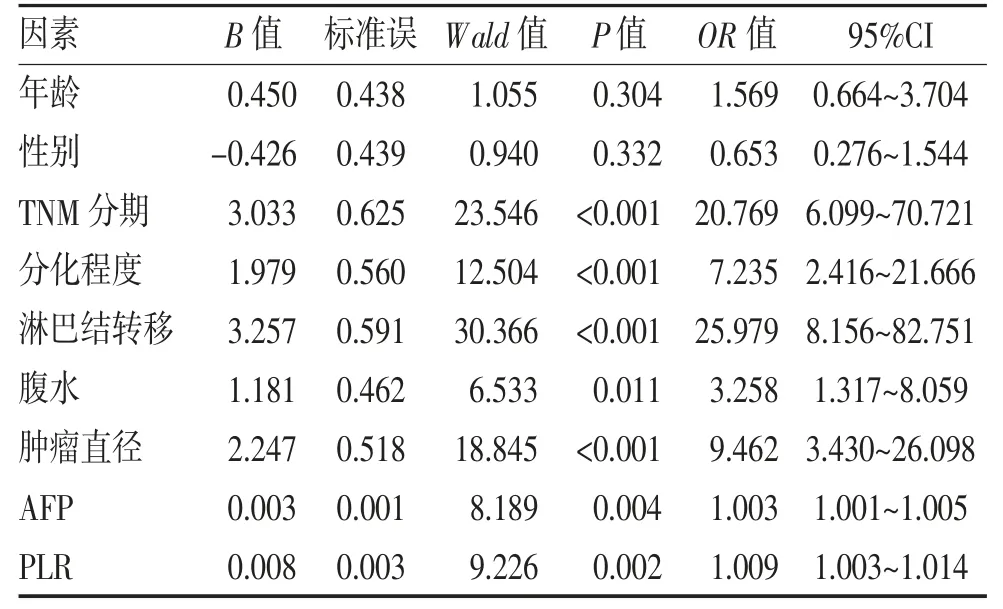
表2 影响乙型肝炎相关肝硬化肝癌患者预后的单因素分析
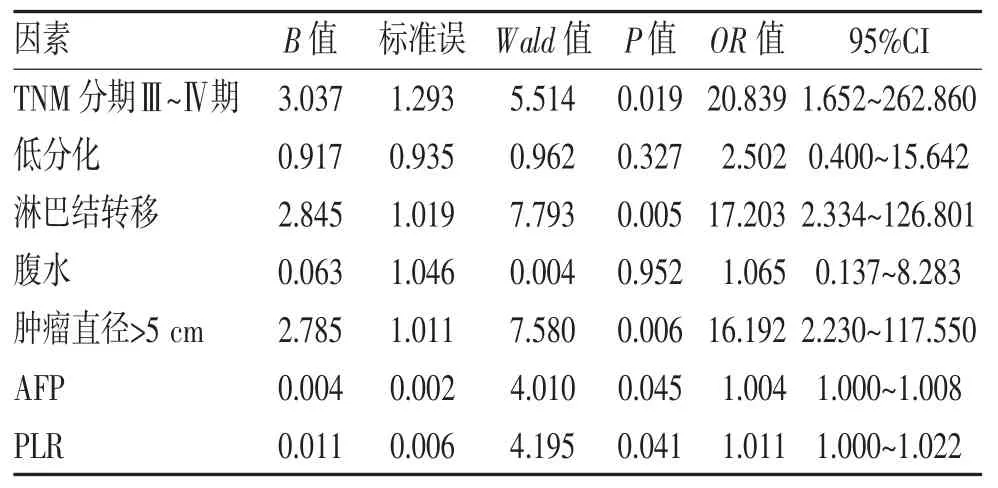
表3 影响乙型肝炎相关肝硬化肝癌患者预后的Logistic 多因素分析
3 讨论
乙型肝炎病毒感染在我国较常见,早期不易发现,很多患者发现时即已发展为慢性肝炎,严重者已处于肝硬化肝癌状态。我国原发性肝癌的发展主要有4 个阶段:肝炎病毒感染、慢性肝炎、肝硬化、肝癌,其中乙型肝炎病毒感染引发的肝癌居首位[10]。原发性肝癌预后相对较差,即使经过规范化治疗,2 年内仍有约50%的患者肿瘤复发[11]。
慢性炎症参与了肿瘤微环境的构建,二者相互作用,互为因果,恶性循环导致肿瘤进展。研究[12]发现凭借单一的炎症因子来评估炎症反应可靠性较差,而联合多种指标的比值或乘积用于判定炎症反应的程度具有较高的稳定性。PLR 作为一种炎症因子标志物,反映血小板系统促瘤因素与淋巴免疫系统抑瘤因素的均衡情况,PLR 升高意味着促瘤因素占主导地位,可能会导致肿瘤进展,已证实PLR 升高与部分实体瘤预后不良存在相关性[13]。C.HU[14]等发现PLR 升高是阴茎癌患者总生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS)不良的独立预后因素。X.L.ZHANG 等[15]研究结果也显示治疗前高PLR 水平是胃癌患者OS 和PFS预后不良的因素,且PLR 升高患者肿瘤分期更晚(Ⅲ~Ⅳ期),更易出现淋巴结转移。S.CHON 等[16]发现PLR≥226 患者的预后较差,多因素分析显示PLR 可作为上皮性卵巢癌的独立预后因素。B.M.LEE 等[17]报道治疗前PLR 升高意味着胰腺癌患者更差的OS及PFS。PLR 在肝癌领域的研究虽不多,但也有类似发现。Y.F.CHEN 等[18]对肝癌根治性手术后患者研究发现,PLR 水平高低与肝外转移率密切相关,高PLR患者更易出现肝外转移。D.WANG 等[19-20]研究发现高PLR 值与肝细胞癌肿瘤大小、术后复发风险增加密切相关。
本研究结果显示,乙型肝炎相关肝硬化肝癌组PLR 水平明显高于肝硬化对照组。当ROC 曲线最大约登指数为0.356 时,对应的PLR 为141.99,真阳性率达65.3%,真阴性率达70.3%,AUC 为0.703,这与既往研究结果[19-20]相似。高PLR 组患者的TNM 分期更晚、分化程度更低,AFP 更高,且更易出现淋巴结转移。TNM 分期Ⅲ~Ⅳ期、淋巴结转移、肿瘤直径>5 cm、AFP 及PLR 是影响乙型肝炎相关肝硬化肝癌患者预后的独立危险因素。在后续的研究中,本课题组拟进一步构建PLR+AFP 联合预测模型,并进行PLR+AFP 联合检测的预测效能分析。
综上所述,治疗前外周血PLR 可作为乙型肝炎相关肝硬化肝癌患者的独立预后因素,高水平PLR预示乙型肝炎相关肝硬化肝癌患者预后较差。PLR在临床上较易获取且价格低廉,其作为判断预后的指标值得进一步推广,但本研究也存在一些不足,有待扩大样本验证。
