长链非编码RNA-PTENP1在结直肠癌组织中的表达及意义
2022-03-02左仲学王宏志黄绪群
左仲学 王宏志 黄绪群
结直肠癌已成为导致我国居民死亡的主要癌种[1],对人群生命安全构成严重威胁。尽管现有的诊疗手段不断进步,但患者总体预后依然改善有限[2]。有研究指出[3],高转移性与结直肠癌患者死亡密切相关。长链非编码RNA(long non-coding RNA,lncRNA)作为一种长度在200 nt以上的RNA,缺乏蛋白编辑功能,但参与了多种疾病发生进展过程[4],且在多种恶性肿瘤组织中出现表达异常[5]。10号染色体上磷酸酶与张力蛋白同源缺失性基因假基因1(phosphase and tensin homology deleted onchromosome ten pseudogene 1,PTENP1)作为一种lncRNA,是抑癌基因PTEN的假基因,可通过竞争PTEN表达而发挥作用,已发现其参与了多种恶性肿瘤发生进展过程[6]。本研究检测了结直肠癌组织中PTENP1表达情况,探讨其在不同临床指标间的表达差异性,以及与患者预后的相关性。
1 资料与方法
1.1 一般资料 以2013年8月至2015年8月我院收治的结直肠癌患者为对象,共入选106例,男59例,女47例;平均年龄(59.55±10.27)岁;术中将结直肠癌和癌旁>3 cm正常肠黏膜组织(均经病理学检查排除肿瘤),快速置于液氮中,-70℃保存。本研究通过医院伦理委员会批准,均行知情同意。
1.2 纳入与排除标准 纳入标准:(1)术前均未行任何放化疗治疗,术后病理学检查确证;(2)临床资料完整,均完成随访。排除标准:(1)出现远处转移,采用非根治性手术治疗者;(2)心肝肾等重要脏器严重功能障碍者;(3)合并有其他系统肿瘤者、内分泌代谢系统疾病者。
1.3 方法
1.3.1 利用RT-qPCR技术检测组织中PTENP1表达:取结直肠癌和正常肠黏膜组织,剪碎、研磨,加入细胞裂解液,使用总RNA提取试剂(美国Sigma公司)提取组织中总RNA,检测其纯度和浓度,按照逆转录试剂盒(美国Fermentas公司)说明获得cDNA,使用实时荧光定量PCR仪(美国ABI公司),按照PCR扩增试剂盒(日本Takara公司)说明对引物序列(由上海生工生物工程公司设计合成)进行扩增。序列:PTENP1:上游:5’-GGATCATTACCTCACACCATACC-3’,下游:5’-TCTAAGAAACAACTAAGCCAAAGTC-3’;β-actin:上游:5’-TCCCTGGAGAAGAGCTACG-3’,下游:5’-GTAGTTTCGTGGATGCCACA-3’。条件:94℃ 2 min,94℃ 30 s,63℃ 30 s,76℃ 30 s,38次循环。每个样品设复孔6个。用2-△△Ct法计算组织中PTENP1表达量。
1.3.2 病例随访:于术后第1天开始对病例随访,形式包括住院查房及出院后门诊、电话等,截止时间2021年8月31日,所有病例随访满5年,以死亡作为结局事件,记录患者总生存时间和5年生存率。

2 结果
2.1 PTENP1在结直肠癌和癌旁组织中的表达量 PTENP1在结直肠癌组织中的表达量为(0.24±0.09),低于癌旁组织中的(1.02±0.13),差异有统计学意义(t=52.036,P<0.001)。
2.2 PTENP1在不同临床病理指标结直肠癌组织中的表达差异 PTENP1在不同性别、年龄、肿瘤部位和肿瘤大小中表达量差异无统计学意义(P>0.05),而在不同分化程度、TNM分期、浸润深度、是否发生脉管浸润和淋巴结转移中表达量有差异(P<0.05)。见表1。

表1 PTENP1在不同临床病理指标结直肠癌组织中的表达差异
2.2 结直肠癌组织中PTENP1表达量与预后的相关性 106例患者随访时间2~60个月,中位随访时间60个月,以结直肠癌组织中PTENP1表达量的均值0.24为界值,将患者分为低表达组(n=60)和高表达组(n=46),低表达组患者平均生存时间(32.85±2.78)个月,5年生存率为35.00%,高表达组分别为(51.02±2.28)个月和71.74%,Log-Rank检验有统计学意义(χ2=17.140,P<0.01)。见图1。
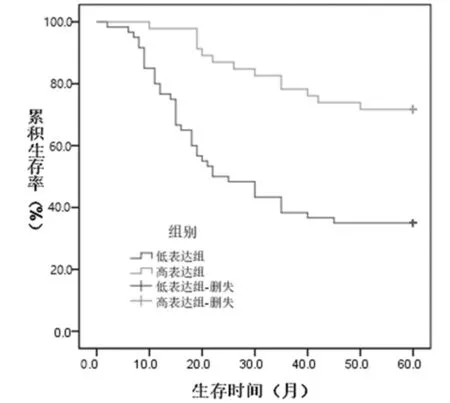
图1 结直肠癌组织中PTENP1表达量与预后的相关性
2.3 结直肠癌患者生存期的危险因素分析 分化程度、TNM分期、淋巴结转移和PTENP1表达是影响患者生存期的风险因素(HR=0.518、2.061、2.342和0.424,P<0.05)。见表2。
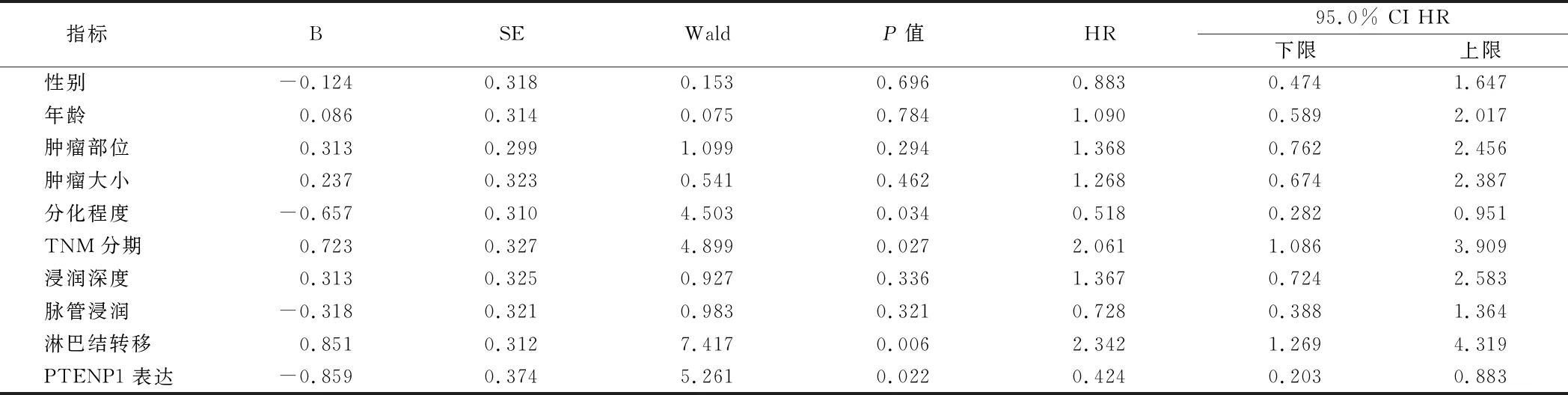
表2 影响结直肠癌患者生存期的多因素分析
3 讨论
结直肠癌患者由于早期不易诊断,一旦出现全身症状时已进展至中晚期,错失最佳治疗时机[7],尽管肿瘤诊疗技术取得长足发展,但结直肠癌患者生存率依然较低,转移和复发依然是造成患者死亡的主要原因[8]。lncRNA作为生物体内广泛存在但不具有蛋白翻译功能的长链RNA,已有研究显示,其与细胞增殖、迁移、分化等密切相关[9]。并且,多项研究表明,lncRNA与恶性肿瘤发生进展密切相关[10,11]。有研究指出,结直肠癌组织中存在lncRNA表达谱异常,可能参与了结直肠癌转移过程[12]。PTENP1作为一种lncRNA,是PTEN的假基因,位于人染色体9q13.3,有研究指出,其可抑制膀胱癌的进展[13]。亦有研究指出,PTENP1可作为口腔鳞癌早期标记物及治疗靶点[14]。Fan等[15]则指出,PTENP1通过抑制miR-106b抑制宫颈癌进展。本研究结果显示,结直肠癌组织中PTENP1呈低表达,提示PTENP1可能作为抑癌基因参与了结直肠发生。本研究结果显示,低分化、TNM分期Ⅲ~Ⅳ期、浸润深度T3~T4、发生脉管浸润和淋巴结转移的患者组织中表达量明显降低,说明PTENP1可能参与了肿瘤恶性进展。
有研究指出,检测血清PTENP1表达水平对胃癌有潜在诊断及预后评估价值[16]。张宇华等[17]指出,血清PTENP1可用于绒毛膜癌诊断和评估预后。这些研究报道表明,PTENP1可能与恶性肿瘤患者预后关系密切。本研究结果显示,与高表达组比较,低表达组患者平均生存时间和5年生存率均显著降低,说明结直肠癌患者组织中PTENP1表达水平与患者预后密切相关。本研究结果表明,PTENP1低表达是结直肠癌患者生存期的风险因素之一,进一步说明PTENP1低表达是影响预后的危险因素,提示PTENP1可能是评估患者预后的潜在标志物。
综上所述,结直肠癌患者组织中PTENP1表达量降低,且与代表恶性进展的临床指标有关,与患者不良预后有关,有望成为患者诊疗及评估预后的标志物。
