GSPT1在膀胱癌组织中的表达及对STAT3信号的影响研究
2022-03-02程琳贝雨峰李荷云李成俊李向东毕瑞杰刘建琳张建
程琳 贝雨峰 李荷云 李成俊 李向东 毕瑞杰 刘建琳 张建
膀胱癌是泌尿系统最常见的恶性肿瘤,每年约有430 000例新发病例和165 000例死亡病例。尽管治疗方法最近取得了进展,但晚期膀胱癌患者的预后仍然较差,其5年总生存率仅为20%[1,2]。膀胱癌的发展包括肿瘤抑制基因的遗传变化,许多基因的分子改变与膀胱癌的发展和预后有关。因此,迫切需要阐明膀胱癌的潜在分子机制,并找到治疗该疾病的新分子靶标。肿瘤发生与细胞周期、增殖相关的某些特定蛋白有关。真核肽链释放因子(eRF)是新生肽链释放的一组重要蛋白质,包括型eRF1、eRF3。eRF3a是哺乳动物蛋白质翻译终止过程中的主要因素,eRF3a主要由G1到S相变1蛋白(GSPT1)编码。研究确定,胃癌、肺癌、前列腺患者中的GSPT1显着增加[3]。最近的研究表明,GSPT1是骨髓恶性肿瘤增殖和分化的介体,其降低可导致急性髓细胞白血病(AML)中的细胞周期停滞和细胞凋亡[4]。此外,GSPT1可以重新排列以形成融合基因,GSPT1在慢性粒细胞白血病的疾病进展中起重要作用;还与肝细胞癌(HCC)的上皮-间质转化有关[5]。生物信息学表明,信号转导子和转录激活子3(STAT3)是GSPT1的下游靶分子,积累的证据表明,STAT3作为癌基因起作用,并且是炎症和癌症之间的关键纽带[6]。 STAT3诱导了鞘氨醇-1-磷酸受体1(S1PR1)的上调,后者相互激活STAT3,导致持续的IL-6释放,从而促进B16黑色素瘤和MB49膀胱癌模型的肿瘤发生和转移[7]。目前笔者尚未发现关于GSPT1/STAT3信号通路与膀胱癌关系的研究,本研究拟探讨GSPT1在膀胱癌组织中的表达及对STAT3信号的影响,为膀胱癌的治疗提供理论依据。
1 资料与方法
1.1 一般资料 选取2015至2021年张家口市第一医院泌尿外科通过全膀胱切除术获取的69例癌组织标本和69例相邻的非恶性组织标本(癌旁组织)。所有组织标本经确认并归类为TCCB。 通过组织学检查。 根据UICC指南评估组织学等级和分期,包括低分化21例,中分化23例,高分化25例。切除后立即将样品冷冻在液氮中。所有患者已获得知情同意,并且研究方案已得到机构研究伦理委员会的批准。
1.2 研究方法
1.2.1 免疫组化法测定GSPT1表达及判定标准:将组织标本用10%中性甲醛固定,包埋在石蜡中,并准备5 mm厚的切片。将石蜡包埋的组织切片在柠檬酸钠缓冲液中脱蜡,重新水化并微波处理30 min,以修复抗原表位。将组织切片与3%H2O2孵育并用山羊血清封闭,以消除内源性过氧化物酶活性。然后,将组织切片与靶向GSPT1(稀释度1∶100,美国Abcam,批号:TY-526363.36)的一级单克隆抗体在4℃孵育过夜。然后与大鼠或兔抗山羊IgG抗体在37℃孵育45 min,然后与链霉亲和素过氧化物酶孵育15 min。将切片用发色剂二氨基联苯胺(DAB,中国中山金桥)染色,直到出现棕色。用苏木精对细胞核染色。用显微镜观察所有图像,并用IPP 6.0(Intel®)分析。通过结合阳性染色的肿瘤细胞的比例和染色强度来确定分数。 将染色的细胞的强度半定量地分为四个等级:0(不染色); 1(弱染色=浅黄色); 2(中等染色=黄棕色)和3(强染色=棕色);得分为:0:负数;1:<10%; 2:11%~50%;3:51%~80%;4:>80%的阳性细胞。 每个标记的阳性细胞分数的强度和分数相乘,因此评分系统被定义为分数为0~3的阴性表达,分数为4~12的阳性表达。
1.2.2 细胞培养及其分组设计:T24细胞从美国典型培养物保藏中心获得,并在Dulbecco改良的Eagle培养基(中国碧云天生物,批号:AX-4585.36)中培养(含有10%的胎牛血清,100 U/ml的青霉素和100 mg/ml的链霉素),并在在37℃、5%CO2的湿润气氛中生长。通过将PCR扩增的全长人GSPT1 cDNA亚克隆到pReceiver-Lv121质粒(购自Genecopoeia,目录号EX-T2560-Lv121)中,生成GSPT1表达构建体。GSPT1开放阅读框(ORF)的长度为987 bp。为过表达/低表达GSPT1,Ribobio(广州市锐博生物科技有限公司)合成并纯化了两个靶向GSPT1的人siRNA序列,使用的siRNA序列如下:GSPT1 inhibitor组:5 ’-GGTGCGATCGATCGTCAGAAAGUCUGUGAGAUUdTdT-3’;GSPT1mimics:5’-CAAUGCUGAUCGTAGCTGAUCUGUUUGAUAAdTdT-3’。通过慢病毒感染产生表达GSPT1 inhibitor、GSPT1 mimics的稳定细胞系。 对于慢病毒生产,使用Lipofectamine Reagent(美国Invitrogen,批号:UY-56963.36),将慢病毒表达载体与慢病毒包装载体共转染到T24细胞中。用1.0 mg/ml嘌呤霉素选择表达GSPT1的稳定细胞系3 d。72 h后,收集细胞并进行处理以进行进一步的体外研究。
1.2.3 T24细胞细胞活力的检测及癌细胞单克隆形成数目检测:在指定的时间点,将培养结束的细胞与100 ml无菌MTT染料(0.5 mg/ml,美国Sigma生物科技,批号:DX-47856.36)一起接种到96孔板中,在37℃下放置4 h,然后除去培养基,并加入150 μl二甲基亚砜(DMSO,美国Sigma生物科技,批号:OP-458993.3)添加。 在570 nm下以655 nm作为参考波长测量吸光度。所有实验均重复3次。将细胞接种在60 mm培养皿上(每板0.5×103个细胞)并在5%CO2中37℃培养。10 d后,用10%甲醛固定5 min后,用1.0%结晶紫染色30 s。
1.2.4 T24细胞细胞凋亡测定:Annexin V-FITC/PI双重染色试剂(美国塞默非世生物科技,批号:DR-485963.36)结合FC500MCL流式细胞仪(美国伯乐生物科技)检测细胞凋亡。 将培养结束细胞以3×105细胞/孔的密度接种在6孔板中,用0.25%胰蛋白酶消化,消化后用PBS洗涤2次,加入100 μl结合缓冲液,依次制成1×106细胞/ml悬浮液。加入膜联蛋白V-FITC和PI,在室温下于黑暗中孵育5 min,并用流式细胞仪系统检测。重复实验3次并取平均值。
1.2.5 T24细胞侵袭水平测定:分别使用Matrigel Tranwell评估细胞的侵袭。通过使用具有8 μm孔膜的24孔腔室(Corning LifeSciences,目录号353097)和下部腔室中含有10%FBS的培养基作为化学吸引剂来评估细胞的侵袭水平。将细胞(1×105)的无血清培养基接种到上腔室中,并向含10%FBS的下腔室侵袭。24 h后,固定侵袭细胞并用0.1%结晶紫染色。通过使用图像分析软件ImagePro Plus 6.0(美国Media Cybernetics)测量侵袭细胞。
1.2.6 T24细胞迁移水平测定:将细胞(每孔1×104)接种到12孔板中,使其生长至汇合。使用200 μl无菌移液器吸头在每个铺满的单层上划伤(伤口)后,将细胞在无血清培养基中于恒温和CO2控制的培养箱(37℃,5%CO2)下培养24 h。通过测量伤口相对边缘之间的距离来研究伤口闭合情况。至少进行了3个独立的实验。
1.2.7 T24细胞GSPT1、STAT3、JAK2 mRNA表达水平测定:首先,将细胞系制备成细胞悬液。然后,添加TRIzol试剂以提取总RNA。总RNA的浓度和纯度通过Nanodrop 1000显微分光光度计(Gene Company Limited,中国)测量。根据制造商的说明,通过RT-PCR试剂盒(日本Takara,批号:5856.36)获得cDNA。用于GSPT1扩增的引物是正向5’-CATGTGCTAGCTGATCGTACGCGTTGGT-3’和反向5’-CCCACGTAGCTGATCGTCGATCGTGTTAAGA-3’。用于STAT3扩增的引物是正5’-GAGCACTCGTAGCTAGTCGATGCTAGATCC-3’和反向5’-CGACGTAGCTAGTCGATCGTATGACTGCC-3’。JAK2扩增用引物为正向5’-GGCCGTAGCTAGCTGATGATCGAAACAACC-3’和反向5’-GCACGTAGCTGATCGTAGCTATTGAATCC-3’。 GAPDH扩增的引物是正向5’-TAGCTAGCTGTCAGTCGCTCGAGGCACAAG-3’和反向5’-GTTTTGTCGATGCTAGCTAGTCGGCTTCA-3’。PCR反应条件如下:在94℃预变性45 s,在94℃变性10 s,在60℃退火30 s,共40个循环。根据制造商的协议,使用SYBR Premix Ex Taq Ⅱ试剂盒(日本Takara,批号:XS-52636.36)进行实时定量PCR。将基因表达标准化为GAPDH表达。
1.2.8 T24细胞GSPT1、STAT3、JAK2表达水平测定:将培养结束的细胞在RIPA裂解缓冲液中裂解,并使用BCA蛋白质测定试剂盒(Thermo Scientific,批号:XI-4589636.32)检测蛋白质浓度。蛋白质通过SDS-PAGE凝胶分离,并转移到聚偏二氟乙烯(PVDF)膜(Millipore,批号:DS-569696.37)上。在室温下将印迹在5%牛奶中封闭1 h。将PVDF膜与抗GSPT1、STAT3、JAK2、GAPDH一抗(英国Abcam,目录号:ab76148、ab108596、ab32101、ab68153)在4℃的冷藏室中孵育过夜。随后,将膜与生物素化的山羊抗小鼠IgG(1∶3 000,中山金桥生物技术有限公司,批号:VB-58965.69)在室温下孵育2 h。使用ECL化学发光反应(美国Amersham Pharmacia Biotech.批号:VB-26985.36)检测了免疫反应带强度,并通过AS-98 LabWorks Image(美国Scion Corporation)确定每个条带的光密度值。

2 结果
2.1 癌旁组织、膀胱癌组织中GSPT1表达的相关性分析 膀胱癌组织中GSPT1蛋白表达阳性率高于癌旁组织(P<0.01)。见表1,图1。
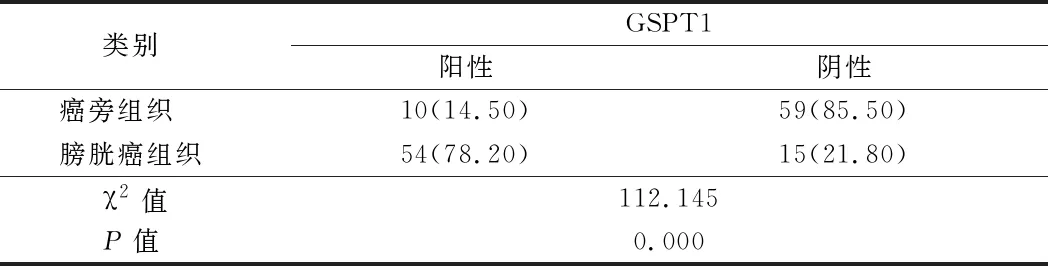
表1 癌旁组、膀胱癌组中GSPT1表达的相关性分析 n=69,例(%)

图1 GSPT1在癌旁组织、膀胱癌组织的表达(结晶紫染色×40);A 癌旁组织;B 膀胱癌组织
2.2 GSPT1蛋白表达与临床病理特征的关系 GSPT1蛋白表达与年龄的相关性并不明显(P>0.05);与TMN分期、病理学分级、复发、转移相关性明显,且TMN分级越高、病理学分期越高、有复发、有转移的患者中, GSPT1蛋白阳性表达率越高(P<0.01)。见表2。

表2 GSPT1蛋白表达与临床病理特征的关系 例(%)
2.3 3组T24膀胱癌细胞OD值、存活率水平的表达 与T24膀胱癌细胞组比较,GSPT1 inhibitor组OD值、存活率水平降低(P<0.01),GSPT1 mimics组OD值、存活率水平升高(P<0.01);与GSPT1 inhibitor组比较,GSPT1 mimics组OD值、存活率水平升高(P<0.01)。见表3。
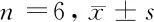
表3 3组T24膀胱癌细胞OD值、存活率水平的表达
2.4 3组T24膀胱癌细胞单克隆形成数目的表达 与T24膀胱癌细胞组比较,GSPT1 inhibitor组单克隆形成数目降低(P<0.01),GSPT1 mimics组单克隆形成数目升高(P<0.01);与GSPT1 inhibitor组比较,GSPT1 mimics组单克隆形成数目升高(P<0.01)。见表4。
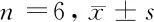
表4 3组T24膀胱癌细胞克隆形成数目的表达
2.5 3组T24膀胱癌细胞凋亡率的表达 与T24膀胱癌细胞组比较,GSPT1 inhibitor组细胞凋亡率升高(P<0.01),GSPT1 mimics组细胞凋亡率降低(P<0.01);与GSPT1 inhibitor组比较,GSPT1 mimics组单细胞凋亡率降低(P<0.01)。见表5。
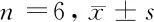
表5 3组T24膀胱癌细胞凋亡率的表达
2.6 3组T24膀胱癌细胞迁移能力比较 与T24膀胱癌细胞组比较,GSPT1 inhibitor组迁移率降低(P<0.01),GSPT1 mimics组迁移率升高(P<0.01);与GSPT1 inhibitor组比较,GSPT1 mimics组迁移率升高(P<0.01)。见表6。
表6 3组T24膀胱癌细胞迁移能力比较
2.7 3组T24膀胱癌细胞迁移能力比较 与T24膀胱癌细胞组比较,GSPT1 inhibitor组穿膜数降低(P<0.01),GSPT1 mimics组穿膜数升高(P<0.01);与GSPT1 inhibitor组比较,GSPT1 mimics组穿膜数升高(P<0.01)。见表7,图2。
表7 3组T24膀胱癌细胞穿膜数比较

图2 3组膀胱癌T24细胞穿膜数数目比较(结晶紫染色×40);A T24膀胱癌细胞组;B GSPT1 inhibitor组;C GSPT1 mimics组
2.8 3组T24膀胱癌细胞GSPT1、STAT3、JAK2mRNA表达水平比较 与T24膀胱癌细胞组比较,GSPT1 inhibitor组细胞GSPT1、STAT3、JAK2mRNA降低(P<0.01),GSPT1 mimics组细胞GSPT1、STAT3、JAK2mRNA升高(P<0.01);与GSPT1 inhibitor组比较,GSPT1 mimics组GSPT1、STAT3、JAK2mRNA升高(P<0.01)。见图3,表8。
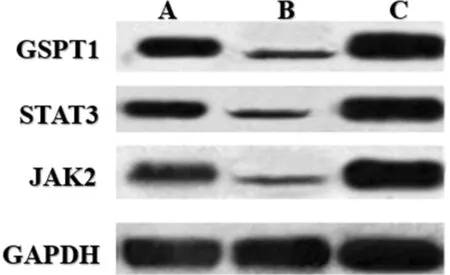
图3 3组T24膀胱癌细胞STAT3蛋白比较;A T24膀胱癌细胞组;B GSPT1 inhibitor组;C GSPT1 mimics组
表8 3组T24膀胱癌细胞GSPT1、STAT3、JAK2 mRNA表达水平比较
2.9 3组T24膀胱癌细胞GSPT1、STAT3、JAK2蛋白表达水平比较 与T24膀胱癌细胞组比较,GSPT1 inhibitor组细胞GSPT1、STAT3、JAK2蛋白降低(P<0.01),GSPT1 mimics蛋白升高(P<0.01);与GSPT1 inhibitor组比较,GSPT1 mimics组GSPT1、STAT3、JAK2蛋白升高(P<0.01)。见表9。
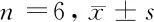
表9 3组T24膀胱癌细胞GSPT1、STAT3、JAK2蛋白表达水平比较
3 讨论
许多细胞的肿瘤发生与GSPT1的异常表达有关,这表明失调的GSPT1可能在癌变或肿瘤进展中起关键作用。GSPT1由单个基因位点加工而成,该基因位点由必需的造血转录因子GATA-1调控。最近的研究表明,GSPT1在许多人类癌症中起着重要作用,包括鼻咽癌、大肠癌和滤泡性甲状腺癌[8]。在各种癌症类型的30项研究中,GSPT1被广泛上调。据报道,mTOR是GSPT1的直接靶标,GSPT1的上调促进了CRC细胞系HT29的增殖[9]。尽管GSPT1在多种癌症中均明显过表达,但尚未完全了解GSPT1在恶性肿瘤中的作用机制。在本研究中,我们研究了T24膀胱癌细胞中GSPT1的致癌性,发现GSPT1在T24膀胱癌细胞中被上调,从而推断出GSPT1参与了膀胱癌的发展。通过生物信息学分析,将STAT3基因指示为理论GSPT1靶基因。本研究的荧光素酶报告基因分析表明,GSPT1通过STAT3 3’UTR介导了STAT3下调。 qRT-PCR和蛋白质印迹分析表明,GSPT1的过表达显着升高了STAT3 mRNA和蛋白质的水平。这些结果表明,STAT3是GSPT1的真正靶标。
在人类中,先前的研究表明,肠型胃肿瘤和乳腺癌中GSPT1 mRNA的水平升高,在人类软骨细胞分化过程中GSPT1 mRNA的水平则显着升高。GSPT1表达与血液系统恶性肿瘤患者的临床预后密切相关。GSPT1表达与AML患者的预后呈负相关,而NUMB的表达在体外和体内均受GSPT1负调控[10];GSPT1可能是成人B细胞急性淋巴细胞白血病的预后不良因素。最近,研究揭示了实体瘤(肝癌)患者GSPT1表达与预后的关系,发现GSPT1表达与EMT相关,并且是HCC预后的预测生物标志物。与上述的报告一致,本研究表明GSPT1表达在人膀胱癌组织上调,并且患者GSPT1表达水平与TNM分期、病理学分级、复发、转移相关性明显,且TNM分期越高、病理学分期越高、有复发、有转移,GSPT1蛋白阳性表达率越高(P<0.01)。这些研究表明GSPT1是膀胱癌诊断预后的新型预测因子。进一步解释GSPT1的促癌机制,我们测试了GSPT1过/低表达后,癌细胞增殖、侵袭、凋亡水平的改变结果发现T24膀胱癌细胞组比较,GSPT1 inhibitor组OD值、存活率、穿膜数、迁移率水平降低(P<0.01),GSPT1 mimics组OD值、存活率、穿膜数、迁移率水平升高(P<0.01);与GSPT1 inhibitor组比较,GSPT1 mimics组OD值、存活率、穿膜数、迁移率水平升高(P<0.01)。与T24膀胱癌细胞组比较,GSPT1 inhibitor组细胞凋亡率升高(P<0.01),GSPT1 mimics组细胞凋亡率降低(P<0.01);与GSPT1 inhibitor组比较,GSPT1 mimics组单细胞凋亡率降低(P<0.01)。这表明,GSPT1能促进T24膀胱癌细胞增殖、侵袭、抑制其凋亡。
STAT3是增殖信号的重要靶标,在细胞增殖中起着重要作用。越来越多的证据表明,STAT3表达升高,它是介导癌症进展的转录因子,其在60%的结直肠癌、胃癌中高度过量表达,这表明STAT3也是肿瘤发生的标志[11,12]。此外,癌基因JAK2是凋亡蛋白的抑制剂,在控制细胞增殖和生长中具有重要意义。先前研究表明,STAT3、JAK2存在相互作用[13-15]。STAT3的下表达降低了JAK2的蛋白水平,这表明STAT3可能通过JAK2参与细胞凋亡的调控。
作为一种肿瘤癌基因,JAK2是癌症治疗的重要靶点,是线粒体凋亡途径的重要调节剂,并通过阻止细胞色素c从线粒体膜间空间释放到细胞质中来发挥其抗凋亡功能[16]。研究表明,STAT3/Jak2信号在上皮-间充质向癌细胞的转化中起关键作用,这暗示了STAT3/Jak2信号在膀胱癌进展中的重要性[17];膀胱癌细胞中STAT3/Jak2的激活驱动了EMT和肿瘤的侵袭;Jak2抑制剂AG490可以抑制膀胱癌细胞的生存能力和细胞迁移,并同时降低STAT3信号传导[18-20]。这些研究证明STAT3在膀胱癌进展中具有致癌作用,但是GSPT1和STAT3/Jak2信号转导在膀胱癌转移中的生物学关系尚不清楚。本研究中,与T24膀胱癌细胞组比较,GSPT1 inhibitor组细胞GSPT1、STAT3、JAK2mRNA蛋白降低(P<0.01),GSPT1 mimics组细胞GSPT1、STAT3、JAK2mRNA蛋白升高(P<0.01);与GSPT1 inhibitor组比较,GSPT1、STAT3、JAK2mRNA蛋白升高(P<0.01)。这表明,GSPT1促进STAT3、JAK2mRNA蛋白表达进而激活STAT3/JAK2通路。本研究显示人类膀胱细胞中GSPT1的过度表达与Jak2和STAT3的表达以及STAT3/Jak2基因的激活相关,表明GSPT1可能通过STAT3/Jak2信号通路诱导膀胱癌的转移和侵袭。这为膀胱癌的发生提供了新的见解。
综上所述,GSPT1在膀胱癌组织上调,与TNM分期、病理学分级、复发、转移相关;GSPT1可能通过STAT3/Jak2信号通路诱导膀胱癌的转移和侵袭。
