旋转弧放电等离子体重整乙醇制氢
2022-03-02郭伟郑贤锋郭起家
郭伟 郑贤锋 郭起家
1.安徽师范大学物理与电子信息学院 2.安徽华东光电技术研究所
21世纪以来,化石燃料作为能源在交通、化工等领域一直占主要地位。但是由于其过度的开采和使用,造成了土地破坏、水资源污染、全球气候变暖等一系列严重的环境问题。氢气作为一种新能源,具有燃烧产物洁净、燃烧发热量高等优点。现阶段氢气的主要来源是烃类和醇类的重整。乙醇在常温常压下是液体,毒性低,且可再生,广泛应用于重整领域。
等离子体重整是一种新型的制氢方式。等离子体作为物质的第四态,它包含大量的高能电子、活性基团、激发态离子等,这些活性粒子能有效促进重整反应的进行。且等离子体重整由于其能量密度小、装置体积小,因而在现场制氢和小规模制氢方面具有很大的发展潜力,在国内外受到广泛关注[1-7]。
杜长明等[8]采用新型Laval滑动弧放电,研究了电弧放电特性及在生物乙醇重整制氢气上的应用,重点考查了氧碳物质的量比(以下简称氧碳比)、硫碳物质的量比(以下简称硫碳比)以及乙醇流量对重整效果的影响。结果表明,乙醇转化率最高达到了82%。当乙醇流速为0.10 g/s、硫碳比为2.0、氧碳比为1.6时,制氢能耗达到最小值82.88 kJ/mol。最佳操作条件为硫碳比2.0、氧碳比1.4~1.6。吕一军[9]对滑动弧放电重整乙醇制氢进行了研究,结果表明,随着乙醇含量的增加,乙醇转化率和氢气收率下降,但产氢速率增加,制氢能耗降低。Burlica R等[10]设计了一种带有喷嘴的非热等离子体滑动弧重整反应器,研究了重整乙醇制氢的制氢速率和能量效率。以氩气为工作气体,以脉冲的形式加入乙醇溶液。实验结果表明,当放电功率为0.45 kW,乙醇体积分数为40%,乙醇流量为4~20 mL/min时,氢气的产率为3.4~5.0 μmol/s。在最大流量下,制氢能耗达到90 kJ/mol。
目前,等离子体重整器的设计、重整效率的提高、重整机理的探析等仍处于起步阶段,还需要进一步的研究[11-13]。
相较于一般的滑动弧放电,旋转弧放电形成的等离子体区域更大,有利于反应进行。本研究设计了一种气流驱动式旋转弧等离子体炬,并对重整反应腔进行了优化。采用空气作为工作气体,对旋转弧等离子体重整乙醇制氢进行了研究。研究考查了氧醇比、乙醇流量、放电电压、放电间距对重整结果的影响,为等离子体重整制氢工艺的优化和催化剂的研制提供一定的理论技术指导。
1 实验装置和原理
1.1 实验装置和流程
重整系统主要包括重整反应腔、高压电源、平流泵、电子流量计、冷凝罐、电弧点火器、气相色谱仪等。图1是旋转弧等离子体重整乙醇的实验装置简图。
空气经电子流量计分两路进入反应腔,一路作为放电气体从电弧炬端切向进入。电弧的转速主要和该路空气的流速有关。乙醇经平流泵与另一路空气混合后从预热好的上反应腔下端的进气口切向进入反应腔。反应后的气体经冷凝后被采集,用于气相色谱仪分析其组成。

实验时采取将反应腔倒置的方式。这是因为乙醇气体的密度比空气大,有利于乙醇气体与等离子体射流充分接触。并且在两个反应腔之间有一个盘管,如图2所示,该设计有助于涡旋气流的形成,并且能减少炬端上升气流对涡旋气流的影响,保证乙醇气体往下流动与等离子体充分反应。电弧炬中间钉子状的电极连接高压电源,而整个电弧炬的外壳接地。在外壳和电极之间用聚四氟乙烯制成的绝缘层间隔。

1.2 实验原理
空气作为工作气体主要由O2和N2组成。用高能电子轰击O2,使O2分离:
O2+e→O+O+e
(Ⅰ)
电离离解产生的O自由基具有很强的氧化能力,它能与乙醇或其他自由基发生反应,形成含氧化合物。O自由基也可以捕获某些粒子中的H原子,形成OH基并破坏某些C2的C=C键[14]。
实验涉及的主要总包反应如下:
乙醇部分氧化:
C2H5OH+0.5O2→2CO+3H2
(Ⅱ)
C2H5OH+1.5O2→2CO2+3H2
(Ⅲ)
乙醇受热分解:
C2H5OH →CH4+H2+CO
(Ⅳ)
此外,乙醇直接从放电端进入会使等离子体发生区产生炭沉积,导致等离子体生成不稳定,污染电极[15]。因此,本研究使乙醇蒸气直接注入等离子体火焰中。这样的进气方式可以有效抑制等离子体发生区的炭沉积。
1.3 参数设定和结果评价
本研究选择的实验参数条件设置见表1。

表1 实验条件参数的设定氧醇比乙醇流量/(mL·min-1)放电电压/kV放电间距/mm典型值0.942.11.82.0范围0.5~1.416.8~50.51.0~2.01.0~3.5
其中,放电端空气流速固定为8 L/min。本研究所涉及的气体体积均为标准状态下的体积。实验所用乙醇体积分数为99%的无水乙醇,氧醇比为初始反应物中氧和乙醇的物质的量比。本研究除了特别提及的地方,实验参数一般默认选取典型值。实验从乙醇转化率η(C2H5OH)、氢气选择性S(H2)、氢气收率y(H2)、能量效率T、能量产率Q(H2)这几方面来评价重整效果。其定义如下:
乙醇转化率:
(1)
氢气选择性:
(2)
氢气收率:
(3)
能量效率:
(4)
能量产率:
(5)
式中:n1(C)为气相产物中C的物质的量,mol;n0(C)为初始反应物中C的物质的量,mol ;n1(H2)为产物中H2的物质的量,mol ;n1(H)为产物中H的总的物质的量,mol ;n0(H)为初始反应物中H的物质的量,mol ;q1为每小时生成的气相产物(包括H2、CO、CH4、C2H2、C2H4、C2H6、C3H6、C3H8)的总发热量,kJ/h;qEt为每小时消耗的原料乙醇的发热量,kJ/h ;Ec为每小时重整系统的耗电量,kWh/h ;p(H2)为每小时氢气的体积产量,L/h。
在计算发热量时都选用低位发热量进行计算,重整系统的耗电量包括重整装置和周边设备等。
2 结果与讨论
经前期实验,通过气相色谱仪分析产物组成可知,除了空气中未参与反应的N2以及冷凝成液体的水蒸气,重整的气相产物有H2、CO、CO2、CH4、C2H2、C2H4、C2H6、C3H6、C3H8,其中C2及C2以上的碳氢化合物含量较低。值得注意的是,在长达40 h的试验后,在拆卸实验仪器时发现,反应腔内壁上几乎没有积炭的形成,这说明反应腔的优化设计对于抑制积炭的形成具有良好的效果。
2.1 氧醇比
实验在乙醇流量为42.1 mL/min、放电电压为1.8 kV、放电间距为2 mm的条件下,考查了氧醇比对重整反应的影响。
图3显示了氧醇比对气相产物中几种主要组分体积分数的影响。随着氧醇比的增加,产物中CO2体积分数从3.21%增加到5.62%。而CO和H2含量都有所降低,H2体积分数降低了4.21%,CO体积分数降低了2.59%。CH4体积分数在氧醇比小于0.8时略有增加,但在0.8之后有明显减少。这说明在氧醇比小于0.8时,随着O2的增加,乙醇分解转化的量增加,生成了更多的CH4、CO等。但是,初始反应物中O2的进一步增加使得重整反应中氧化反应的程度加深,一些较大的分子如CO、CH4、C2H4、C3H6等与O2、O自由基等反应生成CO2、H2等组分。并且更多的氧化反应释放的热量使反应腔温度升高,导致反应物活性增加,从而进一步促进了重整反应的进行。虽然图3中H2含量呈下降趋势,但是由于空气流量的增加,导致N2含量和产物流量增加,使得H2的实际产生速率有一定增加(见图4)。当氧醇比为1.2时,产氢速率的最大值在标准状态下为1 200.26 L/h。
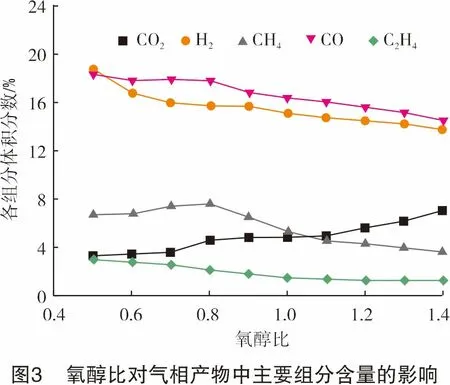
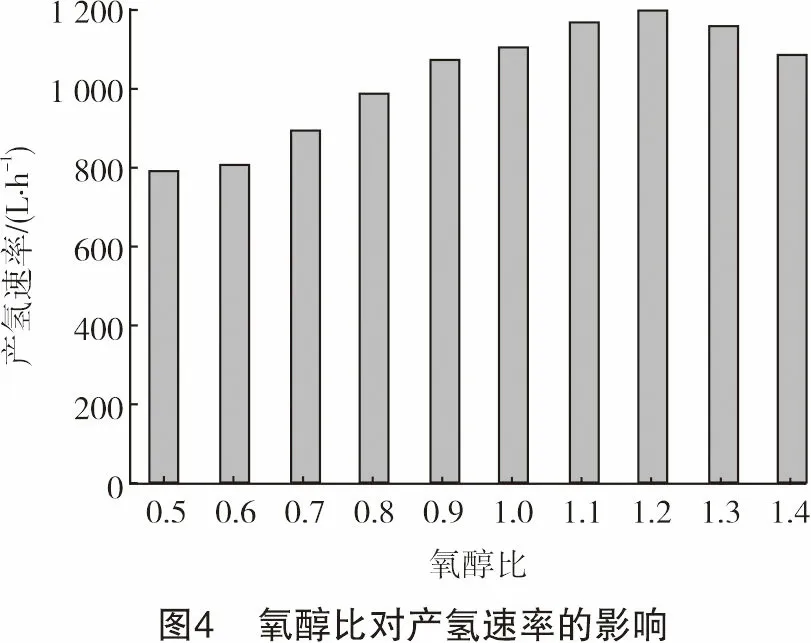
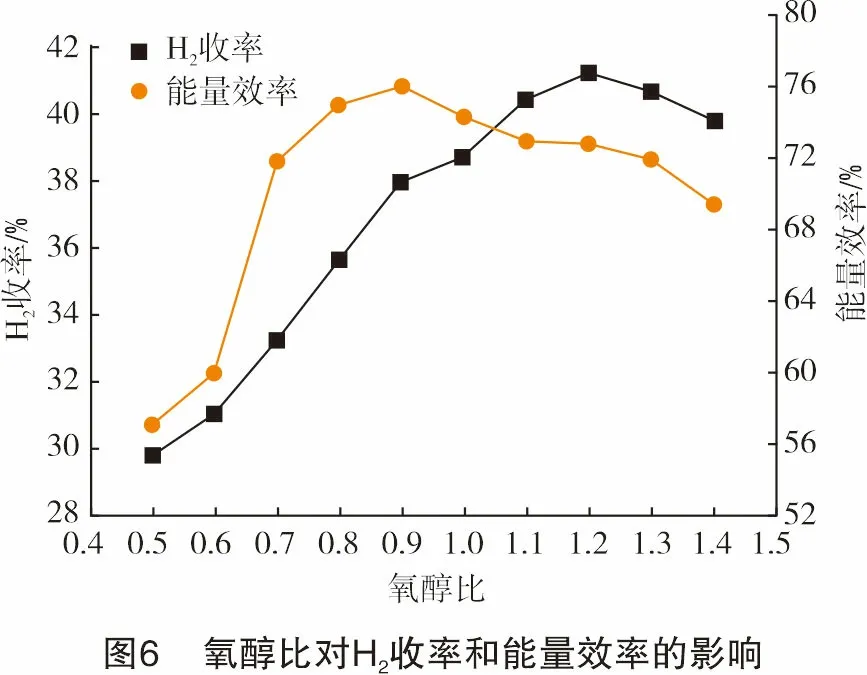
图5和图6显示了氧醇比对重整结果的影响。结果表明:乙醇转化率随着氧醇比的增加而增加,在氧醇比为0.9时,乙醇转化率达到了100%;H2选择性先降低后增加,最后又有所降低,在氧醇比为1.2时达到最大值50.01%;H2收率先增后减,最大值为41.21%;能量效率在氧醇比为0.5~0.9时增加了18.82%,最大值为75.99%。通过分析,其主要原因为在氧醇比较低时,初始反应物中O2含量较少,使得乙醇氧化程度较低,乙醇转化率、H2选择性、H2收率和能量效率都较低。随着氧醇比的增加,更多的O2被电离离解,生成更多O自由基、高能电子和激发态离子参与反应,使得乙醇和一些较大的分子被进一步氧化生成CO、CO2、H2等。当氧醇比超过0.9时,体系中发生了更多的氧化反应,释放出大量的热量,导致气相产物中各组分总发热量减少,能量效率降低;氧醇比过高时,过量的O和O自由基会与CO和H2发生反应,生成CO2、H2O,使得H2含量有所减少。

2.2 乙醇流量
图7和图8显示了在氧醇比0.9、放电间距2 mm、放电电压1.8 kV的条件下,重整结果随乙醇流量的变化。从图7和图8中可以看到,乙醇转化率和能量效率随着乙醇流量的增加先增加后降低,当乙醇流量为33.7~42.1 mL/min时,乙醇转化率达到100%。而H2选择性则和H2收率随着流量的增加不断降低。这是因为流量较小时,乙醇和空气混合气形成的涡旋气流强度较小,随炬端出来的上升气流较早地进入下反应腔,导致反应不够充分;当流量过大时,乙醇在等离子体反应区滞留时间较短,且流量过大使得反应腔内的热量被带走,导致反应腔温度和反应物的活性降低,从而使乙醇转化率降低。滞留时间的减少使得乙醇氧化程度较低,较大的分子如CH4、C2H4含量明显增加,H2选择性和H2收率下降,但高发热量组分含量的增加使得能量效率反而有所增加。


2.3 放电电压
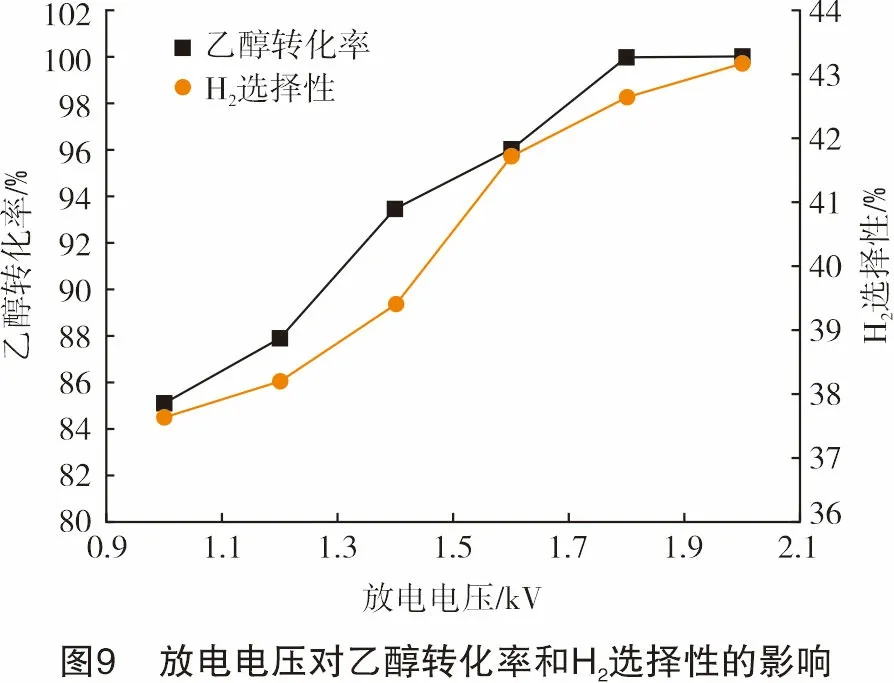
图9和图10显示了重整结果随放电电压的变化关系。乙醇转化率、H2选择性、H2收率、能量效率均随着放电电压的增加而提高。在放电电压达到1.8 kV后,能量效率有所降低,这是因为电压的增加使得设备功率、耗电增加,导致能量效率有所降低。放电电压为2.0 kV时,乙醇转化率达到100%,H2选择性为43.19%,H2收率为38.13%。这是由于随着放电电压的增大,放电区的能量密度、高能电子数、高能电子平均能量会增加。并且等离子体鞘层厚度也会随着放电电压的增加而增大,使得反应通道增加,增加了高能电子的碰撞几率,产生更多的高能电子和自由基,从而使更多的活性粒子参与制氢反应,使重整效果得到改善。

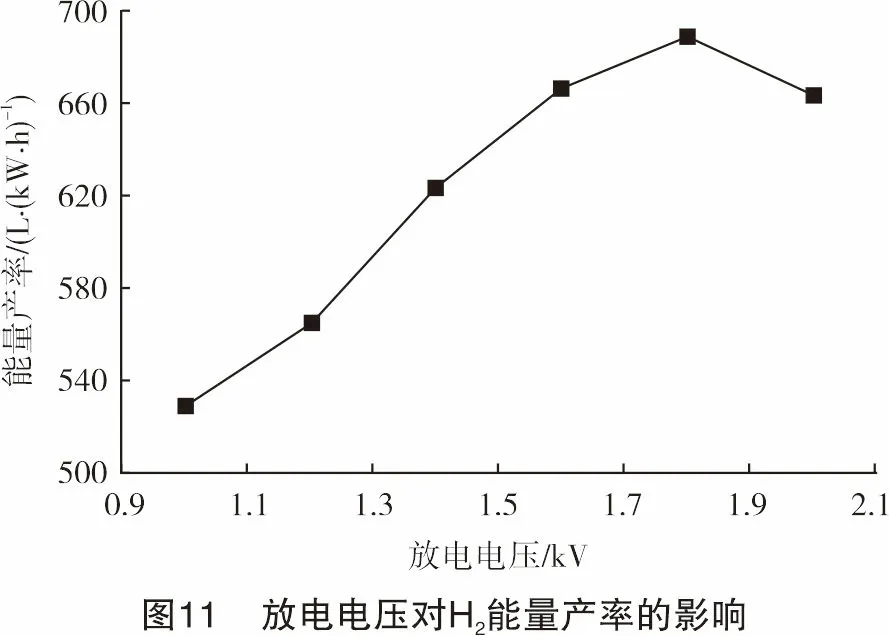
本研究还计算分析了放电电压对能量产率的影响,如图11所示。H2的能量产率先增加后有所降低,在1.8 kV时获得最大值687.94 L/kW·h,这在旋转弧等离子体小规模制氢和现场制氢领域属于较高水准。
2.4 放电间距
实验还研究了放电间距对重整结果的影响,如图12所示。随着放电间距的增大,乙醇转化率、H2选择性、H2收率和能量效率均有所增加。其主要原因是在相同流速下,放电间距增加,使得等离子体放电区域增大,即反应体积增大;停留时间增加,使得被电离离解产生的O自由基数量增加,提高了自由基碰撞的几率,促进了乙醇的分解和转化,因此重整效果有所改善。

但是放电间距的过度增大会使放电的平均电子能量降低,乙醇分解转化的程度较低,导致产物分子较大,因而C2及C2以上的烯烃类含量较高。实验发现,当放电间距超过3.5 mm时,旋转电弧会变得不稳定,甚至出现断弧的现象。因此,放电间距不宜过大,最佳放电间距为2.5 mm左右
3 结论
实验设计了1套气流驱动式旋转弧等离子体重整乙醇制氢的装置。对进气方式和积炭处理进行了优化设计。考查了氧醇比、乙醇流量、放电电压、放电间距对重整结果的影响,获得了如下结论:
(1)适当增加氧醇比可以提高乙醇转化率、H2选择性和H2收率,但是不宜超过1.2。当氧醇比为1.2时,产氢速率达到最大值1 200.26 L/h。
(2)乙醇流量的增加有利于提高能量效率,但不宜超过42.1 mL/min,否则会减少反应物的滞留时间,不利于重整。
(3)放电电压的提高对乙醇转化率、H2选择性、H2收率、能量效率均有积极影响,但是过高的电压会使耗电增加,降低能量效率。
(4)适当增加放电间距会增加反应物停留时间,提高重整效果。实验所得最高能量产率为687.94 L/kW·h。
(5)最佳实验条件为氧醇比1.1、乙醇流量33.7~42.1 mL/min、放电电压1.8 kV、放电间距2.5 mm,在该条件下能得到较好的重整效果。反应腔的设计有待进一步优化,H2与N2等副产物气体的高效分离也是后续需要考虑的问题。
