PI3KCA在子宫内膜癌中的表达及与临床病理特征的关系
2022-03-02马莹张哲曲章义韩旭
马莹,张哲,曲章义,韩旭
(1.哈尔滨医科大学附属第一医院妇科腔镜科,哈尔滨 150001; 2.哈尔滨医科大学公共卫生学院卫生微生物学教研室,哈尔滨 150001)
子宫内膜癌(endometrial carcinoma,EC)是一种常见妇科肿瘤,在多数欧美发达国家EC患者占妇科肿瘤总数的50%[1]。我国每年新诊断EC患者高达20万,因EC死亡患者数量亦逐年升高[2-3]。近年来的研究表明,磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B/哺乳动物雷帕霉素靶蛋白通路是一种与多种恶性肿瘤发生、发展及不良预后相关的信号转导通路,目前在非小细胞肺癌[4]、卵巢癌[5]、骨肉瘤[6]等中研究较多,主要通过影响细胞增殖、凋亡、侵袭、迁移以及促血管生成发挥相应作用[7]。PI3K在哺乳动物中可分为PI3KⅠ型、PI3KⅡ型、PI3KⅢ型3个亚型,其中PI3KⅠ型与肿瘤的关系最为密切,而PI3KCA主要编码PI3KⅠ型中参与恶性肿瘤发生发展的关键催化亚基p110α[8]。本研究旨在通过研究PI3KCA在EC组织中的表达情况及其与临床病理特征的关系,为判断EC患者病情严重程度以及预后提供帮助,并为EC的分子治疗奠定基础。
1 资料与方法
1.1一般资料 选择2017年9月至2019年9月在哈尔滨医科大学附属第一医院妇科住院治疗的83例EC患者作为EC组,选取同期83例子宫肌瘤患者作为子宫肌瘤组。纳入标准:①EC组经病理学检查确诊[9];②手术前未经过放化疗、免疫治疗及内分泌治疗。排除标准:①转移性EC;②合并其他恶性肿瘤;③长期使用糖皮质激素。EC组年龄37~70岁,平均(57±6)岁;淋巴转移情况:阳性33例、阴性50例;病理分级:低分化27例、中分化29例、高分化27例;肌层浸润深度:≥1/2 70例,<1/2 13例;国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期:Ⅰ期23例、Ⅱ期25例、Ⅲ期22例、Ⅳ期13例。子宫肌瘤组年龄40~69岁,平均(56±6)岁。两组年龄比较差异无统计学意义(P>0.05)。本研究经哈尔滨医科大学附属第一医院伦理委员会批准,患者均签署了知情同意书。
1.2方法
1.2.1反转录实时聚合酶链反应(polymerase chain reaction,PCR)检测 ①采用TRIzol法(Invitrogen®)提取标本的总RNA,采用Invitrogen®Qubit 4荧光计检测提取总RNA的浓度及纯度,检测合格后继续下游实验。②按照BcaBEST®RNA PCR Kit Ver.1.1说明,将总RNA反转录为互补DNA,反应条件:65 ℃ 1 min,30 ℃ 5 min,65 ℃ 30 min,98 ℃ 5 min,5 ℃ 5 min。③按照Bimake®2x SYBR Green反转录PCR master mix说明,以互补DNA为模板进行PCR扩增。甘油醛-3-磷酸脱氢酶及其引物均包含在试剂盒内。PI3KCA基因特异性引物由吉林库美生物科技有限公司合成,上游引物:5′-CTCTGAGGAGGTGGGTAG-3′,下游引物:3′-CGGTGGTCAGTTGAGTAA-5′。反应体系共25 μl:互补DNA模板4 μl,上下游引物各 1.25 μl,2x SYBR Green反转录PCR master mix 12.5 μl,双蒸水6 μl。使用美国Thermofisher ABI QuantStudio 1荧光定量PCR仪,反应条件:94 ℃ 30 s、54 ℃ 30 s、72 ℃ 2 min,以上40个循环,72 ℃ 5 min总延伸。④每个标本重复3次实验,记录Ct值,并取平均值,平均Ct值≤20为PI3KCA基因高表达,平均Ct值>20为PI3KCA基因低表达。另采用ΔΔCt法进行相对定量分析,根据Ct平均值以2-ΔΔCt表示PI3KCA基因的相对表达量。
1.2.2免疫组织化学检测 ①将石蜡包埋的标本切片,厚度4 μm,每个标本切5片。1片空白对照,1片苏木精-伊红染色,3片行免疫组织化学检测。②免疫组织化学按照SP法试剂盒(北京索莱宝科技有限公司,批号:SP0021)说明进行操作,石蜡切片经脱蜡、梯度乙醇水化、3%过氧化氢去除内源性过氧化物酶后,再用微波法进行抗原修复。利用山羊血清对石蜡切片封闭,然后滴加兔源PI3KCA相关蛋白(p110α)抗体(美国Affinity Biosciences公司生产,1∶5 000稀释),过夜孵育后滴加Bio-羊抗兔IgG(1∶100稀释)及链霉亲和素-过氧化物酶(1∶100稀释),二氨基联苯胺显色。③用Mayer′苏木精染色剂复染,脱水,封片。④用显微镜观察染色物质及其出现的位置及染色深度。无染色颗粒为PI3KCA相关蛋白不表达,浅黄色颗粒为PI3KCA相关蛋白低表达,棕黄色颗粒为PI3KCA相关蛋白中表达,褐色颗粒为PI3KCA相关蛋白高表达[10]。

2 结 果
2.1两组子宫内膜组织PI3KCA基因表达量比较 EC组子宫内膜组织PI3KCA基因表达量明显高于子宫肌瘤组[(1.24±0.24)比(0.26±0.11)](t=33.417,P<0.001)。
2.2EC组织中PI3KCA基因表达与临床病理学特征的关系 EC组织标本中,PI3KCA基因高表达率为51.8%(43/83),PI3KCA基因低表达率为48.2%(40/83)。不同淋巴转移情况、肌层浸润深度及FIGO分期的PI3KCA基因高表达率比较差异有统计学意义(P<0.05);不同病理分级的PI3KCA基因高表达率比较差异无统计学意义(P>0.05),见表1。

表1 EC组织中PI3KCA基因表达与临床病理特征的关系 [例(%)]
2.3两组PI3KCA相关蛋白表达阳性率比较 PI3KCA相关蛋白在EC细胞中主要表达于细胞质及细胞膜,见图1。EC组PI3KCA相关蛋白表达阳性率明显高于子宫肌瘤组[100.0%(83/83)比33.7%(28/83)](χ2=82.250,P<0.001)。

注:EC为子宫内膜癌图1 子宫内膜中PI3KCA相关蛋白(p110α)的表达 (Mayer′苏木精染色)
2.4EC组织中PI3KCA相关蛋白表达情况与临床病理特征关系 在EC患者子宫内膜组织标本中,PI3KCA相关蛋白高表达率为32.5%(27/83)、中表达率为25.3%(21/83)、低表达率为42.2%(35/83)。不同淋巴转移情况、肌层浸润深度及FIGO 分期的PI3KCA相关蛋白表达情况比较差异有统计学意义(P<0.05),不同病理分级的PI3KCA相关蛋白表达情况比较差异无统计学意义(P>0.05),见表2。
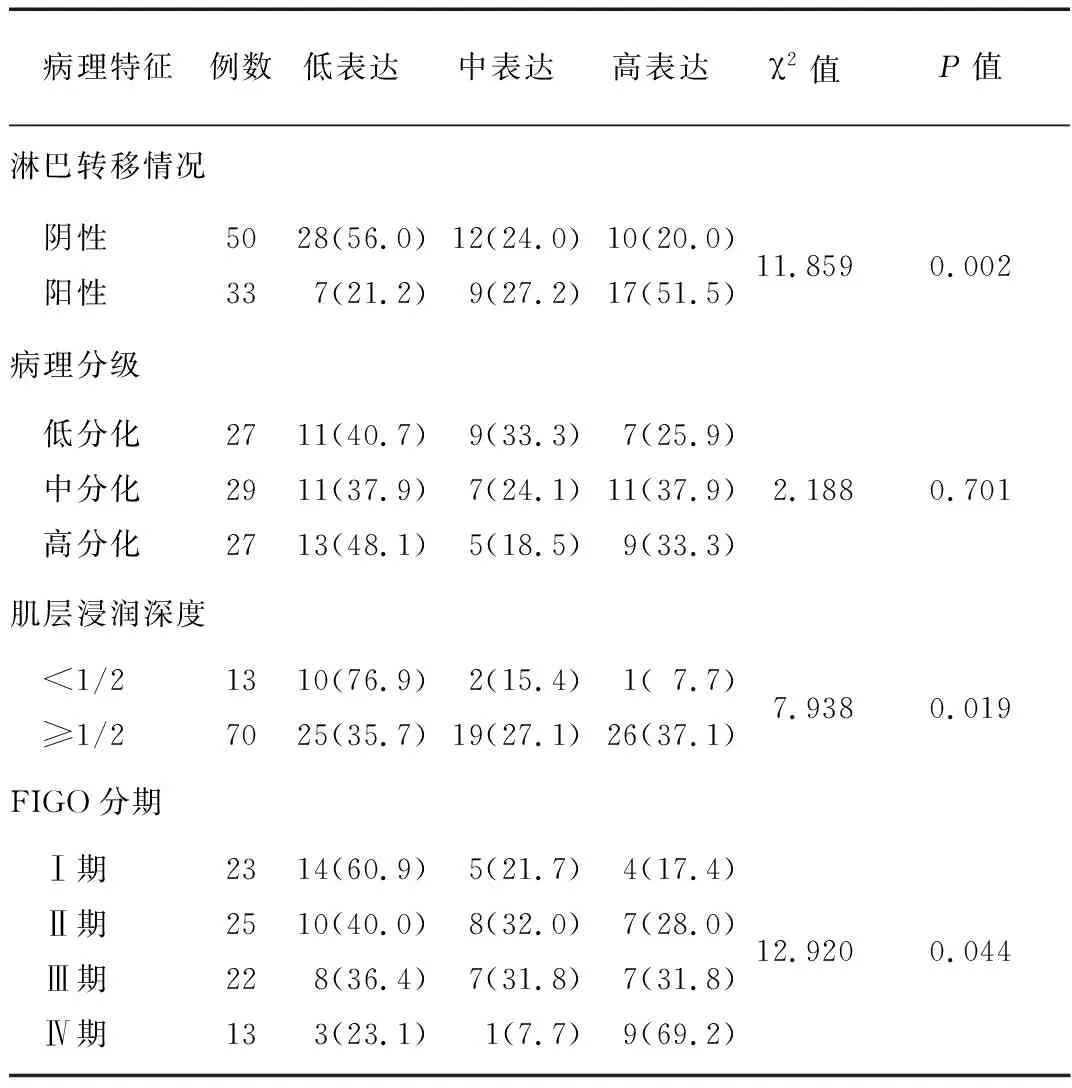
表2 EC组织中PI3KCA相关蛋白表达情况与临床病理特征的关系 [例(%)]
3 讨 论
绝经后女性是EC的主要发病人群,但近年20~44岁EC患者的比例逐渐升高,约7%[11]。EC发病率的升高及患病群体的年轻化迫切要求对EC病情进行精准判断,制订个体化的治疗方案[12]。因此,本研究从PI3K/蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号转导通路中编码PI3K的PI3KCA基因入手,观察PI3KCA在不同病情严重程度EC患者中表达量的差异,以期准确判断患者病情,从而延长患者生存期,改善预后。
PI3K/蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号转导通路在调控肿瘤细胞增生、细胞周期、细胞程序性死亡等方面发挥作用,其在多种恶性肿瘤中异常表达[13]。PI3KCA基因作为PI3K/蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号转导通路上游位点的重要调控基因之一,能够促进细胞产生恶性行为,PI3KCA基因主要通过其编码表达的催化亚基p110α蛋白发挥作用,p110α蛋白具有类脂激酶及蛋白激酶双活性[14-15],PI3KCA基因突变导致p110α蛋白过表达,进而导致下游激酶活性增加,PI3K/蛋白激酶B通路持续激活,最终产生癌变[16]。Denninghoff等[17]研究发现,PI3KCA是较常见的可发生突变的癌基因,因此目前对EC发生发展中PI3KCA基因重要作用的研究具有理论意义。
本研究结果显示,EC病情严重程度与PI3KCA表达量高度相关,在RNA以及蛋白质层面,PI3KCA基因及其编码表达的p110α蛋白的表达量随EC淋巴结转移范围扩大、肌层浸润深度增加、FIGO分期及病理分级升高而升高,表明PI3KCA基因在EC的发生发展过程中发挥重要作用。目前,对PI3KCA基因在人类恶性肿瘤发生发展中作用的研究逐渐增多,以胆管癌、肺癌及乳腺癌等为主[18],对EC的相关研究有限。本研究中,未发现PI3KCA基因表达量与EC临床病理分级之间的明显相关性,但并不说明两者完全没有关联,其原因可能与本研究纳入样本量有限、病理类型主要为子宫内膜样腺癌有关,尚不能排除不同病理类型导致研究结果的差异,需要进一步探索。
随着分子生物学的发展,对于肿瘤研究的重点逐渐倾向于分子靶向治疗,准确找到有效的分子靶点,针对靶点精准用药可提高治疗效果。本研究结果显示,PI3KCA表达量与EC患者病情的严重程度相关,因此针对该基因位点进行靶向治疗,可能在很大程度上改善患者的预后。研究发现,顺铂可能通过抑制PI3K通路诱导EC细胞发生自噬[19],而PI3KCA是PI3K通路重要的上游基因。同时,PI3KCA可通过磷酸化BAD蛋白及胱天蛋白酶9阻止细胞凋亡[20],抑制糖原合成酶激酶-3β的活性,从而阻止G1/S-特异性周期蛋白D1的降解,促进肿瘤G1/S细胞周期的转化[21],上述研究结果在细胞自噬、凋亡以及细胞周期调控方面均为EC患者的治疗提供了新的分子生物学思路。曹海敬等[22]证明,PI3KCA基因突变可使下游通路活化,进而抑制细胞程序性死亡,使细胞无限繁殖产生癌变,因此针对PI3KCA基因的抑制剂研究具有重要临床意义。目前,许多P13KCA基因抑制剂进入临床试验阶段[23],但标准化的用药方案及治疗效果尚不确切,且人第10号染色体缺失的磷酸酶及张力蛋白同源基因突变患者的PI3KCA基因突变率较高[24],因此PI3KCA抑制剂与多种药物联合治疗肿瘤可能成为未来的研究方向。目前,中国科学院开发的PI3Kα抑制剂已获得美国食品药品管理局的临床试验许可,计划用于实体肿瘤的晚期治疗[25],这为EC的治疗提供了可行性。本研究利用相应的试验室技术分别在蛋白质和RNA层面证明了PI3KCA参与EC的发生发展过程,验证了PI3KCA与EC临床病理特征的关系,说明PI3KCA是一种具有潜在治疗价值的靶向位点,但尚有许多问题需进一步探索。
综上所述,EC组织PI3KCA表达量高于正常子宫内膜组织,且PI3KCA表达与EC的临床病理学特征有一定的相关性。
