人类糖脂转运蛋白家族成员在疾病发生发展中的作用
2022-03-02张湘豫卢梦云邹先琼
张湘豫,卢梦云,邹先琼
(1.桂林医学院附属口腔医院口腔医学研究所,广西 桂林 541004; 2.桂林医学院基础医学院,广西 桂林 541004)
鞘脂属于一类脂质,最初被描述为细胞膜结构的主要组成部分,它们普遍存在且高度保守;鞘脂及其代谢产物是多种生理和生物活性的关键调节因子,如神经酰胺、鞘氨醇-1-磷酸、神经酰胺-1-磷酸(ceramide-1-phosphate,C1P),能参与细胞增殖、生存、胚胎发育、器官形成和免疫细胞活动调节等重要生理功能,并参与了多种病理过程,特别是一些炎症反应或相关的疾病[1-2]。此外,鞘脂含量或活性的改变在癌细胞代谢中发挥重要作用。糖脂转运蛋白(glycolipid transfer protein,GLTP)被认为在葡萄糖神经酰胺代谢中发挥作用,其过表达导致细胞内葡萄糖神经酰胺的合成和转移显著增加[3]。而神经酰胺的处理不仅能部分阻断由于转录因子特异性蛋白(specificity protein,Sp)1及Sp3敲除引起的启动子活性下调,也能改变Sp1/Sp3与GLTP基因启动子的亲和性以及减少Sp3的乙酰化[4]。GLTP家族成员对于维持细胞内鞘脂的稳态极其重要,因此阐明GLTP家族成员的生物学功能对炎症、肿瘤等相关疾病的防治具有重要意义[5]。已有文献报道了一些GLTP家族成员的结构和生物学功能[6-8]。但GLTP家族成员在炎症、肿瘤等疾病发生发展中的作用及其机制尚不清楚。现就人类GLTP家族成员的结构、功能及其在疾病发生发展中的作用予以综述。
1 GLTP家族成员的结构和功能
为维持细胞内外脂质平衡稳定,脂质在细胞内通过囊泡和非囊泡的机制转运至生物膜[5]。而脂质膜间运输的非囊泡机制主要依赖脂质转运蛋白,脂质转运蛋白在与特定膜的瞬时相互作用中获取并传递其特定的脂质,脂质转运蛋白只是暂时黏附在脂质膜上,在转移过程中可作为脂质分子增溶剂包裹不溶性脂质来发挥作用[5]。研究发现,糖鞘脂(glycosphingolipids,GSLs)转移蛋白家族成员共享一种独特的结构折叠,称为 GLTP折叠[9]。GLTP折叠是一种新颖的外周两性折叠和结构上独特的脂质结合基序,GLTP具有独特的α-螺旋构象,排列在一个两层“三明治”基序中,这种“三明治”状结构被认为是真核生物GLTP家族的结构基础,形成单一的“口袋状”糖脂结合位点,即GLTP折叠(图1),具有GLTP折叠的蛋白即GLTP家族成员[5,9-11]。GLTP家族的重要成员包括磷脂酰肌醇-4-磷酸衔接蛋白(phosphatidylinositol-4-phosphate adaptor protein,FAPP)2、人1-磷酸神经酰胺转移蛋白(ceramide-1-phosphate transfer protein,CPTP)、促细胞死亡蛋白11及GLTP家族的一个新成员——人类糖脂转运结构域2蛋白(glycolipid transfer protein domain containing protein 2,GLTPD2)[6,12]。其中,FAPP2不仅可以转运葡萄糖神经酰胺,还可以转运半乳糖神经酰胺和乳糖神经酰胺,而CPTP和促细胞死亡蛋白11能选择性结合或转移C1P[13]。同时,促细胞死亡蛋白11是自主神经酰胺水平的中间调节蛋白[14]。GLTP家族成员作为可以转运某些鞘脂功能的蛋白在细胞功能代谢中起着至关重要的作用,因为鞘脂参与了细胞重要的代谢过程。从真菌到人类均存在GLTP家族成员,证明了GLTP家族的重要性[5]。由于GLTP家族成员与肿瘤、炎症性疾病、神经退行性疾病等密切相关,因此探索GLTP家族成员的功能与疾病的作用关系,对这些疾病的防治具有重要意义。

图1 糖脂转运蛋白蛋白空间结构(PDB:1SX6)
2 GLTP家族成员与疾病的关系
有研究表明,GLTP家族成员参与了炎症性疾病、肿瘤、神经退行性疾病等的发生发展过程[15-17]。因此,阐明GLTP家族成员的生物学功能及其在疾病发生发展中的作用具有重要意义。
2.1GLTP 人类GLTP是一种小的(分子量为24 000)两性可溶性蛋白,介导各种GSLs的非囊泡状转运[6,10,18]。然而,迄今为止决定GLTP选择性转运特定GSLs的机制尚不清楚[18]。通过对GLTP的动力学研究表明,GLTP的作用不是GLTP分配于供体囊泡表面,而是通过转移到膜界面,GLTP及时发现并识别GSLs上的糖基部分,然后形成GLTP-GSLs复合物,进而释放到受体上并完成GSLs在膜间转移[6,19](图2)。

注:GLTP为糖脂转运蛋白,GSLs为糖鞘脂,GLTP-GSLs Complex in solution为游离的糖脂转运蛋白-糖鞘脂复合物,Glycolipid为糖脂类,Phosphoglyceride为磷酸甘油酯,Cytoplasm为细胞质图2 GLTP介导的体外GSLs膜间转移模型
通常,细胞形状改变是细胞程序性死亡过程的表型指标,而人类GLTP基因表达的改变,不仅改变了细胞与细胞接触和表面黏附的某些GSLs的稳态水平,而且还调节了某些人癌细胞株的细胞形状变化,从而诱导了细胞程序性坏死的发生发展[5]。表达δ联蛋白可诱导树突生长,而GLTP基因与δ联蛋白共表达可加速细胞向圆形形状的转变,这些发现是已知的首次由GLTP基因过表达引发的表型变化,并通过与p120联蛋白家族成员的直接相互作用进行调控[20]。研究发现,在被活化的β联蛋白转化的小鼠乳腺上皮细胞中,GLTP基因的表达也会受到影响[21]。同时,通过双氯醇上调GLTP与丙型肝炎病毒(hepatitis C virus,HCV)非结构5A蛋白(non-structural 5A protein,NS5A)竞争结合宿主囊泡相关膜蛋白相关蛋白A(vesicle-associated membrane protein-associated protein-A,VAP-A),导致VAP-A和HCV NS5A之间的复合物形成中断,由于VAP-A/NS5A复合物的形成对病毒RNA的复制至关重要,因此GLTP降低了VAP-A/NS5A复合物的水平,从而抑制了HCV的复制[22]。研究证明,GLTP过表达能上调细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)抑制因子1A(p21)及1B(p27),下调CDK2和CDK4、细胞周期蛋白E和细胞周期蛋白D1,进而阻滞细胞周期于G1/S检查点,诱导细胞程序性坏死,从而抑制人类结直肠癌HT-29细胞的生长[17]。同时,GLTP参与了一种罕见的神经退行性疾病中的中枢神经系统的髓鞘增生,该增生是C型尼曼-皮克病最明显的病理特征之一[23]。有学者通过微阵列分析发现,GLTP基因是6 000个经筛选的乳腺组织互补DNA克隆中的12个基因之一,这些克隆在经过部分或完全转分化为鳞状化生的转化小鼠乳腺上皮中转录上调[6]。在不影响结直肠癌HT-29细胞神经酰胺水平的情况下,GLTP基因上调可导致鞘氨醇-1-磷酸水平降低,而鞘氨醇-1-磷酸是调节细胞生长和抑制细胞凋亡的信号分子[4]。以上研究表明,GLTP与细胞周期及细胞程序性坏死密切相关,在丙型肝炎、神经退行性疾病、结直肠癌等疾病的发生发展中发挥重要作用。
2.2FAPP2 人类FAPP2是FAPP成员,具有Pleckstrin同源结构域,其基因位于染色体7p21,由519个氨基酸组成[16]。FAPP2定位于高尔基体反式面,可以将葡萄糖神经酰胺从高尔基体转运到内质网,在复杂GSLs的合成中发挥关键作用[24]。同时,FAPP2-GLTPH结构揭示了一种控制GLTP家族特异性的元素,称为ID环(individual or identification loop)。不同的ID环有不同的识别中心,可在家庭成员中产生不同的特异性[11,25]。
FAPP2在GSLs的代谢中发挥了重要作用,该蛋白与程序性细胞死亡过程的调节密切相关[5]。细胞凋亡是细胞死亡的一种特殊形式,它发生在正常和病理过程中,可由多种刺激引起[23]。通过干扰小RNA沉默FAPP2基因增强了抗Fas肿瘤细胞对Fas/Fas配体诱导的凋亡的敏感,其中Fas和Fas配体是肿瘤坏死因子死亡受体/配体家族成员,Fas配体与表达Fas的细胞结合可触发其凋亡[26-27](图3)。FAPP2基因已初步被血清学鉴定为潜在的乳腺癌抗原,很可能与乳腺癌密切相关[27-29]。FAPP2基因在结肠癌肿瘤组织中的表达增加,而FAPP2基因的表达下调抑制了结肠癌细胞的生长;同时研究发现,Wnt/β联蛋白信号通路参与了FAPP2调控的肿瘤细胞生长,提示FAPP2可能作为癌基因调控肿瘤生长[30]。研究证明,利用CRISPR/Cas9(clustered regularly interspaced short palindromic repeats/CRISPR-associated protein 9)基因编辑技术敲除FAPP2基因能够通过下调Wnt/β联蛋白信号通路抑制肝癌细胞的增殖和侵袭,因此FAPP2基因被认为是一种与肿瘤发生密切相关的肿瘤相关调节因子[16]。研究发现,在HCV感染致病过程中,HCV NS5A会激活磷脂酰肌醇-4-激酶,导致磷脂酰肌醇-4-磷酸(phosphatidylinositol-4-phosphate,PI4P)脂质的大量生产和再分配到复制复合物中,PI4P招募宿主效应子来调节HCV基因组复制或病毒粒子的产生,而FAPP2具有对PI4P和糖脂的特异性功能脂质结合域,因此PI4P结合FAPP2的表达可抑制HCV复制,同时糖脂结合FAPP2蛋白导致复制效率显著下降,表明这两个结构域对FAPP2在HCV基因组复制中的作用均至关重要[31]。以上研究表明,FAPP2在细胞程序性死亡过程中具有重要的生物学功能,与丙型肝炎、肝癌、结肠癌等疾病的发生发展密切相关。
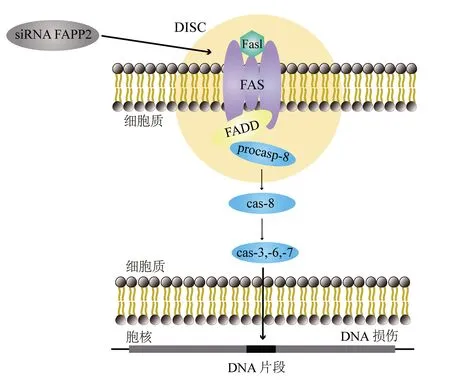
注:siRNA为干扰小RNA,FAPP2为磷脂酰肌醇-4-磷酸衔接蛋白,DISC为死亡诱导信号复合体,FasL为Fas配体,FADD为Fas相关死亡结构域蛋白,procasp-8为无活性的胱天蛋白酶8,cas为胱天蛋白酶图3 FAPP2基因在肿瘤细胞中对Fas诱导的凋亡的模式图
2.3CPTP 人类CPTP是由GLTPD1编码的一种蛋白质,已被证明能形成GLTP折叠,其特征是修饰的
GLTP折叠层选择性地结合C1P,而不是GSLs、神经酰胺或其他具有磷酸头基的脂类[10,32]。C1P是由神经酰胺经位于反式高尔基体的神经酰胺激酶磷酸化而成的一类重要鞘脂分子,其通过与细胞膜上的Gi蛋白结合介导多条信号通路,从而产生诱导细胞增殖、干细胞动员、巨噬细胞迁移、诱导自噬介导的促炎细胞因子以及激活IVA胞质型磷脂酶A2α(cytosolic phospholipase A2α,cPLA2α)产生二十烷类化合物等生物活性作用[33-34]。IVA cPLA2α和二十烷类化合物被认为在炎症和细胞损伤中发挥重要作用,C1P积累和IVA cPLA2α的激活导致花生四烯酸和促炎症类花生酸的产生[34]。
CPTP是早期自噬体组装和炎症小体驱动的促炎细胞因子生成和释放的内源性调节因子,但不是细胞凋亡的内源性调节因子,同时宫颈癌细胞系HeLa、人肾上皮细胞系HEK-293T以及单核巨噬细胞均表现出CPTP诱导的自噬,在单核巨噬细胞中,炎症小体组装和胱天蛋白酶1的强烈激活伴随两种促炎细胞因子(白细胞介素-1B和白细胞介素-18)的释放显著增加[1,33,35-36](图4)。研究发现,下调CPTP基因可导致人肺癌A549细胞中促炎症花生酸的产生[32]。在重症胰腺炎中,CPTP基因可能通过下调IVA cPLA2α的表达影响紧密连接相关蛋白(即闭合小环蛋白1)的表达,保护肠上皮屏障;紧密连接是调节肠道通透性的结构基础,可能在细菌易位中发挥重要作用[37]。近年研究表明,在结直肠癌SW480细胞、乳腺癌中,CPTP是肿瘤抑制因子微RNA(microRNA,miRNA/miR)-328的直接作用靶点[38]。且已有文献报道,miR-328在许多肿瘤中低表达,提示CPTP可能通过靶向miR-328作用于肿瘤细胞而发挥抗肿瘤作用[39]。以上研究表明,CPTP在自噬体组装和炎症小体的形成中发挥了重要的生物学功能,且与炎症性疾病、胰腺癌、乳腺癌等疾病的发生发展密切相关。

注:CPTP为人1-磷酸神经酰胺转移蛋白,C1P为神经酰胺-1-磷酸,CERK为神经酰胺激酶,Cer为神经酰胺,NLRP3为核苷酸结合寡聚化结构域样受体蛋白3,caspase-1为胱天蛋白酶1,IVA cPLA2α为IVA胞质型磷脂酶A2α,AA为花生四烯酸,Pro为前体,IL为白细胞介素,SPT为丝氨酸棕榈酰转移酶,A-SMase为酸性鞘磷脂酶,ERK为胞外信号调节激酶,NF-κB为核因子κB,MEK为促分裂原活化的蛋白激酶激酶,MMP为基质金属蛋白酶图4 CPTP缺失诱导炎症小体的激活及C1P在哺乳动物细胞中的生物学功能
2.4GLTPD2 人类GLTPD2是GLTP家族的一个新成员,GLTPD2基因最初是由计算机生成的人类基因组注释预测出来的[5]。有研究通过聚合酶链反应分析发现,GLTPD2信使RNA在肝脏组织中高表达[5,12]。GLTPD2基因是一种蛋白质编码基因,与该基因有关的基因本体论注释包括糖脂结合和GLTP活性,其重要旁系同源物为CPTP[5]。人类GLTPD2的GLTP结构域位于102~252氨基酸残基,1~36氨基酸残基为N端信号肽,13~32氨基酸残基为跨膜区,人类GLTPD2分子量为31 600,等电点为10.19[6]。有研究表明,人类GLTPD2与肝、肠、肾等器官的功能及疾病的发生发展密切相关[12]。GLTPD2基因是新生小鼠坏死性小肠结肠炎中上调程度最高的15个基因之一,也是单聚体而非五聚体C反应蛋白处理内皮祖细胞时上调程度最高的12个基因之一,五聚C反应蛋白与单体C反应蛋白的分离被认为参与了动脉粥样硬化斑块发生部位的局部促炎症反应[40-41]。在一项全基因关联研究中,GLTPD2基因被确定为35个脂类相关基因位点中与心血管疾病风险相关的10个基因变体之一[41]。以上研究表明,GLTPD2与小肠结肠炎、心血管疾病等疾病的发生发展密切相关。
3 小结与展望
GLTP家族成员的鞘脂代谢“传感器”功能极其重要,因为鞘脂参与了细胞的生死过程,即细胞增殖、分化、发育、凋亡、自噬、炎症、焦亡、坏死等重要的生物学功能[5]。进化修饰导致GLTP折叠对C1P具有特异性(如CPTP)或对GSLs具有可变选择性(如FAPP2和GLTP),而这些GLTP家族成员由不同人类染色体上具有不同内含子、外显子组织的单拷贝基因编码[10]。虽然关于GLTP及其相关的GLTP同源蛋白的结构、功能和基因组方面已有了较多研究,但这些胞质两性鞘脂转运蛋白在体内的功能仍不清楚[10,18,20,34]。
由于还有许多新的GSLs转运蛋白成员尚未被发现,因此对鞘脂信号调控癌细胞信号转导和代谢机制的进一步了解将有助于改进癌症的治疗方式[42]。了解鞘脂信号在与肿瘤微环境(包括基质细胞、内皮细胞、破骨细胞或血小板)中相关的肿瘤和宿主细胞之间通讯调控中的作用,将有助于开发新的治疗策略来抑制癌症的生长、增殖和转移[2,6]。此外,还需要更多研究来探讨如何改变鞘脂信号,以增加T细胞的抗肿瘤功能,并降低骨髓源性抑制细胞和肿瘤相关巨噬细胞的抑制功能,提高免疫治疗的抗癌效果[42-43]。因此,寻找新的GSLs转运蛋白对未来相关疾病的预防、诊断及治疗非常重要。
已知GLTP家族成员在细胞周期、细胞程序性坏死、自噬体组装和炎症小体形成等生物学过程中发挥了重要作用,并与丙型肝炎、神经退行性疾病、结直肠癌、肝癌、乳腺癌、小肠结肠炎、心血管疾病等的发生发展密切相关。这些研究为今后涉及人类健康和疾病中的GLTP的跨学科、转化医学研究开辟了新途径,如有针对性地调控特定的GLTP家族成员的表达水平,进而影响细胞内特异鞘脂的水平,作为相关疾病防治的有效手段。相信随着研究的不断深入,更多GLTP蛋白家族成员将会被发现,而阐明其生物学功能及其在疾病发生发展中的作用将为人类最终战胜这些疾病做出重要贡献。
