反应性星形胶质细胞在中枢神经系统疾病中的作用
2022-03-02王若儒李媛媛黄韦华孙旭黎佳思
王若儒,李媛媛,黄韦华,孙旭,黎佳思
(海军军医大学第一附属医院 a.神经内科,b.输血科,上海 200433)
星形胶质细胞是中枢神经系统(central nerve system,CNS)中最丰富的细胞之一[1]。研究发现,星形胶质细胞的功能是动态的,其可根据不同的时间点、触发因素或反应途径改变自身功能,从而产生截然不同的生物学效应;在CNS损伤刺激下,某些星形胶质细胞的基因表达会发生改变,因基因表达改变而失去原有功能或获得其他功能的星形胶质细胞被称为反应性星形胶质细胞(reactive astrocytes,RAS)[2]。在CNS损伤、感染性疾病、肿瘤、脑血管病、癫痫、神经退行性疾病以及炎性脱髓鞘疾病中,RAS表达均显著上调并参与疾病的发生发展过程[3-5]。动物实验表明,RAS至少存在两个亚型,即由炎症刺激(脂多糖)诱导的A1型RAS(经典表型)和由缺血(大脑中动脉闭塞)刺激诱导的A2型RAS(替代表型);A1型RAS通过分泌细胞毒性物质诱导神经元和少突胶质细胞死亡,起到损伤作用;A2型RAS通过释放神经营养因子和其他保护因子促进神经元存活,具有修复功能[2]。现就RAS在CNS疾病中的作用予以综述。
1 RAS概述
20世纪70年代,人类首次从部分星形胶质细胞中发现胶质纤维酸性蛋白,并首次提出RAS[6]。人们普遍认为,RAS由星形胶质细胞受到刺激后增殖产生,其可在损伤组织周围形成瘢痕组织,从而在CNS疾病急性期发挥保护作用,在慢性期发挥损害作用[7]。Zamanian等[8]通过分析纯化小鼠RAS基因图谱发现,不同刺激可诱导形成两类具有不同功能的RAS。因此,将RAS定义为对不同类型损伤刺激产生具有高度异质性反应的星形胶质细胞[2]。抑制A1型RAS的产生可减少其细胞毒性作用、促进A2型RAS的产生,放大其保护性作用,已成为目前CNS疾病治疗的新方向。
1.1RAS的功能 在CNS受到损伤刺激后,星形胶质细胞在分子以及细胞层面发生相应改变形成RAS,并非仅仅外形改变。RAS的功能随着损伤种类和严重程度的不同而变化,RAS被激活的过程由细胞间和细胞内信号分子以及机体内环境共同诱导。
1.1.1RAS的保护作用 RAS的保护作用主要包括:①通过谷胱甘肽合成酶调节谷胱甘肽的产生,抑制神经元的氧化损伤[9];②通过表达缝隙连接蛋白43等促进腺苷释放,保护神经[10];③降低氨离子的毒性作用[11];④通过降解β淀粉样蛋白保护神经[12];⑤维护血脑屏障功能并促进血脑屏障修复[13];⑥分泌转化生长因子-β,促进神经元存活和轴突再生[14];⑦抑制炎症细胞或炎症反应由损伤区域向健康CNS实质扩散[15]等。
1.1.2RAS的损伤作用 RAS的损伤作用主要包括:①通过产生白细胞介素(interleukin,IL)-1α、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6、诱导型一氧化氮合酶等炎症因子加剧炎症反应[2];②产生血管内皮生长因子等细胞因子,损害血脑屏障功能[16];③过度激活水通道蛋白4,引起细胞毒性水肿[17];④影响兴奋性氨基酸转运蛋白1释放潜在的兴奋性毒性谷氨酸[18];⑤通过CXC趋化因子配体12/CXC趋化因子受体4介导炎症性疼痛[19]等。
1.2RAS的分型 研究发现,RAS在CNS疾病早期主要发挥保护作用,在疾病晚期主要发挥损伤作用[13]。但有研究显示,RAS在急性炎症早期具有损伤作用,而在帕金森病(Parkinson′s disease,PD)等慢性疾病中具有保护作用[20]。Han等[21]通过颅内注射提取自大肠埃希菌O55:B55的脂多糖诱导RAS产生。随后,Zamanian等[8]通过闭塞成年雄性小鼠大脑中动脉诱导短暂缺血的方式诱导RAS产生。基因检测显示,A1型RAS与A2型RAS的基因表达差异明显,在脂多糖诱导的RAS中有57个基因表达上调,但这些基因并未在大脑中动脉闭塞诱导的RAS中过表达;在大脑中动脉闭塞诱导的RAS中有150个基因表达上调,在脂多糖诱导的RAS中则未见这些基因过表达[1,8]。Liddelow等[3]参照巨噬细胞命名方法,将神经炎症诱导的RAS命名为A1型(经典表型),将缺血诱导的RAS命名为A2型(替代表型),并根据其基因表达水平将C3d和S100A10分别作为A1型和A2型RAS的标志物。两种RAS表型参与的具体信号通路见表1。

表1 RAS分子表达的变化

续表1
1.2.1A1型RAS A1型RAS的特点主要包括:①星形胶质细胞在活化为A1型RAS的过程中自身突触减少,提示其促突触功能可能丧失或已产生突触毒性[2];②A1型RAS可上调补体级联基因的表达,同时还可分泌可溶性毒素或上调人脂质运载蛋白2、IL-1α、补体1q、TNF-α、γ干扰素、前列腺素D2等的表达[13,28],提示其具有神经毒性;③A1型RAS清除髓鞘碎片的能力存在缺陷,影响体内突触修剪的效率[22]。研究表明,在中枢神经损伤后,A1型RAS主要由IL-1α、TNF-α和补体1q诱导产生,且IL-1α、TNF-α和补体1q水平均与小胶质细胞的激活呈正相关;将IL-1α、TNF-α和补体1q的中和抗体联合注射入视神经受挤压小鼠的玻璃体,以抑制A1型RAS的形成,结果发现视网膜神经节细胞死亡显著减少[3,15]。另有研究表明,核因子κB可激活A1型RAS并释放补体C3[22],从而进一步激活转化生长因子-β信号通路[37]、Notch-少突胶质细胞转录因子2信号通路以及Rac-谷光氨肽S-转移酶Pi信号通路,调节A1型RAS的增殖[38]。目前对A1型RAS的研究多侧重于其功能,而其极化过程以及在CNS疾病中的作用仍需进一步探究。
1.2.2A2型RAS 目前关于A2型RAS的研究相对较少。基于RAS由小胶质细胞激活的理论推测,激活M2型小胶质细胞的IL-4、IL-10等细胞因子或免疫复合物+脂多糖也可激活A2型RAS[2]。实验证明,IL-4、IL-10或免疫复合物+脂多糖可诱导具有保护作用的RAS形成,这种RAS可分泌神经营养因子、血管内皮生长因子、碱性成纤维细胞生长因子等,保护神经元[23,39]。还有研究显示,缝隙连接蛋白30可调节A2型RAS的形成[40]。目前关于A2型RAS诱导过程尚不明确,且标志物S100A10特异性较低,因此无法有效纯化、提取A2型RAS。因此,关于A2型RAS的产生以及其保护性功能的维持仍需进一步研究。具体的RAS分型见图1。
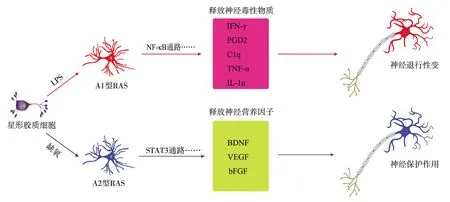
注:LPS为脂多糖,RAS为反应性星形胶质细胞,NF-κB为核因子κB,STAT3为信号转导及转录激活因子3,IFN-γ为γ干扰素,PGD2为前列腺素D2,C1q为补体1q,TNF-α为肿瘤坏死因子-α,IL-1α为白细胞介素-1α,BDNF为脑源性神经营养因子,VEGF为血管内皮生长因子,bFGF为碱性成纤维细胞生长因子图1 RAS分型
2 RAS在CNS疾病中的作用
研究表明,RAS在神经创伤、局灶性脑缺血/脑出血[41]、癫痫[42]、原发性或继发性中枢神经肿瘤[43]、阿尔茨海默病(Alzheimer′s disease,AD)[44]、PD[45]、多发性硬化(mutiple sclerosis,MS)[46]、肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)[37]等疾病中均具有重要作用。
2.1脑卒中 脑卒中具有高发病率、高致残率、高复发率、高病死率等特点,给社会和家庭带来沉重的经济和精神负担。脑缺血后,损伤组织释放TNF-α、IL-1β等促炎细胞因子,激活RAS[47]。RAS可在脑卒中早期清除坏死组织碎片、分泌胶质源性神经营养因子,促进神经再生[48]。大量RAS通过以下途径抑制脑卒中后神经修复①激活核因子κB通路促进神经元凋亡;②分泌硫酸软骨素蛋白多糖抑制神经元再生;③减少谷氨酸摄取促进神经元死亡;④形成胶质瘢痕限制神经修复[26,49]等。而前角蛋白、排斥导向分子A、转化生长因子-β等信号通路可逆转RAS对缺血性脑卒中预后的不利影响[50]。蛛网膜下腔出血小鼠脑中RAS数量与出血的严重程度呈正相关[22]。脑出血后,RAS可通过下调谷氨酸转运体1表达、过表达内皮素1,影响损伤脑区的神经血管偶合,导致迟发性脑缺血的发生或预后不良[51]。研究还发现,在脑出血后第3天RAS即可分泌骨桥蛋白,对血脑屏障起到保护作用[41]。脑卒中可影响大脑的神经元、胶质细胞、内皮细胞和室管膜细胞等,但大多数临床试验侧重于对神经元的保护治疗,且未能在临床上形成有效治疗,而RAS与神经元和血管系统均密切相关,其功能改变对脑卒中后血供恢复和功能修复均具有重要意义。因此,进一步深入研究RAS在脑卒中后的作用机制,抑制其有害作用、促进其保护作用,可能为脑卒中的治疗提供新途径[15]。
2.2AD AD以记忆丧失和认知功能障碍为特征,临床表现为神经精神症状和行为障碍[46]。AD的病理特征包括老年斑、神经元纤维缠结和广泛的神经元缺失。研究表明,RAS是神经斑块的重要组成部分,其数量增加程度与认知功能降低相关[45]。正常情况下,星形胶质细胞是大脑炎症反应的主要调节者,但在病理条件下,RAS在产生炎症因子和活性氧类时可能会形成神经毒性[52]。实验观察发现,AD小鼠海马RAS中的S100β、谷氨酸转运体1水平均降低,导致组织促炎细胞因子水平升高,进而导致脑内炎症损伤[52-53]。以上研究表明,通过阻断AD小鼠大脑RAS的能量代谢和氧化应激,可减少小鼠炎症反应和β淀粉样蛋白斑块沉积,从而改善小鼠记忆并延缓疾病进展。另一项关于AD患者脑和脑脊液蛋白质组学分析显示,AD患者存在星形胶质细胞代谢异常[54],而星形胶质细胞是脑内基础代谢的主要组成部分[55],因此未来深入研究RAS的异质性可以为AD的治疗提供新思路。
2.3PD PD是一种由基底节多巴胺能神经传递中断和黑质神经元死亡引起的进展性神经退行性疾病,其病理特征为神经细胞胞质中存在α-突触核蛋白沉积和蛋白质包涵体。研究发现,PD患者黑质致密部及病变组织周围的胶质纤维酸性蛋白水平升高,表明RAS参与了PD的起病及进展过程[56]。另有研究表明,在PD小鼠模型中,多巴胺能神经元通过分泌高水平的趋化性细胞因子,诱导星形胶质细胞转化为有益的A2型RAS,并迁移至受损的神经元,通过线粒体吞噬、分泌神经营养因子、清除游离谷氨酸等作用保护神经元[57]。进一步研究发现,A2型RAS的诱导与缝隙连接蛋白30有关[40]。总之,与脑梗死等其他CNS疾病相比,PD不伴有明显的组织损伤和炎症激活,因此研究主要针对A2型RAS在PD中的保护作用,对于A1型RAS在PD中的作用研究较少。未来可以通过调控星形胶质细胞的功能发挥其神经保护作用,从而治疗PD。
2.4MS MS是一种炎症性疾病,可导致CNS脱髓鞘和轴突损伤,其特征为弥散于整个CNS的炎性脱髓鞘局灶性病变。通过研究实验性自身免疫性脑脊髓炎模型小鼠发现,小鼠血脑屏障中的RAS增殖伴随小血管周围终足丧失,进而导致CNS炎症和血管周围水肿[58]。检测人体病理组织标本发现,急性MS患者病变区域存在RAS[45]。MS患者脑内RAS释放的炎症因子(IL-10、IL-17A、IL-22和CC趋化因子配体3等)可导致T细胞活化,并在病灶区域引起髓鞘和轴突损伤[59]。以上研究表明,RAS在MS疾病进展过程中发挥重要作用,是MS治疗的重要靶点。还有研究发现,αB-晶状体蛋白可诱导局部RAS增生,加重MS的早期进展;转谷氨酰胺酶6可通过激活RAS产生神经毒性[56]。总之,RAS通过激活炎症反应等途径在MS进展中发挥作用;同时,RAS还可促进脱髓鞘病变后坏死组织清除、支持髓鞘再生,但RAS在MS患者疾病恢复期的修复作用还有待研究。
2.5ALS ALS是一种不可逆的进行性运动神经元疾病,其特征为CNS运动神经元变性,导致肌肉萎缩、呼吸衰竭甚至死亡[45]。RAS存在于ALS小鼠易损区,其数量与ALS患者的神经退变程度相关[60]。有研究表明,RAS可直接导致ALS运动神经元死亡,并伴有信号通路异常,如神经元α-氨基-3-羟基-5-甲基-4-异唑丙酸受体GluR2亚基表达改变、谷氨酸转运体1表达下调、胞内钙离子超载[25]以及乳酸转运受损、运动神经元p75受体信号激活[61]和反式激活应答DNA结合蛋白43缺失[62]。体内RAS活化和免疫激活以及炎症标志物表达增加均可加剧ALS的病理进程,而γ干扰素诱导的RAS可通过信号转导及转录激活因子3依赖的信号通路产生神经毒性,进一步诱导RAS募集,损伤运动神经元[2]。ALS中RAS的募集和神经毒性均可被信号转导及转录激活因子3抑制剂抑制[37]。目前关于ALS的病因尚不明确,且临床也缺乏有效的治疗方法和可靠的治疗药物,但ALS患者病变区域存在RAS,且其数量与患者的神经变性水平相关[45],因此RAS可能参与了ALS患者神经元死亡。
2.6脑肿瘤 RAS在原发胶质母细胞瘤、转移性肺癌、乳腺癌和黑色素瘤等脑部常见原发或继发性肿瘤的转移中发挥重要作用[63]。多形性胶质母细胞瘤是成人最常见的原发性恶性脑肿瘤,由于其特殊的微环境和抗炎特性,无法获得抗肿瘤免疫[64]。研究发现,应用Janus激酶抑制剂抑制RAS,可减缓多形性胶质母细胞瘤的生长、增加免疫细胞在肿瘤处的募集[13]。此外,RAS还可与多形性胶质母细胞瘤细胞建立协同关系,诱导肿瘤细胞锌指E盒结合蛋白1基因表达,刺激肿瘤发生上皮-间充质转化和肿瘤细胞浸润[65]。RAS也可通过影响离子通道和转运蛋白的表达改变氢离子、钾离子和钙离子水平,导致细胞体积变化,从而增加肿瘤细胞的迁移和侵袭力[66]。
RAS在肿瘤转移中的作用随着疾病的进展不断发生变化,初次接触肿瘤细胞时,RAS可产生纤溶酶原激活物杀死肿瘤细胞,抑制其转移[67];在黑色素瘤、乳腺癌、肺癌等转移性肿瘤进展过程中,RAS可通过分泌CC趋化因子配体7[67]、Jagged 1蛋白[68]、IL-23[69]等细胞因子促进肿瘤转移和侵袭。可见,RAS在原发或继发性颅脑肿瘤中具有调控作用,深入了解其复杂性和异质性对治疗脑肿瘤具有重要意义。
3 小 结
近年来,RAS在CNS疾病病理过程中的作用逐渐成为研究热点。RAS对CNS损伤的影响是多方面的,但目前关于RAS的研究仍存在局限:①目前关于RAS的研究多限于动物模型或体外细胞,因此RAS在人体疾病中的具体病理生理机制尚不明确,同时对于RAS在不同CNS疾病中的作用也存在争议;②目前RAS的常用生物标志物胶质纤维酸性蛋白特异性不高,因此寻找新的RAS生物标志物迫在眉睫。相信随着基因组学和蛋白质组学等技术的发展,关于RAS的调控靶点及其相关通路的研究会取得新的进展,从而为CNS疾病的诊治提供新方向。
