经颅磁刺激联合骨髓间充质干细胞移植治疗对脊髓损伤大鼠功能恢复的作用机制
2022-03-02冯思宁王帅孙师苏浩张立新
脊髓损伤(spinal cord injury,SCI)是由脊柱外伤、脊髓肿瘤等原因造成的脊髓结构、功能的损害,主要表现为损伤平面以下的运动和感觉部分或完全消失,伴或者不伴二便功能障碍。其中外伤是最常见的发病原因。在国内经济发达地区,例如北京、上海等地,SCI发病率约为百万分之50~60,并且有逐年上升的趋势
。脊髓损伤患者除了肢体功能障碍外还可能出现肺部感染、泌尿系感染和压疮等一系列并发症
,影响患者生活质量的同时也给家庭和社会带来了沉重的经济负担。如何改善患者的肢体功能,提高日常生活能力及生存质量,便成为医学领域亟需解决的难题。
近年来,有研究者采用细胞移植的方法治疗脊髓损伤动物,发现细胞移植法可能修复损伤脊髓结构的连续性及促进脊髓的神经功能恢复
。而骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)因其来源丰富、易于提取及分离和纯化、多向分化潜能
、低抗原性等特点
,使其成为研究热点。利用BMSCs治疗SCI已日渐成熟,国外已有多个研究团队通过动物实验证明,行BMSCs移植治疗SCI后病灶囊腔缩小,感觉及运动功能均有较大的改善。但其移植后促进脊髓损伤功能恢复的机制尚无定论
。
磁刺激是使用随时间变化的电流流入线圈,产生时变磁场,在组织内产生感应电流,从而达到兴奋或抑制组织的效果。它作为一种无创的诊断及治疗方法逐渐走进人们的视线。已发现磁刺激治疗是促进脊髓损伤后功能恢复的有效方法
。先前有研究报道BMSCs和经颅磁刺激(Transcranial magnetic stimulation,TMS)对血管性痴呆模型大鼠有协同作用
。本文旨在观察BMSCs移植联合TMS治疗对脊髓损伤大鼠功能恢复的影响,初步探讨两者联合作用机制,为其临床应用提供理论依据。
1 材料与方法
1.1 一般资料 取8周龄的清洁级SD雌性大鼠60只,体质量180~250g,随机分成5组,每组12只,即:假手术组,模型组, BMSCs组,TMS组,TMS+BMSCs组。
1.2 实验方法
1.2.1 实验分组 ①假手术组:SD大鼠按脊髓损伤制作模型方法咬除T10及部分T9、T11椎体椎板,暴露T10处脊髓背侧硬脊膜,之后逐层缝合,不做打击处理。术后7d再次暴露脊髓背侧硬脊膜,注射DEME/F12培养基5μL。②模型组:大鼠SCI术后7d再次暴露T10处脊髓背侧硬脊膜,于损伤处注射DEME/F12培养基5μL。③BMSCs组:大鼠SCI术后7d,用10μlHamilton微量注射器向损伤区的中心区注射5μL细胞悬液(细胞密度为1×10
/μL),注射后留针2~3min。然后缓慢退出,术毕逐层缝合。④TMS组:大鼠SCI术后24h后给予磁刺激治疗。磁刺激治疗方案为:频率10Hz,刺激强度70%静息运动阈值,刺激5s,间歇10s,共计500脉冲,治疗时间总长750s
。每天1次,每周5d,共4周。刺激部位:应用直径6cm线圈,将线圈磁场中心贴近大鼠头骨正中心。术后7d于脊髓损伤处注射DEME/F12培养基5μL,24 h后继续磁刺激治疗。⑤TMS+BMSCs组:大鼠术后24h后给予10Hz磁刺激治疗,每天1次,每周5次,共4周,术后7d于损伤处注射5μL细胞悬液,24 h后继续磁刺激治疗。
2.4 BMSCs和TMS联合治疗SCI模型脊髓轴突再生微环境的影响
脊髓损伤的治疗一直是一个世界性难题,局部神经组织破坏导致的神经再生受限和神经功能恢复障碍是治疗脊髓损伤的主要障碍
。
1.3.2 免疫荧光NeuN分析 脊髓冰冻切片切成10μm厚的组织切片,用抗原复活剂处理,用PBS冲洗后用山羊血清(北京索拉宝科技有限公司)封闭15min。然后用神经元特异性核蛋白(neuron specific nuclear protein ,NeuN)多克隆抗体(1∶100;Proteintech),在4℃过夜,然后用Cy3标记的山羊抗兔IgG抗体(1∶300,Beyotime),室温下保持60min。用DAPI染色后,组织切片用抗荧光猝灭剂封闭。每只大鼠随机从纵切的脊髓组织的上、中、下端每个位置随机抽取2张片子;染色后采用荧光显微镜在同一光强度(放大倍率x400;Olympus公司)下拍摄图像(红、绿激光强度100ms用于观察靶蛋白;蓝色激光10ms),使用Image J进行光强度值的计算。以损伤区域为中心进行前、中、后取3张照片,平均每张片子上前、中、后数据后每只大鼠共有6个数据,每组共计收集36个数据。
1.2.4 脊髓组织灌流固定 取术后4周大鼠,2%戊巴比妥钠腹腔麻醉(50 mg/Kg)行腹腔麻醉,将大鼠仰卧位剪开上腹部,并将膈肌沿两侧向上剪开,以“V”字形剪短肋骨,用止血钳翻开,充分暴露心脏。4℃预冷PBS溶液用输液袋装满,并连接20ml注射器针头,剪开心外膜,将针头经心尖刺入主动脉,剪开右心耳。每组中取6只应用4℃PBS 250ml进行心脏灌洗,观察肝脏红变白后,改用4%多聚甲醛,直到大鼠出现肢体震颤及僵硬,停止灌注。4℃冰箱固定5min后进行取材。剪取大鼠胸腰段脊髓,取以损伤处为中心长约2cm的脊髓,用PBS漂洗后,放入4%多聚甲醛中4℃固定24h。随后采用15%、20%、30%蔗糖溶液4℃梯度沉糖脱水,OCT包埋后放置于冷冻冰箱用于后续免疫荧光染色。每组取另外6只大鼠直接用4℃PBS进行脊髓灌注,取胸腰段脊髓损伤处中心长约1cm的脊髓,-80℃超低温冰箱中保存以进行免疫印迹分析。
画有不落纤尘之明澈,是林容生艺术最大的特色。林容生的画以“具体”为胜,山石坡峰,林木庄稼,房屋的窗棂阶壁,溪流的委婉走向,在他的画中都清晰如许。正是由于他的用笔用线十分丰富并有着极深的线造型功力,他才能如此悉心而从容地勾勒物象的形貌,使笔线在塑形的同时,尽情展现出变化的意趣, 透溢出使驱者的兴味与情怀。另一方面,他长期研究墨与色的关系,将“随类敷彩”上升为“以意敷彩”,控制墨与色的比度,把握色调的美感,让人看到一种渗透了当代意识的“青绿山水”。面对他的山水,一股无有雾霾的清爽气息拂面而来,总是让人满目明澈。
1.3 评定标准
2.3 BMSCs和TMS治疗对SCI模型神经胶质纤维酸性蛋白的影响 Westernblot检测 SCI 28d后各组大鼠脊髓损伤处GFAP蛋白表达:脊髓损伤后,GFAP表达明显增高。与模型组比较,TMS、BMSCs组及TMS+BMSCs联合治疗组GFAP蛋白表达均明显降低(
<0.01),联合组较BMSCs组及TMS组表达明显降低(
<0.01)。见图3。
1.2.3 BMSCs的分离提取
取4周龄体质量90~110g的GFP幼鼠,2%戊巴比妥钠腹腔麻醉(50 mg/Kg)行腹腔麻醉,在无菌操作台下分离取出幼鼠的股骨和胫骨,除去其上所附的软组织及肌肉。无菌条件下剪断股骨和胫骨骨干两端,用5 ml注射器吸取DMEM/F12培养基,插入露出的骨髓腔反复冲洗、吹打,将冲洗出的细胞制成均匀的细胞悬液,取310g的细胞悬液离心后弃上清,加入3ml的红细胞裂解液,吸管吹均静置后再次离心,弃上清,用含10%胎牛血清的DMEM/F12培养基进行细胞培养。取形态较均一、生长速度较快的P3代骨髓间充质干细胞,流式细胞术检测第3代细胞表面标记物CD11b、CD29、CD90和CD45,流式结果显示,分离得到的BMSCs细胞表面标记物CD11b和CD45为阴性,CD29和CD90为阳性。提示BMSCs分离提取成功。
2.2 BMSCs与TMS治疗对SCI模型损伤处神经元的影响 免疫荧光检测SCI 28d后各组脊髓NeuN的表达,脊髓损伤组较假手术组NeuN表达明显减少;同SCI组比较,BMSCs移植后,NeuN表达较模型组增加,但差异无统计学意义;TMS治疗后,NeuN表达较模型组增加(
<0.05);TMS和BMSCs联合组与模型组及BMSCs组和TMS组比较,NeuN阳性表达明显增加(
<0.01)。见图1。 Westernblot检测SCI 28d后各组大鼠脊髓损伤处NeuN的蛋白表达,与模型组比较,BMSCs、TMS、TMS+BMSCs联合组较模型组NeuN表达显著增加(
<0.01);TMS+BMSCs联合组较BMSCs组及TMS组NeuN的蛋白表达增加(
<0.01)。见图2。
现代多自由度并联式力控末端执行器属于多输入多输出系统。它由多个支链组成,支链间存在耦合,且每个支链至少有1个恒力补偿作动部件,工具头的最终输出力和姿态由各支链及其恒力补偿作动部件决定。因此,应对它进行解耦控制技术研究,减小或消除各支链间的相互干扰,提高力控末端执行器的动静态性能及其可靠性。
2 结果
2.1 BMSCs移植、TMS及TMS联合BMSCs治疗促进大鼠SCI后运动功能的恢复 所有大鼠术后即出现双后肢瘫痪,24h后BBB评分为0分,提示SCI模型建立成功。术后14d,进行各治疗组间BBB评分比较,BMSCs及TMS治疗组较模型组评分有所提高,但差异无统计学意义,TMS联合BMSCs组评分较模型组及BMSCs组和TMS组提高(
<0.01),BMSCs组和TMS组组间评分比较差异无统计学意义。术后28d,BMSCs组、TMS组及TMS联合BMSCs组评分均较模型组提高(
<0.01),且TMS联合BMSCs组较BMSCs组和TMS组评分提高(
<0.01),BMSCs组和TMS组组间评分比较差异无统计学意义。见表1。
1.3.3 蛋白免疫印迹 GFAP、GAP-43、Nogo-A分析用全细胞裂解试剂盒(沈阳万类生物有限公司)从大鼠脊髓组织中提取总蛋白,然后用BCA蛋白分析试剂盒(沈阳万类生物有限公司)定量。用40%的聚丙烯酰胺凝胶(PVDF)将蛋白质转移到微孔膜上(每孔用PVDF分离12%)。在室温下用5%脱脂牛奶封闭1h后,将细胞膜与以下主要抗体在4℃下培养过夜:抗胶质纤维酸性蛋白(glial fibrillary acidic protein ,GFAP)兔多克隆抗体(1∶500;沈阳万类生物有限公司);抗生长相关蛋白43(Growth associated protein 43,GAP-43)兔单克隆抗体(1∶10000;Abcam);抗神经生长抑制因子A(Neurite outgrowth inhibitor -A ,Nogo-A)兔多克隆抗体(1∶1500;novusbio)与β-肌动蛋白兔多克隆抗体(1∶1000;沈阳万类生物有限公司)。然后用TBS-T缓冲液冲洗膜,并与HRP结合的羊抗兔IgG(1∶5000)或山羊抗兔IgG(1∶5000)抗体(沈阳万类生物有限公司)在37℃下孵育45min。使用ECL发光试剂(沈阳万类生物有限公司)观察蛋白质,并使用Gel Pro分析仪4.0版(媒体控制论公司)对条带的光密度值进行量化。


1.3.1 大鼠双后肢的运动功能观察 按运动功能评分(Basso Beattie Bresnahan,BBB)评定细则,评价所有实验大鼠的后肢关节运动、步行能力、四肢的协调性及稳定性。分别在术前、术后1d、14d、28d进行评价。评定时,将大鼠置于直径100cm、高30cm的透明空心圆柱体内,双人盲法观察并进行大鼠后肢的行走和肢体活动评定。BBB评分完全瘫痪的大鼠为0分,正常大鼠21分,SCI大鼠的功能情况介于两者之间,每只动物观察4min。

学前教育专业学生今后的教学对象主要是学龄前的儿童,在学前钢琴基础、幼儿歌曲弹唱与律动、儿歌即兴伴奏等课程中加入一定比例的畲族童谣的歌曲,不仅继承了传统畲族音乐,同时随着毕业生的就业,还可无形中在学龄前的孩子们心中埋下传播宁德特有的畲族传统民歌的种子。
按照党中央、国务院决策部署,我国自2019年1月1日起,调整跨境电商零售进口税收政策,提高享受税收优惠政策的交易限制,并且扩大商品清单范围。税收政策调整包括:将年度交易限值由每人每年20000元调整至26000元,今后随着居民收入的提高,相机调增;将单次交易限值由每人每次2000元调整至5000元,并明确已经购买的跨境电商零售进口商品不得进入国内市场再次销售。
因人员流动较慢,上升渠道狭窄等原因,乡镇财政人员存在整体水平普遍不高、年龄偏大、学历偏低、素质较弱的问题。许多新参加工作的大学生更倾向于在乡镇组织办等工作出彩多的部门工作,致使专业人才难以补充到乡镇财所队伍,出现人才断档。
在购买者表现出自我感知时,购买者会转变为自我感知的心理近距离中。在对商品进行促销时,价格促销给予购买者感知性利润,能够立即出现自我感知。而赠送式促销,通过赠品的方式使得消费者获得实际可感的实惠,在心理近距离背景下,其购买力也能产生良好的作用。
2.4.1 Westernblot检测SCI 28d后各组大鼠脊髓损伤处GAP-43蛋白表达 与模型组比较,BMSCs、TMS组及TMS+BMSCs组GAP-43蛋白表达增加(
<0.01),其中TMS+BMSCs组较BMSCs组GAP-43蛋白表达增加(
<0.01),TMS+BMSCs组较TMS组比较有所增加,差异无统计学意义。见图4。

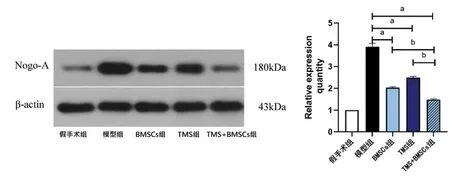
2.4.2 Westernblot检测SCI 4周后各组大鼠脊髓损伤处Nogo-A蛋白表达 脊髓损伤后Nogo-A表达明显增高。与模型组比较,BMSCs组、TMS组及TMS+BMSCs组Nogo-A蛋白表达明显降低(
<0.01),联合组较单一治疗组Nogo-A蛋白表达降低(
<0.01)。见图5。
本文提出了一种基于改进的OCS调制方式,利用UFBG-AOTF光学生成多倍频可调谐毫米波的方法.在调制指数m=2.5π的条件下,最高倍频因子可达22.该方案通过控制UFBG-AOTF的声波频率实现FMF的线性调谐,仅使用一个DD-MZM,灵活、简单且成本较低,同时也降低了对振荡器及调制器的频率要求.此外,提高DD-MZM的调制系数能够实现更高倍频因子毫米波信号的产生.同时,对倍频因子为22时系统下行链路传输性能的分析表明,在只将基带数据信号调制到其中一个边带上的OCS改进方案中,信号可以进行长距离且性能更稳定的传输,有效避免了色散所导致的码元时移效应.
3 讨论
1.2.2 SCI模型制作 实验大鼠用2%戊巴比妥钠腹腔麻醉(50mg/Kg)进行腹腔麻醉,大鼠俯卧于操作台,背部剃毛备皮,常规皮肤消毒,以T10棘突为中心作长约3cm的切口,剥离周围软组织及椎旁肌肉,显露并用血管钳咬除T10及部分上、下椎体的棘突和两侧椎板,暴露脊髓背侧硬脊膜。采用Allen’s法
,制备大鼠T10脊髓打击伤模型。将大鼠固定在致伤装置底座上,调整冲击棒套管下端使其弧面紧贴脊髓背侧硬脊膜,之后用10g冲击棒自10 cm高处自由下落击打脊髓,造成急性脊髓损伤模型,冲击棒直径2mm,致伤能量为100 gcf。打击后大鼠暴露硬脊膜处可见血肿,硬脊膜完整呈紫红色,膨隆,大鼠若出现短暂的双后肢痉挛及摆尾动作,则标志造模成功。在脊髓损伤正上方留置硅胶薄膜,方便二次注射时找出损伤部位。切口处用生理盐水冲洗,并滴加小剂量青霉素,逐层缝合肌肉、软组织。术后直至大鼠麻醉苏醒时注意保温,术后每日行青霉素腹腔注射,连续3日。每日辅助排尿2次,直至排尿反射建立。
早在20世纪初,即有动物实验研究证实,BMSCs具有促进神经功能再生的潜能,与BMSCs共培养,促进了神经元细胞的分化,显著提高了脊髓损伤大鼠的功能恢复
。赵文涛等人对国内外领域相关发表文章进行了一项系统评价及Meta分析,其中共纳入6个随机对照试验,252名患者
,通过分析指出:间充质干细胞能提高脊髓损伤患者的ASIA触觉及日常生活能力评分及Frankel损伤分级;但在ASIA运动评分和膀胱残余尿量方面效果不显著。说明间充质干细胞移植治疗脊髓损伤有一定疗效。
虽然BMSCs对脊髓损伤治疗有着一定的效果,但其治疗机制至今仍然没有定论。目前认为BMSCs治疗脊髓损伤的机制主要有:①有研究认为,在一定条件下,BMSCs可以被诱导分化为神经元样细胞和神经胶质细胞
,迁移至损伤部位,填充脊髓损伤后形成的囊腔,缩小囊腔范围。②BMSCs通过分泌神经生长相关因子,如:神经生长因子、脑源性神经营养因子等,促进神经功能的恢复
,对突触的传递及可塑性亦发挥重要的作用
。③BMSCs可以通过抑制不利于再生的胶质瘢痕形成,促进轴突再生。在亚急性期和慢性期和下调瘢痕组织区域轴突生长抑制因子Nogo-A的释放。同时,以旁分泌形式释放的神经营养因子亦为轴突再生创造了良好的微环境。
经颅磁刺激自1985年发现以来,已被广泛应用于治疗多种神经退行性疾病。例如,重复性经颅磁刺激通过激活β-catenin促进Alzheimer病大鼠的认知功能和神经元存活
。由经颅磁刺激产生的磁场,通过延长神经元的寿命、增加神经元的数量改善了帕金森病大鼠的认知功能
。磁刺激已被发现可作为促进脊髓损伤后功能恢复的有效方法,对脊髓损伤后的运动、疼痛、痉挛、二便功能障碍等均有不同的治疗作用。磁刺激的治疗机制与其抑制神经元的过度兴奋、降低神经炎性反应、改变血脑屏障通透性、促进神经元存活有关。有研究显示,皮层抑制功能降低与脊髓损伤后自然恢复相关,磁刺激能够通过调节皮质束的功能促进脊髓损伤后的功能恢复。
由于TMS和BMSCs都有改善脊髓损伤后功能障碍的作用,BMSCs与TMS联合治疗对脊髓损伤大鼠的神经损伤是否有更好的修复作用值得探讨。以往的研究表明BMSCs与TMS联合治疗对血管性痴呆大鼠有协同作用,BMSCs+TMS联合治疗后VD大鼠学习记忆能力的恢复较单纯TMS治疗更为显著,提示BMSCs+TMS联合应用治疗神经系统疾病更为有效
。本实验结果显示,BMSCs+TMS联合治疗较单一治疗组显著提高了SCI大鼠BBB评分,同时脊髓损伤处NeuN阳性细胞数增加,联合治疗效果更为显著,提示TMS可能通过促进BMSCs分泌神经生长因子及改善局部微环境促进脊髓损伤后大鼠运动功能恢复,与以前的研究结果一致。
SCI损伤后影响功能恢复的因素主要包括继发性损伤;炎性因子的分泌;微环境的变化;胶质瘢痕的形成等。中枢神经系统可塑性理论不同于传统的中枢神经损伤不可逆的观点,认为脊髓损伤后轴突的生长对神经再生及功能恢复至关重要。损伤处的轴突可通过残端出芽的形式再生,或通过残留轴突侧支出芽的形式再生,并延伸至到相应的靶细胞以形成新的突触联系,并在一定程度上恢复对靶细胞的神经支配。同时,也可以在重塑代偿机制发挥作用,例如上调神经递质分泌,改善轴突周围的生长环境等
。但是成年哺乳动物中枢神经系统(central nervous system,CNS)再生能力极其微弱,这除了因为CNS神经元自身的再生能力下降以外,更重要的是CNS神经元内外环境受各种外源性抑制性因子的影响,其中髓鞘碎片分泌的髓鞘相关抑制因子Nogo-A具有限制轴突的延伸及中枢系统损伤后轴突再生的能力
。研究发现,SCI后Nogo-A的表达逐渐升高,导致神经再生困难
。与Nogo-A作用相反的是,生长相关蛋白43(GAP-43)在SCI后可以通过加速生长锥基底部细胞膜的扩张而促进轴突再生。GAP-43是一种神经组织特异性磷酸蛋白,广泛存在于神经组织中,尤其是在生长、分化和再生的轴突末端以及突触前膜。因为GAP-43在神经元生长锥中特异表达,在突起生长和突触形成过程中表达上调,使其成为神经再生的理想标志物
。而胶质瘢痕的主要成分GFAP则通过抑制轴突再生来阻止神经元再生,脊髓损伤的啮齿动物中GFAP表达升高
。
本实验结果显示:①脊髓损伤后GFAP表达显著上调,BMSCs及TMS治疗后GFAP阳性细胞数有所减少,但联合治疗组阳性细胞数减少最为显著,且较单一治疗组阳性细胞数亦有减少。②脊髓损伤后GAP-43的表达显著降低,BMSCs及TMS治疗组可见GAP-43上调,而TMS联合BMSCs组GAP-43上调最为显著,且上调效果优于BMSCs组。③脊髓损伤后Nogo-A的表达显著增加,BMSCs及TMS治疗组可见Nogo-A下调,但对比模型组差异无统计学意义,而TMS联合BMSCs组Nogo-A下调最为显著,差异有统计学意义。
1.3.1 小鼠LLC细胞培养及肺癌移植瘤模型建立 收集对数生长期LLC细胞,制成1×106个/mL的单细胞悬液;0.2 mL/只,皮下注射入30只C57/BL6小鼠左侧腋下,观察、记录LLC小鼠生长及成瘤情况。
本研究通过应用BMSCs、TMS及TMS+BMSCs联合治疗SCI大鼠,观察发现联合治疗组SCI大鼠BBB评分显著高于单一治疗组,即联合治疗组大鼠运动功能恢复优于单一治疗组,可能与TMS促进BMSCs分泌GAP-43,抑制GFAP及Nogo-A的分泌,从而改善了脊髓损伤后局部的微环境,促进了轴突的再生相关。联合治疗组神经元较单纯治疗组增多,是否因TMS促进了BMSCs向神经元的分化,或因局部微环境改善促进了神经元的存活,仍需进一步实验以证实。
[1] National Spinal Cord Injury Statistical Center.Spinal cord injury(SCI):facts and figures at a glance[R/OL].2017,1-2.https://www.nscisc.uab.edu/reports.aspx.
[2] Eckert MJ, Martin MJ. Trauma: spinal cord injury[J]. Surg Clin North Am, 2017, 97(5): 1031-1045.
[3] Lee BB, Cripps RA, Fitzharris M, et al. The global map for traumatic spinal cord injury epidemiology: update 2011, global incidence rate[J]. Spinal Cord, 2014, 52(2): 110-116.
[4] Garbossa D, Fontanella M, Fronda C, et al. New strategies for repairing the injured spinal cord: the role of stem cells[J]. Neurol Res, 2006, 28(5):500-504.
[5] Okano H, Okada S, Nakamura M, et al. Neural stem cells and regeneration of injure sPinal cord[J]. Kidney Int, 2005, 68(5):1927-1931.
[6] Xiang SY, Dusaban SS, Brown JH. Lysophospholipid receptor activation of RhoA and lipid signaling pathways[J]. Biochim Biophys Acta, 2013, 1831(1):213-222.
[7] Carrade DD, Affolter VK, Outerbridge CA, et al. Intradermal injections of equine allogeneic umbilical cord-derived mesenchymal stem cells are well tolerated and do not elicit immediate or delayed hypersensitivity reactions[J]. Cytotherapy, 2011, 13(10):1180-1192.
[8] Courtney p, Samdani AF, Betz RR, et al. Grafting of human bone marrow stromal cells into spinal cord injury: a comparison of delivery methods[J]. Spine, 2009, 34(4):328-334.
[9] Boido M, Garbossa D, Fontanella M, et al. Mesenchymal stem cell transplantation reduces glial cyst and improves functional outcome after spinal cord compression[J]. World Neurosurg, 2014, 81(1):183-190.
[10]孙剑渊,顾琦,吴勤峰,等.重复经颅磁刺激对不完全性脊髓损伤患者的临床疗效观察[J].中国康复,2019,34(6):303-306.
[11]Wang F,Zhang C, Hou S,et al. Synergistic effects of mesenchymal stem cell transplantation and repetitive transcranial magnetic stimulation on promoting autophagy and synaptic plasticity in vascular dementia[J]. Gerontol A Biol Sci Med Sci,2019,8(16): 1341-1350.
[12]向艳平,唐峰,黄晓琳等.不同频率重复经颅磁刺激对脊髓损伤大鼠运动功能的影响[J].中国康复医学杂志,2013,28(1):3-13.
[13]Allen AR.Srugery of experimental lesion of spinal cord equivalentto crush injury of fracture dislocation of spinal column[J].Apreliminary report,1911,57(1):878-880.
[14]Yin YM,Lu Y,Zhang LX,et al.Bone marrow stromal cells transplantation combined with Ultrashortwave therapy promotes functional recovery on spinal cord injury in rats[J].Synapse,2015 Mar;69(3):139-47.
[15]Chow DS, Teng Y, Toups EG, et al. pharmacology of riluzole in acute spinal cord injury[J]. J Neurosurg Spine, 2012, 17(1): 129-140.
[16]Wu S, Suzuki Y, Ejiri Y, et al. Bone marrow stromal cells enhance differentiation of coculturedneurosphere cells and promote regeneration of injured spinal cord[J]. J Neurosci Res, 2003, 72(3): 343-351.
[17]赵文涛,李盼盼,张海峰,等.间充质干细胞移植治疗脊髓损伤:系统评价及Meta分析[J].中国组织工程研究,2015, 19,(36):5865-5871.
[18]Zeng X, Qiu XC, Ma YH, et a1.Integration of donor mesenchymal stem cell derived neuron like cells into host neural network after rat spinal cord transection[J]. Biomaterials, 2015, 53(2):184-201.
[19]Zeng R, Wang LW, Hu ZB, et a1. Differentiation of human bone marrow mesenchymal stem cells into neuron-like cells in vitro[J]. Spine, 2011, 36(13):997-1005.
[20]Hawryluk GW, Mothe A, Wang J, et a1.An in vivo characterization of trophic factor production following neural precursor cell or bone marrow stromal cell transplantation for spinal cord injury[J]. Stem Cells Dev, 2012, 21(12):2222-2238.
[21]Waterhouse EG, Xu B. New insights into the role of brain-derived neurotrophic factor in synaptic plasticity[J]. Mol. Cell. Neurosci, 2009, 42(2): 81-89.
[22]Chen X, Chen S, Liang W, et al. Administration of repetitive transcranial magnetic stimulation attenuates A(1-42)-induced Alzheimer's disease in mice by activating beta-catenin signaling[J]. Biomed Res Int, 2019, 20(9): 1431760.
[23]Ba F, Zhou Y, Zhou J, et al. Repetitive transcranial magnetic stimulation protects mice against 6-OHDA-induced parkinson's disease symptoms by regulating brain amyloid beta1-42 level[J]. Mol Cell Biochem, 2019, 458(1):71-78.
[24]Filli L, Schwab ME. Structural and functional reorganization of propriospinal connections promotes functional recovery after spinal cord injury[J]. Neural Regen Res, 2015, 10(4): 509-513.
[25]叶超群,孙天胜,刘智.脊髓损伤后轴突再生的研究进展[J].中国脊柱脊髓杂志,2007,17(9): 715-718.
[26]黄海珍,桑锋,王玉霞,等.Nogo在中枢神经损伤再生中的作用机制[J].生物学杂志,2009,26(4):61-64.
[27]岳岩.小鼠脊髓损伤后Nogo-A的免疫组织化学研究[J].局解手术学杂志,2011,20(3):237-241.
[28]Wang F, Zhang C, Hou S, et al. Synergistic effects of mesenchymal stem cell transplantation and repetitive transcranial magnetic stimulation on promoting autophagy and synaptic plasticity in vascular dementia[J]. J Gerontol A Biol Sci Med Sci, 2018,74(9):1341-1350.
[29]Liu F, Liao F, Li W, et al. progesterone alters Nogo-A, GFAP and GAP-43 expression in a rat model of traumatic brain injury[J]. Mol Med Rep, 2014, 9(4): 1225-1231.
