卒中后认知障碍对数学计算-步行双任务中步态自动化程度和跌倒风险的影响
2022-03-02何智捷张韶辉于小明蒋黎明韦晓芝张婷婷赵嘉诚
认知障碍是卒中后常见的障碍类型之一,主要表现为额叶执行功能受限和注意力缺陷
。步行-认知的双重任务执行是卒中患者回归社区后需常面对的日常活动之一
,不同于健康人群,脑卒中者常通过过度占用执行功能和注意力来执行步行控制
。在当前认知资源容量的框架理论下,执行功能障碍和注意力缺陷可能是诱发步行不稳和跌倒发生的主要原因之一
。然而,认知障碍、双任务下的步态表现和跌倒风险三者之间的关系依然尚未明确
。明确此关系对于理解认知障碍诱发跌倒的潜在机制具有重要意义,且可为双重任务干预方案的设计提供理论指导。
中枢神经系统的步行控制可以看作为执行步行控制和节律化自动控制之间的平衡
。执行步行控制与前额叶的资源利用相关
,而节律自动化控制则涉及基底核
。研究发现,不同认知任务影响步态表现和跌倒风险的机制并不相同
。前人研究的双重任务设计较多集中在与前额叶、语言中枢以及感觉-运动皮层介导的认知任务层面上
,而对于涉及空间记忆的数学计算却关注较少。研究显示,基底核不仅与节律化自动控制有关,还同时介导数学计算
。此外研究表明,集中注意学习可以激活右侧基底核
,这可能说明注意力缺陷也会间接影响基底核的功能发挥。因此,设计数学计算的认知任务可能对于理解双任务下的步行自动化控制和跌倒风险程度具有重要意义。然而,较为遗憾的是,前人研究中步态时空参数的评估并不能反映与基底核相关的步态自动化控制
。此外,采用质心和压力的距离或夹角来评估跌倒风险,忽略了支撑面和步行速度的影响
。因此,本研究通过设计步行-数学计算的双任务,采用步态变异性和步态稳度量化评估步行自动化程度和跌倒风险,旨在探讨卒中后认知障碍对数学计算-步行双任务中步行自动化程度和跌倒风险的影响。
1 资料与方法
1.1 一般资料 于2019年6月~10月间在上海市虹口江湾医院及其周边社区,共招募脑卒中受试者31名。诊断标准:符合《各类脑血管疾病诊断要点》脑卒中诊断标准,并经CT或MRI检查证实。纳入标准:年龄50岁~ 75岁,性别不限;首次发病,且病程>6个月;无佩戴各类辅助步行或矫形器具;可自主步行20m。排除标准:伴有其他神经系统疾病或严重内科疾病者;患有肌骨类型疾病或其他疾病,并导致下肢不对称及肌骨损伤者;视力或听力障碍者;已参加任何临床研究者;接受系统化的认知功能训练者。由一名经验丰富的康复治疗师,采用MoCA认知评估量表(Montreal Cognitive Assessment, MoCA)对受试者进行认知功能评定
,根据认知功能评估结果分为认知障碍组(
=14,MoCA<26)和无认知障碍组(
=17,MoCA≥26)。此外,评估受试者下肢功能(Fugl-Meyer Assessment,FMA)和Berg平衡功能。两组受试者基线特征见表1。本研究经医院伦理委员会批准,且受试者知情同意。
早期生长反应因子1(EGR-1)是一种早期生长反应基因,属于转录因子锌指蛋白家族成员。它可以在几分钟内激活一系列信号通路,其活性在数小时内即衰退。渗透压改变、热休克、缺氧、DNA损伤、辐射损伤等应激都会刺激EGR-1的表达。EGR-1通过多种通路调节细胞的增殖、分化和凋亡。但是,目前关于EGR-1在卵巢癌中的发生、发展中起到什么样的作用还未有明确的报道。本研究运用免疫组化的方式检测EGR-1蛋白在卵巢癌的表达情况,探讨EGR-1在卵巢癌的发生、发展的过程中的作用与意义。
1.2 方法
在双重任务中,跌倒风险和步行自动化控制息息相关
。本文研究结果显示,认知障碍组内外侧动态稳度显著低于无认知障碍组。这与前人关于遗传性痉挛、脑卒中等领域的研究结果相一致
。以往针对神经病变人群步行策略的研究认为,脑卒中步态表现的改变不仅仅是因为运动功能的受限,也有可能是其根据自身功能而选择慢速平稳的应对策略有关
。尽管我们并未发现前后方向的不稳增大,但这并不意味着认知障碍对前后方向的动态稳度没有影响,原因在于步速的降低和双支撑的延长使得动态稳度趋于正常。然而,认知障碍组在步行脚跟触底时,内外侧跌倒风险依然较大,这提示在康复干预中应着重于内外侧平衡的训练。
2.2 两组患者并发症发生率对比 对照组肾结石患者并发症发生率为2.00%,观察组患者为20.00%,观察组患者并发症发生率显著增高,两组比较有统计学意义(P<0.05,表2)。
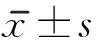
2 结果
卒中后认知障碍影响步态生物力学变化和诱发跌倒的潜在机制,持续引发神经康复领域研究人员的重点关注
。与前人研究侧重点不同的是,本研究着眼于涉及基底核的数学计算-步行双重任务,并明确了卒中后认知障碍对数学计算-步行双重任务中步行自动化程度和跌倒风险的影响。结果发现,与无障碍组相比,认知障碍组具有显著更低的步速、更大的双支撑期比例、更大的步速变异性及更低的内外侧动态稳度。这可能说明在可影响基底核的双重任务中,执行功能障碍和注意力缺陷进一步降低了步行自动化模式和增加了跌倒风险。
在健、患侧肢体脚跟触地时,认知障碍组的内外侧动态稳度显著小于无认知障碍组(
<0.05),前后方向动态稳度2组间比较差异无统计学意义。见表4。
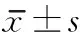
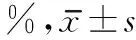
其次,需要建设目标,通过运用云计算、移动互联网、大数据分析等先进技术,建设出符合院校发展的数字化环境,从而实现规范高效的管理,并且可以为学校管理者作出决策提供强有力的依据,为全校的老师和学生提供更加便捷的信息服务系统,科学地提高学校的信息化水平,实现学校转型发展[3]。

3 讨论
2组步态时空参数的比较。与无认知障碍组相比,认知障碍组具有显著较小的步速和较大的双支撑期(
<0.05);其余步态参数指标无统计学差异。见表2。2组步态参数变异性比较,认知障碍组的步速变异性显著大于无认知障碍组(
<0.05);其余步态参数变异性指标未见统计学差异。见表3。
步态控制主要依赖于前额叶-纹状体网络,此网络涉及执行功能
。其中,纹状体是基底节环路的输入层,主要参与步行程序性和节律自动化的过程,而前额叶主要是在复杂的步行条件下补充自动化
。步态参数变异性与步行自动化控制程度的负相关关系已得到大量研究证实
。在本研究中,我们发现认知障碍组的步速变异性显著更大,这可能说明执行功能障碍对步行自动化模式产生显著的负面影响。研究发现,与青年相比,健康老年人和脑卒中患者在步行任务中均表现出前额叶的过度激活,且脑卒中患者前额叶过度激活程度大于健康老年人
。目前认为,这种前额叶过度激活的现象是为了补偿中枢病变后步行自动化模式的匮乏,用以补充自动化和执行步行控制
。较为有趣的是,我们发现,伴有执行功能障碍和注意力缺陷的卒中者在数学计算-步行双重任务中步速的显著降低。其可能的原因是,由于脑卒中患者随意性控制下降及本体感觉障碍,平衡调节和维持需要更高的集中注意力才能完成
,这从一定层面上解释了步速降低、双支撑延长及步速变异性增大的部分原因。
1.2.1 生物力学测试方案 50个反光Marker依据Vicon动作捕捉方案依次粘贴于身体骨性标志处。采用三维红外运动捕捉系统(Vicon Motion Systems, T40, UK)和三维测力台(AMTI, OR6-GT1000, USA)同步采集步态中的运动学和动力学参数,采样频率分别为100 Hz和1000 Hz。在本研究中,认知-步行双重任务测试要求受试者一边步行,一边进行10—3的连续递减计算
。其中,要求受试者以自我选择速度进行步态测试,在正式测试前,要求受试者完成5次步态预测试,以充分熟悉实验场地和实验意图。正式实验采集3次成功的数据用以后续数据处理分析。
优先注意资源的限制和环境需求导致机体在面对不同认知任务时,出现不同的应对策略
。Patel等
的研究评估添加不同类型认知任务的效果,结果发现连续减法中认知消耗最高。与本研究结果较为不一致的是,上述研究发现数学计算的介入并没有显著降低步态表现,其认为这是步行自动化的结果。造成这种结果不一致的原因可能归因于受试者的不同,健康老年人在脑功能、步态表现和认知资源容量上均优于脑卒中患者
。这也可能暗示在临床康复中设计双重任务干预类型时,应根据患者认知水平和功能水平进行选择。
水体沉积物是水体营养元素的重要蓄积库,是水体营养盐的缓冲剂,维持水中营养盐平衡,在水体缺乏营养时,水生生物的生长主要是靠沉积物释放的营养盐维持调节。磷是造成水质富营养化的关键性的限制性因素之一[1]。城市河流闸控滞流,水力流通性差,造成大量沉积物淤积,内源负荷累积。城市河流沉积物磷的沉积物-水界面交换和输送研究具有重要意义。
本研究存在着一些限制:①本研究采用MoCA量表对受试者认知功能中的各项能力进行了评估,但并未进一步分析MoCA分项得分,尤其是执行功能、注意力与步态变异性及动态稳度的相关性;②我们基于前人研究结果,在前言和讨论部分进行了脑功能和步态控制的相关讨论,但并没有进行双重任务下的脑功能评估。未来研究可在此基础上,通过纳入涉及不同脑区的认知任务,采用近红外技术明确不同认知双重任务下的步态控制、跌倒风险与脑功能潜在关系。
综上所述,卒中后执行功能障碍和注意力缺陷改变了双重任务下的步行模式,对步态变异性和动态稳度产生显著的负面影响。建议临床康复治疗中,应多设计包含运动控制和数学计算的双重任务训练,以期降低跌倒发生率。
[1] Graff-Radford J. Vascular Cognitive Impairment [J]. CONTINUUM Lifelong Learning in Neurology, 2019, 25 (1): 147-164.
[2] 王延延, 安丙辰,郑洁皎. 脑卒中后认知障碍引起跌倒的机制研究进展 [J]. 中国康复理论与实践, 2016, 22(11):1285-1288.
[3] 张阳,Pinter D. 年轻脑卒中患者认知功能障碍的发病率 [J]. 中国康复, 2019, 34(9):476-478.
[4] 朱玲玲,绳宇. 血管性轻度认知障碍老年人双重任务行走下步态参数特征与跌倒的关系 [J]. 中国康复理论与实践, 2020, 26(4):467-471.
[5] 叶明珠, 熊健, 王乐聪, 等. 老年认知障碍与跌倒的相关性研究进展 [J]. 中国康复, 2020, 35(07):383-386.
[6] Al-Yahya E, Johansen-Berg H, Kischka U, et al. Prefrontal cortex activation while walking under dual-task conditions in stroke: a multimodal imaging study [J]. Neurorehabilitation & Neural Repair, 2016, 30 (6): 591-599.
[7] Hawkins K A, Fox E J, Daly J J, et al. Prefrontal over-activation during walking in people with mobility deficits: Interpretation and functional implications [J]. Hum Mov Sci, 2018, 59(5): 46-55.
[8] 刘玉,李庆雯. 双任务训练在脑卒中患者下肢康复中的研究进展 [J]. 中国康复医学杂志, 2020, 35(1):100-105.
[9] Tombu M, Jolicoeur P. All-or-none bottleneck versus capacity sharing accounts of the psychological refractory period phenomenon [J]. Psychol Res, 2002, 66 (4): 274-86.
[10]Yang L, Lam F M, Huang M, et al. Dual-task mobility among individuals with chronic stroke: changes in cognitive-motor interference patterns and relationship to difficulty level of mobility and cognitive tasks [J]. Eur J Phys Rehabil Med, 2017, 54 (4): 526-535.
[11]Clark D J. Automaticity of walking: functional significance, mechanisms, measurement and rehabilitation strategies [J]. Front Hum Neurosci, 2015, 9(2): 246-252.
[12]Maidan I, Nieuwhof F, Bernad-Elazari H, et al. The role of the frontal lobe in complex walking among patients with parkinson's disease and healthy older adults: an fNIRS study [J]. Neurorehabil Neural Repair, 2016, 30 (10): 963-971.
[13]Al-Yahya E, Dawes H, Smith L, et al. Cognitive motor interference while walking: a systematic review and meta-analysis [J]. Neuroscience & Biobehavioral Reviews, 2011, 35 (3): 715-728.
[14]Mink J W. The basal ganglia: focused selection and inhibition of competing motor programs [J]. Progress in Neurobiology, 1996, 50 (4): 381-425.
[15]黄彩平, 谢欲晓, 王思远, 等. 步行-执行功能双任务训练对慢性脑卒中患者康复的研究进展 [J]. 中国康复医学杂志, 2018, 33(8):988-992.
[16]Holden A, Wilman A, Wieler M, et al. Basal ganglia activation in Parkinson's disease [J]. Parkinsonism Relat Disord, 2006, 12 (2): 73-77.
[17]Patel P, Bhatt T. Task matters: influence of different cognitive tasks on cognitive-motor interference during dual-task walking in chronic stroke survivors [J]. Top Stroke Rehabil, 2014, 21 (4): 347-357.
[18]梁雷超, 黄灵燕, 伍勰, 等. 膝骨关节炎对女性老年人步行动态稳定性的影响 [J]. 体育科学, 2016, 36(03):61-66.
[19]张丽, 卞立, 陈煜, 等. 脑卒中后认知功能障碍的康复评估与治疗进展 [J]. 中国康复, 2020, 35(12):660-663.
[20]Herman T, Mirelman A, Giladi N, et al. Executive control deficits as a prodrome to falls in healthy older adults: a prospective study linking thinking, walking, and falling [J]. J Gerontol A Biol Sci Med Sci, 2010, 65 (10): 1086-1092.
[21]Montero-Odasso M, Verghese J, Beauchet O, et al. Gait and cognition: a complementary approach to understanding brain function and the risk of falling [J]. J Am Geriatr Soc, 2012, 60 (11): 2127-2136.
[22]梁雷超, 吕娇娇, 黄灵燕, 等. 认知-姿势控制双任务在老年人跌倒研究中的应用进展 [J]. 中国康复理论与实践, 2016, 22(11):1289-1293.
[23]van Vugt Y, Stinear J, Claire Davies T, et al. Postural stability during gait for adults with hereditary spastic paraparesis [J]. J Biomech, 2019, 88(11): 12-17.
[24]Hof A L, Gazendam M G, Sinke W E. The condition for dynamic stability [J]. J Biomech, 2005, 38 (1): 1-8.
[25]Cohen J A, Verghese J, Zwerling J L. Cognition and gait in older people [J]. Maturitas, 2016, 93(9): 73-77.
[26]Watson N L, Rosano C, Boudreau R M, et al. Executive function, memory, and gait speed decline in well-functioning older adults [J]. J Gerontol A Biol Sci Med Sci, 2010, 65 (10): 1093-1100.
[27]Annweiler C, Beauchet O, Bartha R, et al. Motor cortex and gait in mild cognitive impairment: a magnetic resonance spectroscopy and volumetric imaging study [J]. Brain, 2013, 136 (3): 859-871.
[28]Montero-Odasso M, Speechley M, Chertkow H, et al. Donepezil for gait and falls in mild cognitive impairment: a randomized controlled trial [J]. Eur J Neurol, 2019, 26 (4): 651-659.
[29]Hermand E, Tapie B, Dupuy O, et al. Prefrontal cortex activation during dual task with increasing cognitive load in subacute stroke patients: a pilot study [J]. Front Aging Neurosci, 2019, 11 (2): 160-166.
[30]Mihara M, Miyai I, Hatakenaka M, et al. Sustained prefrontal activation during ataxic gait: a compensatory mechanism for ataxic stroke[J]. Neuroimage, 2007, 37 (4): 1338-45.
[31]钟琳晔, 刘喆, 常冬梅, 等. 探究恢复期脑卒中患者注意力缺陷与平衡控制及跌倒的关系 [J]. 中国康复理论与实践, 2010, 16(12):1160-1163.
[32]王丹丹, 霍博雅. 脑卒中恢复期患者注意力缺陷与平衡功能、日常生活活动能力及跌倒的关系 [J]. 广东医学, 2012, 33(7):932-934.
[33]Chen N, Xiao X, Hu H, et al. Identify the alteration of balance control and risk of falling in stroke survivors during obstacle crossing based on kinematic analysis [J]. Front Neurol, 2019, 10(5): 813-826.
[34]Den Otter A R, Geurts A C, de Haart M, et al. Step characteristics during obstacle avoidance in hemiplegic stroke [J]. Exp Brain Res, 2005, 161 (2): 180-192.
