藤黄健骨片治疗骨关节炎的作用机制*
2022-03-01陈天鑫聂立聪朱瑜琪
陈天鑫,聂立聪,朱瑜琪
中国中医科学院眼科医院 北京 100040
骨关节炎(osteoarthritis,OA)是一种退行性骨关节疾病,>65 岁的人群中发病率可达到50%,主要表现为关节的疼痛、肿胀和活动受限,并可导致肌肉萎缩和关节畸形,严重影响患者生活质量[1]。OA在中医属于“痹证”范畴[2],中国历代医家多认为痹证的主要病因包括“风、寒、湿”三邪,可侵犯体表,阻碍经络、气血运行[3]。藤黄健骨片(湖南方盛制药股份有限公司)源于名老中医的经验方,临床观察数据[4]显示其治疗OA疗效显著,不仅对局部疼痛和功能障碍有明显改善,而且能提高患者的生活质量,帮助其恢复正常的工作和生活。研究[5]证实藤黄健骨片具有镇痛、活血化瘀的作用。本文拟通过网络药理学和分子对接探讨藤黄健骨片治疗OA的可能机制。
资料与方法
1 藤黄健骨片活性成分的收集与筛选
在中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology,TCMSP,https://tcmspw.com/tcmsp.php)中分别以熟地黄、鹿衔草、骨碎补、肉苁蓉、淫羊藿、鸡血藤及莱菔子为关键词,获得藤黄健骨片中所含药物的化学成分。目前研究认为,口服生物利用度(oral bioavailability,OB)>30%符合人体对药物的利用程度[6],类药性(drug-likeness, DL)>0.18表明该成分具有成药性的可能[7],因此使用ADME参数筛选可能的活性小分子时,便通过设定OB≥30%、DL≥0.18筛选获得其最终活性成分。运用TCMSP查找筛选所得活性成分对应的靶点信息,将所得靶点信息输入Uniprot(https//www.uniprot.org/)获取靶点对应的基因Symbol。
2 OA相关疾病靶标的获取
以“Osteoarthritis”作为关键词,分别在GeneCards数据库[8](https://www.Genecards.org)、OMIM数据库[9](https://omim.org)、TTD 数据库[10](http://db.idrblab.net/ttd/)和 Drug Bank 数据库[11](https://go.drugbank.com/)检索与OA相关的靶标基因,将得到的数据汇集并去重。
3 药物-活性成分-OA疾病靶点网络的构建
为明确藤黄健骨片与OA潜在靶点间的相互作用,将藤黄健骨片活性成分对应的靶点与OA靶点基因导入Venny网站(https://bioinfogp.cnb.csic.es/tools/venny/),并绘制交集靶点的韦恩图。借助 Cytoscape3.7.2 软件把靶点蛋白构筑“药物-活性成分-疾病靶点”网络并进行分析。
4 构建交集靶点蛋白互作网络(PPI)和获取关键靶点
为进一步了解靶点之间的相互作用,明确关键靶点,将交集靶点输入String 数据库进行检索,设定物种为“Human”(人类),在设置中设定“Highest confidence”0.9,其余设定不变, 获取交集靶点互作网络(PPI),并导出网络的TSV格式文件,将其导入Cytoscape 3.7.2软件进行可视化处理;通过Degree值得到关键靶点。
5 进行GO功能富集和KEGG通路富集分析
将交集靶点导入Metascape数据库(http://metascape.org/gp/index.html)进行GO功能富集分析(包括分子功能(molecular function,MF)、细胞成分(cellular component,CC)、生 物 过 程(biological process,BP)和 KEGG通 路 富 集 分 析,并 运 用GraphPad Prism软件对分析结果进行可视化处理,以体现藤黄健骨片治疗OA的主要作用通路。
6 分子对接与最低结合能图的构建
使用Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)查找藤黄健骨片关键活性成分的3D结构,并导入autodock软件进行能量最小化处理;并利用RCSB PDB数据库(http://www1.rcsb.org/)查找关键靶点的蛋白结构3D结构,结果导入autodock软件,通过去水、加氢、加电荷处理;将处理后的活性成分和靶点相关蛋白在AutoDock Vina软件[12]进行分子对接,并计算最低结合能,将最低结合能最低的一组通过Pymol 2.4.0软件进行可视化处理。
结 果
1 药物活性化合物及筛选靶点结果
通过TCMSP平台共收集到藤黄健骨片化合物478个,熟地黄96个,鹿衔草36个,骨碎补71个,肉苁蓉25个,淫羊藿130个,鸡血藤68个,莱菔子52个。以DL≥0.18、OB≥30%为筛选条件,共筛选出85个具有较高活性的化合物,分别是熟地黄2个,鹿衔草9个,骨碎补18个,肉苁蓉6个,淫羊藿23个,鸡血藤24个,莱菔子3个,去重后得到70个化合物的活性成分;利用UniProt数据库对有效成分进行靶点基因注释,并删去无法获得基因symbol与重复的靶点,共得到251个药物靶点。
2 OA疾病靶点结果
在GeneCards数据库、OMIM数据库、TTD数据库和DrugBank数据库检索OA疾病相关靶点共1305个,去重后共1015个疾病靶点。
3 绘制药物-活性成分-疾病靶点图
运用Cytoscape 3.7.2软件构建藤黄健骨片治疗OA的药物-活性成分-疾病靶点共表达网络图,见图1,其中绿色菱形代表疾病靶点,红色圆形代表药物,六边形代表各药物活性成分,A1、A2、B1、B2、B3、B4、C1、C2代表药物共有活性成分,见表1。根据药物-活性成分-疾病靶点共表达网络图可得出Degree值前五的活性成分分别是quercetin(槲皮素)、kaempferol(山奈酚)、luteolin(木犀草素)、beta-sitosterol(β-谷甾醇)和Stigmasterol(豆甾醇)。网络图说明同一药物活性成分对应于不同的作用靶点,同一靶点也可对应于不同的药物活性成分,显示出藤黄健骨片治疗OA多成分、多靶点的特点。

表1 各药物共有活性成分表
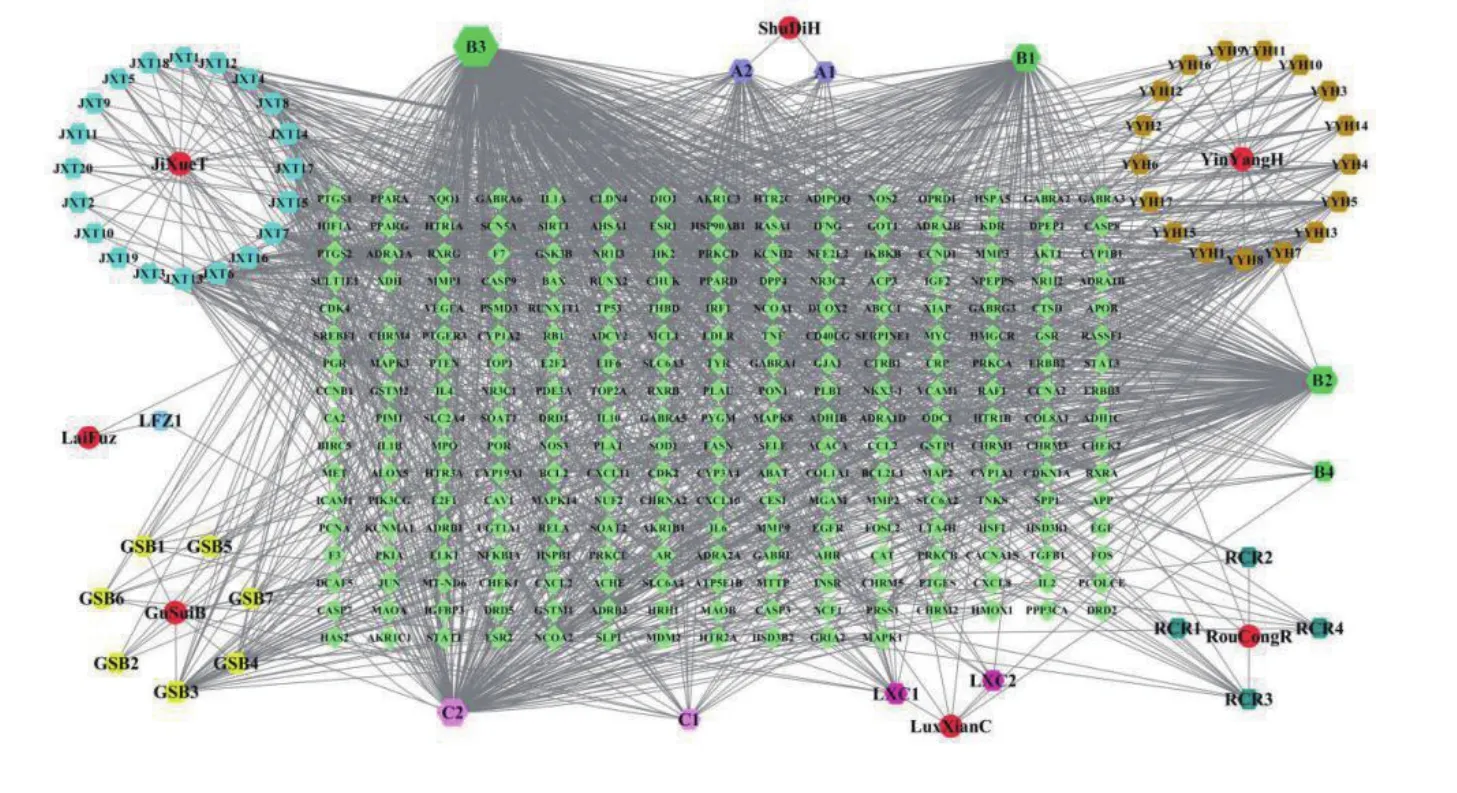
图1 藤黄健骨片治疗OA的“药物-活性成分-疾病靶点图”
4 交集靶点蛋白互作网络(PPI)和关键靶点结果
将药物活性成分对应的靶点与疾病靶点基因导入Venny网站,并绘制交集靶点的韦恩图,见图2,得到二者交集基因共117个。将交集基因导入String数据库检索获取PPI网络图,在设置中设定“Highest confidence”0.9,得到109个靶点,并导出TSV格式文件,用Cytoscape 3.7.2 软件进行可视化处理,见图3,其中颜色越红,面积越大代表degree值越大。根据degree值排名,取前十名为关键靶点见表2。

图3 藤黄健骨片与OA共同靶点PPI网络图

表2 藤黄健骨片治疗OA关键靶点信息表
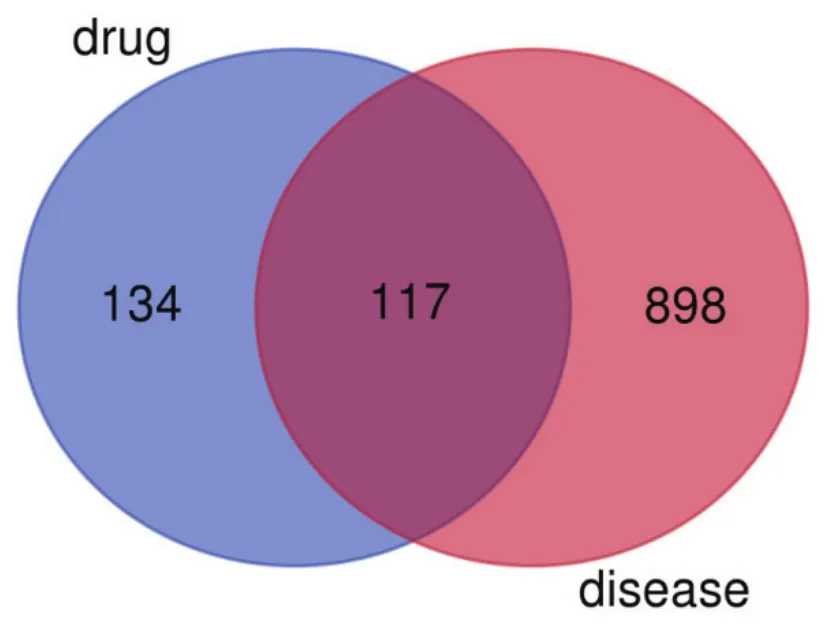
图2 藤黄健骨片活性成分靶点与OA疾病相关靶点映射的韦恩图
5 GO功能富集和KEGG通路富集分析结果
通过将117个交集靶点导入Metascape数据库进行GO功能富集分析和KEGG通路富集分析,以P<0.01进行筛选,一共得到2171条生物过程,包括对有毒物质的反应(response to toxic substance)、对无机物的反应(response to inorganic substance)、对脂多糖的反应(response to lipopolysaccharide)细胞对有机环状化合物的反应(cellular response to organic cyclic compound)、对细胞外刺激的反应(response to extracellular stimulus)等,其中前20条见图4,KEGG分析共得到320条信号通路,包括癌症通路(Pathways in cancer)、糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、IL-17信 号 通 路(IL-17 signaling pathway)、蛋白聚糖在癌症中(Proteoglycans in cancer)等,其中前20条见图5。为了直观反映靶点和信号通路之间的联系,对藤黄健骨片治疗OA关键通路作了“靶点-信号通路”网络图,其中黄色代表信号通路;绿色代表靶点,见图6。

图4 GO分析的Top20生物过程图
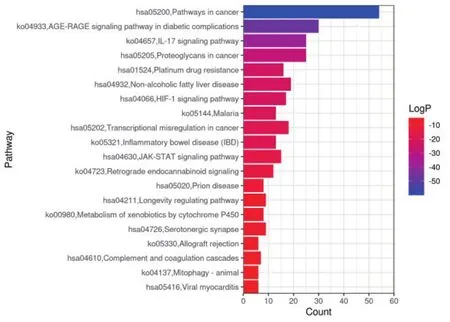
图5 KEGG分析的Top20信号通路图

图6 藤黄健骨片治疗OA的“靶点-信号通路”图
6 分子对接结果与最低结合能图
将关键活性成分quercetin(槲皮素)、kaempferol(山奈酚)、beta-sitosterol(β-谷甾醇)、luteolin(木犀草素)与关键靶点IL-6、TP53、TNF和PTGS2分别进行分子对接并计算最低结合能,结果见图7,其中PTGS2与木犀草素、β-谷甾醇的最低结合能最低,均为-9.3kcal·mol-1,选取PTGS2与木犀草素的分子对接结果进行可视化处理,结果见图8。

图7 藤黄健骨片治疗OA重要活性成分与关键靶点分子对接最低结合能图

图8 活性成分木犀草素与关键靶点PTGS2分子对接图
讨 论
槲皮素、山奈酚、木犀草素和β-谷甾醇可能是藤黄健骨片中的关键成分。研究[13]表明:槲皮素通过抑制软骨细胞的炎症和凋亡,发挥软骨保护作用。其通过激活SIRT1/AMPK信号通路抑制内质网应激[14]。体内及体外实验[15-17]表明:槲皮素能通过干扰NF-κβ信号通路明显降低IL-1β、TNF-α、IL-6等细胞因子的表达,保护关节软骨。山奈酚通过抑制NF-κB途径,显着降低白细胞介素1β刺激的大鼠OA软骨细胞促炎介质的表达,从而预防、停止或延迟OA的发展[18],Huang等[19]研究显示山奈酚的抗炎作用是通过抑制丝裂原激活蛋白激酶相关的细胞外信号调节激酶和P38信号通路介导的,能显著抑制IL-1β诱导的炎症介质蛋白的表达。木犀草素能显著降低IL-1β诱导的NO、PGE2等的生成以及COX-2、iNOS等的表达,防止OA大鼠的软骨破坏和增强II型胶原的表达[20]。木犀草素能有效减轻炎症反应,保护软骨细胞,延缓软骨变性[21]。β-谷甾醇等植物甾醇具有抗炎症、抗氧化和调节人体相关激素等多种生理作用[22]。
IL-6、TP53、TNF和PTGS2可能是治疗OA的潜在靶点。IL-6在OA关节内产生,并在OA的发病机制起重要作用[23],IL-6主要通过Stat3信号传导诱导软骨细胞分解代谢,系统性阻断IL-6可减轻二甲基甲酰胺诱导的小鼠OA[24],IL-6过量的产生已被证明与老年人膝关节软骨丢失密切相关[25];P53是一种肿瘤抑制基因,主要作用是在G1期或S期停止细胞周期,从而修复受损细胞[26],zhu等[27]认为P53上调可能促进软骨细胞凋亡在KOA的进展。TNF是触发关节软骨合成代谢和分解代谢失衡的介质,能刺激MMP-1、MMP-3和MMP13的释放,抑制OA中蛋白聚糖Ⅱ型胶原的合成[28-29]。PTGS2是炎症性PG生物合成的关键酶之一,可能是潜在的炎症性生物标志物[30-31],有研究也发现了在人类OA软骨细胞中高表达的PTGS2[32],其过度表达损害蛋白聚糖的合成,增强软骨中对Ⅱ型胶原和软骨聚集蛋白聚糖的降解[33]。
IL-17信号通路、HIF-1信号通路、JAK-STAT信号通路可能是治疗OA的关键通路。IL-17是关键炎症细胞因子,在自身免疫性疾病和组织炎症中起着关键作用[34],阻断IL-17信号通路可以有效预防及治疗OA[35]。HIF - 1α是低氧反应的主要调节因子之一,在骨建模、骨重塑和稳态中发挥重要作用。其通过激活JAK2/STAT3通路增强破骨细胞的分化[36];了解参与HIF-1α信号通路的多态性之间的相互作用,可以为识别膝骨性关节炎高危人群提供新的诊断支持工具[37]。JAK/STAT信号的激活对于使OA发展为滑膜关节衰竭的慢性炎症状态持续存在至关重要[38]。Lim等[39]研究发现阻断该信号通路可能在软骨退变中具有软骨保护作用。
本文通过网络药理学和分子对接探讨藤黄健骨片治疗OA的机制,发现藤黄健骨片中的槲皮素、木犀草素、山奈酚和β-谷甾醇等很可能通过 IL-6、TP53、TNF和PTGS2等靶点作用于IL-17信号通路、HIF-1信号通路、JAK-STAT信号通路,从而发挥治疗OA的作用。但是由于数据库不够完整、不同算法预测的结果不同等原因[40],网络药理学仍然有很大的局限性,需要基础实验和临床研究对结果进一步验证。
