草乌甲素可溶性微针的制备、质量评价及体外透皮性能研究
2022-02-28李锐婷李丽云孙文强丁江生
李锐婷,李丽云,孙文强,丁江生
(1.云南中医药大学,云南 昆明 650500;2.云南省药物研究所,云南 昆明 650111;3.云南省中药和民族药新药创制企业重点实验室,云南 昆明 650111)
疼痛是最常见的临床症状之一,全球近三分之一的人口深受疼痛困扰,特别是慢性疼痛,严重影响患者的生活质量和工作效率。草乌甲素为毛茛科乌头属植物龙头乌头(AconitumLongtounenseT.L.Ming)提取分离出来的二萜双酯生物碱,又叫滇西嘟拉碱甲(bulleyaconitine A)。草乌甲素是我国20世纪80年代自主研发的新型第三类镇痛药物,不具有耐受性和成瘾性,镇痛作用分别是吗啡的65倍和阿司匹林的7 000倍,临床上已广泛用于治疗关节痛和神经病理性疼痛、癌症晚期疼痛等[1-2]。目前,草乌甲素已上市的剂型有注射剂、片剂和胶囊。草乌甲素因药效强,毒性大,对黏膜、肌肉等组织具有较强的刺激性,注射给药时局部会产生剧烈疼痛,使用不方便,口服时首过效应明显,生物利用度低,胃肠道反应较明显[3]。
微针(microneedle)是指直径小于几十微米、长度为25~2000 μm 的针状结构[4],通过刺穿皮肤角质层进行透皮给药,基本不产生皮肤损伤和疼痛感。可溶性微针(dissolving microneedle,DMN)是微针中的一类,由水溶性高分子材料制备而成,具有给药效率高、安全性好、生物相容性好等优势[5],现已广泛用于多种药物的经皮给药研究。本文选取草乌甲素为模型药物,采用正交试验优选微针的处方及制备工艺,以期获得具有镇痛作用的草乌甲素可溶性微针,并对微针的表观、机械强度、体外释放、稳定性等进行研究。
1 仪器与材料
1.1 材料 草乌甲素(昆明制药集团有限公司,批号:20140518);透明质酸(HA,华熙福瑞达生物医药有限公司,批号:1906173);聚乙烯基吡咯烷酮(PVP K30,博爱新开源医疗科技集团股份有限公司,批号:C200210012);聚乙烯醇1788型(PVA,美国阿拉丁,批号:G1509033);次甲基蓝(上海试剂一厂,批号:20161018);乙醇为分析醇,乙腈为色谱纯,水为实验室自制超纯水。
1.2 主要设备及仪器 低速离心机(TD5A-WS,湖南湘仪离心机仪器有限公司);真空干燥箱(BPZ-6210LC,上海一恒科学仪器有限公司);电子天平[1225020258,梅特勒-托利多仪器(上海)有限公司];电子天平(EX 125 ZH,奥豪斯仪器有限公司);电热鼓风干燥箱(DHG-9145A,上海一恒科学仪器有限公司);高效液相色谱仪(Agilent 1260,美国Agilent公司);可调移液器(16018203,德国赛多利斯);数显推拉力计(HF-50,温州市海宝仪器有限公司);测摇式测试台(HCS-500,温州市海宝仪器有限公司);透皮扩散试验仪(TK-12D,上海锴凯科技贸易有限公司);微针模具(ST-05,新加坡Micropoint Technologies);体视显微镜(M205C,德国徕卡公司)。
1.3 实验动物 SD小鼠,体重200~240 g,雄性,北京华阜康生物科技股份有限公司,许可证号:SCXK (京) 2019-0008,合格证号:1103221911011030。
2 方法与结果
2.1 微针的制备
2.1.1 基质填充方法筛选 采用模具分层浇筑法制备可溶性微针,主要分为两步,第一步:将含药物的基质填充至模具针尖部分,除去模具表面多余的针尖基质,干燥1 h;第二步:填充背衬基质,干燥固化即得微针。本试验开展了离心法和真空法填充基质的对比研究。
采用离心法填充基质时,在3 000~4 000 r·min-1条件下离心10~20 min下,基质溶液能充分进入模具针尖部分,干燥后制得的微针阵列针形完整,且无大量气泡产生;采用真空法填充基质时,抽真空至10 Pa,当基质浓度较高时,抽真空会使基质产生大量气泡,致使基质溶液不能完全进入模具针尖部分,制得的样品针尖不完整。
因此,制备可溶性微针时采用离心法(3 500 r·min-1,10 min)对基质溶液进行填充。
2.1.2 基质的筛选
2.1.2.1 单一基质的筛选 根据材料的力学特性,将基质材料分为韧性材料和脆性材料。通常,韧性材料具有较佳的韧性、可塑性,制备的可溶性微针不易碎裂,但机械强度不足,无法刺入皮肤给药;脆性材料具有较强的硬度,不易发生形变,制备微针的机械强度佳,但给药时易碎裂。本研究对多种常用制备可溶性微针的基质如PVA、PVP K30、HA、CMC-Na、HPMC等进行筛选,判断其力学特性,并对其制备微针的情况进行研究。
单一基质的筛选结果如表1所示,脆性材料中HA(分子量为7 kDa)、PVP K30、PVP K90制备可溶性微针的成型性、机械强度较佳;韧性材料中PVA、HPMC制备可溶性微针的成型性、韧性较佳。胡霞[6]研究表明,PVP K90 在高浓度(160 mg·mL-1)时具有一定的细胞毒性,而本研究中PVP K90制备微针的浓度为200~300 mg·mL-1,因此选择PVP K30、HA(低分子量)作为针尖基质与韧性材料PVA、HPMC进行复合基质的筛选。

表1 多种材料制备可溶性微针的情况
2.1.2.2 复合基质的筛选 为得到机械强度良好、韧性较佳的可溶性微针,本研究将筛选出的脆性材料和韧性材料相结合,筛选制备可溶性微针的最佳复合基质,结果如表2所示。

表2 复合基质的制备微针的情况
结果表明,将PVP K30和HA(7 kDa分子量)混合配成浓度为0.3 g·mL-1的溶液作为针尖基质,浓度为15%PVA作为背衬基质时制备的微针机械强度良好、韧性较佳。
2.1.2.3 基质比例及浓度筛选 根据复合基质的筛选结果,对针尖基质HA和PVP K30的比例进行研究。对HA∶PVP K30的重量比例1∶9、2∶8、4∶6、6∶4进行考察,根据微针贴片的完整度、机械强度选择HA∶PVP K30为2∶8、4∶6、6∶4作为正交试验中针尖基质比例的三水平。
1.3 统计学方法 采用SPSS 19.0统计学软件对数据进行分析。计量资料用均数±标准差表示,组间比较采用t检验。在分析过程中,多组间的数据比较处理采用One-way ANOVA方法进行分析。以P<0.05为差异有统计学意义。
2.1.3 溶剂种类及浓度的筛选 不同的溶剂对微针的成型性、机械强度、药物分布等有不同的影响。因草乌甲素不溶于水,易溶于乙醇、乙醚、稀盐酸等。为避免制备过程中残留的溶剂在给药过程中损害人体健康,本研究选择毒性较小的乙醇作为溶剂,且乙醇能有效抑制微针中药物向背衬层扩散[7]。分别考察了35%、45%、60%、75%的乙醇溶液对微针成型性的影响,结果表明,微针的成型性、机械强度随乙醇浓度的升高而降低,因此选择溶剂乙醇浓度35%、45%、60%作为正交试验的三水平。
2.1.4 干燥温度的筛选 微针贴片制备过程中,干燥温度会影响微针的成型性、机械强度、制备周期等。温度过高时,干燥过程中容易产生气泡,且制备的微针贴片较脆、易碎;温度低容易造成干燥时间长、延长了制备周期。本试验对干燥温度25、35、45、55 ℃进行考察,结果表明随干燥温度的升高微针的完整度、机械强度会降低,但25 ℃时所需干燥时间过长。因此选择35、45、55 ℃作为正交试验中干燥温度的三水平。
2.1.5 正交试验 根据筛选结果,采用L9(34)正交试验,对针尖基质HA∶PVP K30比例(A)、干燥温度(B)、溶剂浓度(C)进行考察,以微针表征、机械强度、易脱模程度、干燥时间等综合评分为标准设计正交试验(见表3),自制评分标准见表4,正交结果见表5,方差分析见表6。

表3 L9 (34)正交设计
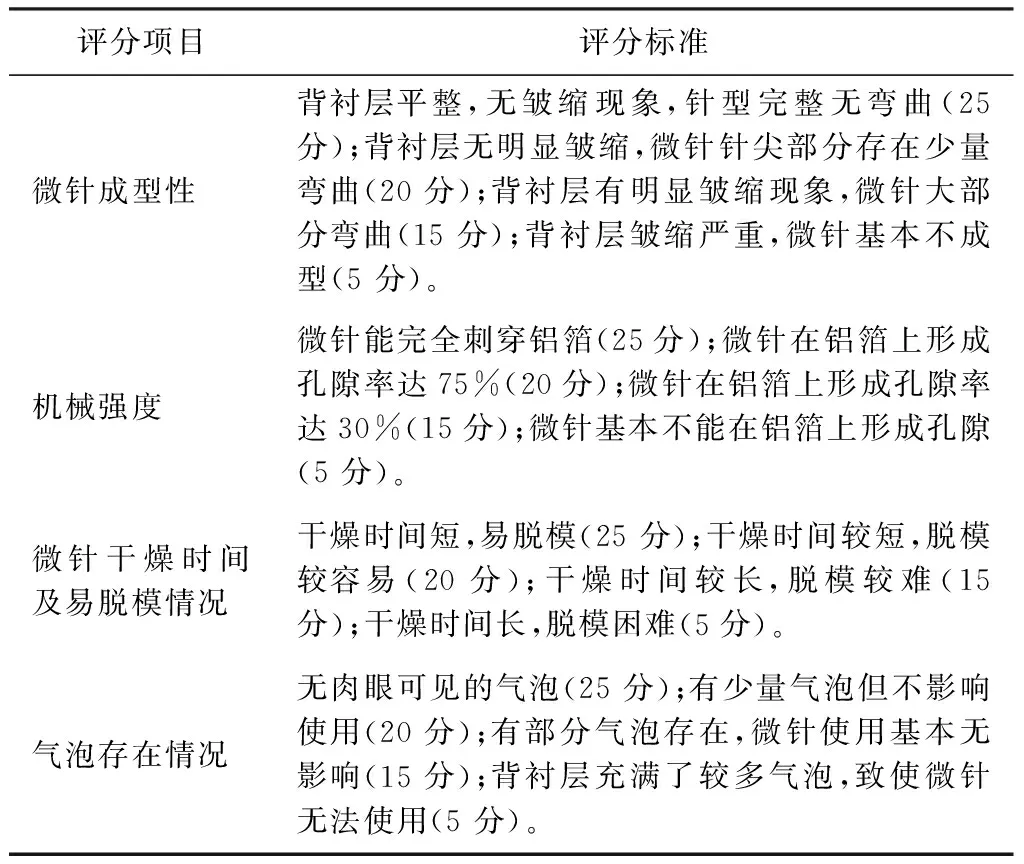
表4 可溶性微针的评分标准

表5 制备空白微针的正交试验安排与结果

表6 微针综合评分方差分析结果
极差分析显示,各因素中针尖基质比例(A)对微针的综合评分影响最大,因素影响顺序为A>C>B。方差分析显示,因素A对微针的综合评分具有显著性影响(P<0.05)。根据试验结果得出,制备可溶性微针的最佳工艺处方为 A2B1C2,即针尖基质HA∶PVP K30=4∶6,干燥温度35 ℃,溶剂浓度为45%。
2.1.6 草乌甲素可溶性微针的制备 根据筛选的最佳处方,将草乌甲素原料药与针尖基质(HA∶PVP K30=4∶6)溶解混合,制成载药量为150、100、70 μg的草乌甲素可溶性微针。
2.2 微针的质量评价

A.测量微针贴片的大小;B.微针贴片;C.显微镜下的微针照片图1 草乌甲素可溶性微针的表观
2.2.2 微针机械强度
2.2.2.1 穿刺试验 将铝箔平铺,草乌甲素可溶性微针针尖向下放置,在一定压力下按压,观察微针穿刺铝箔的孔隙率和穿刺后微针的形态,铝箔纸厚约24 μm。取脱毛处理后的离体猪皮肤,用含次甲基蓝的微针穿刺猪皮,医用胶布固定,处理5 min后除去微针贴片,观察皮肤表面及微针的形态。
穿刺结果如图2所示,草乌甲素可溶性微针可刺穿铝箔,在铝箔上留下完整的穿刺孔道,穿刺后微针基本保持完整,针尖部分出现略微弯曲情况;离体猪皮上,微针形成了与微针阵列相一致的点状分布,表明微针机械强度良好,可顺利穿刺皮肤。

A.微针贴片穿刺铝箔的正面;B.微针贴片穿刺铝箔的背面;C.含次甲基蓝的微针贴片刺穿猪皮图2 可溶性微针贴片刺穿铝箔、猪皮的情况
2.2.2.2 压力-位移研究 本实验室自行组装对微针机械强度进行测试的仪器,将数显推拉力计(HF-50)固定在侧摇式测试台(HCS-500)上,通过手摇测试台实现拉力计的上下运动,根据微针在不同压力下的位移情况考察微针的机械强度。测试时选用直径为5 mm的探头,匀速下降,压力与位移的曲线图如图3所示,当位移达550 μm时,每针承受的力达0.222 N,压力移除时大部分微针针型完整,表明机械强度良好。

图3 操作示意图及位移-压力曲线图
2.2.3 微针的体外溶解释放情况 将含量为70 μg草乌甲素可溶性微针溶解于10 mL 35%的乙醇中,分别在0.5、1、2、4、5、6、8 min取样0.8 mL并立即补充相同体积的新鲜溶液。样品经0.45 μm滤膜过滤,HPLC法测定药物释放量,HPLC法测定草乌甲素的色谱条件根据《中国药典》[8]规定进行。结果表明,草乌甲素可溶性微针在35%的乙醇溶液中8 min时释放量达98.83%,释放曲线如图4所示。

图4 草乌甲素可溶性微针在体外的溶解释放情况
2.3 微针体外透皮释放情况 取健康SD小鼠,脱颈椎处死,小心去除腹部的毛,剥离皮肤,用手术刀刮去皮下组织,并用异丙醇多次擦拭去除剩余的皮下脂肪和筋膜,用生理盐水反复清洗,滤纸吸干水分,-20 ℃的冰箱中保存。
取直立式双室Franz扩散池(扩散面积为1.766 cm2,接收池容积为7 mL)进行微针(载药量为70 μg)体外透皮释放研究,考察不同比例的生理盐水-无水乙醇接收液中草乌甲素可溶性微针中药物体外透皮情况。微针贴片贴在处理过的皮肤上,拇指持续按压2 min,医用胶带固定后,将皮肤夹在扩散池的供体室和接收池之间,用角质层侧与接收溶液接触,排尽皮肤下的空气,盖上固定盖,用夹子固定好避免漏液,磁力搅拌速度设定为500 r·min-1,(37.0±0.5)℃恒温水浴。通过取样针在预定时间点(0.5、1、2、4、8、12、24、36、48 h)取样0.8 mL并立即补充相同体积的新鲜接收液。样品经0.45 μm滤膜过滤,HPLC法测定药物渗透量。根据下列公式1计算单位面积累积渗透量,考察不同接收液中载药微针的释放情况,每个时间点取5份样品药物释放量的平均值,结果如图5所示。
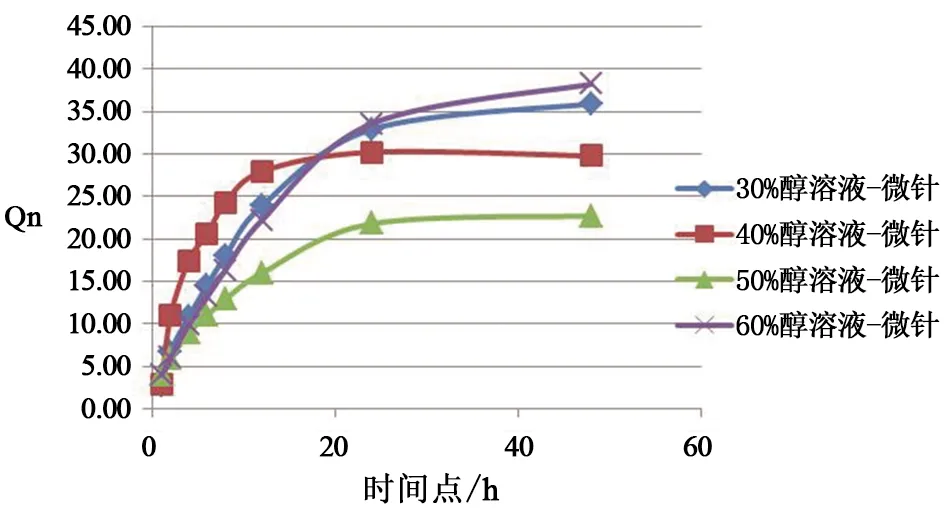
图5 不同接收液中草乌甲素体外透皮的单位面积累积渗透量情况(n=5)
(公式1)
Qn为第 n 个取样点草乌甲素的单位面积累积渗透量(μg·cm-2),Cn为第 n 个取样点草乌甲素的浓度(μg·mL-1),Ci为第i个取样点样品中草乌甲素的浓度(μg·mL-1),S为扩散池截面积(cm2),V0为接受室体积(mL),V为取样体积(mL)。
结果表明,草乌甲素可溶性微针的体外透皮释放在24 h内药物的释放量达到较高水平,然后慢慢趋于平稳。草乌甲素可溶性微针在接收液40%生理盐水+60%无水乙醇中释放量最高,24 h时释放率达84.67%,单位面积累积渗透量为33.56 μg·cm-2;48 h时释放率达96.41%,单位面积累积渗透量为38.22 μg·cm-2。
对草乌甲素可溶性微针体外释放量最高的曲线进行3种释放模型拟合,结果如表7所示,从数据可以看出,一级方程的R2值为0.997 2 ,为3种拟合方程中最高的,由此可见草乌甲素可溶性微针的体外透皮释放符合一级方程的释放规律。

表7 接收液4的释放曲线在3种模型的曲线拟合
3 讨论
基质材料对微针的制备至关重要,其力学特性会影响微针的成型性、机械强度等。单一基质的筛选中发现,同一物质,分子量不同,材料的力学特性不同,如透明质酸钠(HA)基质,当分子量大于10 000时,材料为韧性材料,可塑性强;当分子量小于10 000时,材料为脆性材料,制备的微针机械强度佳。
经稳定性研究发现,微针在高温环境中储存对会产生不良反应。高温环境中,密封储存的草乌甲素可溶性微针会由透明状态变为微黄色,且部分药物会向背衬层扩散,载药量越高,扩散越明显。载药量为150、100 μg的微针会在背衬层形成药物聚集的白色斑点,载药量为70 μg的微针在背衬层不会形成明显的药物聚集斑点。常温环境下,密封储存的草乌甲素可溶性微针的表征、机械强度基本保持不变,少量药物会向背衬层扩散,但不会在背衬部分形成药物聚集的斑点。因此,草乌甲素可溶性微针储存时应避免处于高温状态,以免造成药物向背衬层的流失。
微针体外透皮释放研究中,不同的接收液中微针的体外透皮释放情况不同。理论上接收液中无水乙醇含量越高,透皮释放量越多,但结果却与之有一定差异,这可能由于离体鼠皮部位的不同、角质层厚度不同、离体皮肤的处理差异、微针贴片间载药量存在差异等因素造成。
本研究以大分子药物草乌甲素作为模型,采用分层浇筑法制备草乌甲素可溶性微针,因药物处于针尖部分,因此可精确控制载药量。正交法优选制备微针的最佳工艺,制成的微针表征良好、针形完整,机械强度良好、韧性较佳,能成功刺穿铝箔,刺入皮肤以实现药物的有效渗透。草乌甲素可溶性微针作为草乌甲素的给药新剂型,能安全、有效、快速、方便地进行经皮给药,本研究能为其后续开发利用提供一定依据。
