MnO2的生长机理及其对罗丹明B的快速降解
2022-02-28王淑敏林海龙侯俊斌刘成功
王淑敏,林海龙,侯俊斌,田 源,李 超,刘成功
(1.辽宁大学 轻型产业学院,辽宁 沈阳 110036; 2.辽宁大学 化学院,辽宁 沈阳 110036)
1 前 言
罗丹明B(RhB)是一种阳离子呫吨染料,广泛应用于印刷、纺织和食品等行业。随着工业的快速发展,RhB作为工业废水中典型的有机污染物,产量日益增多,RhB会对人的呼吸道、皮肤和眼睛等造成刺激,甚至对人类和动物具有致癌性、生殖和发育毒性、神经毒性等,因此,研究RhB的降解对处理水污染有着重要意义。
MnO2是一种具有晶型多样、环保高效、氧化活性好等优点的过渡金属氧化物,在有机物催化降解领域具有潜在的应用前景[1-4]。[MnO6]为MnO2晶型的基本组成单元,连接方式的改变可出现(2×2)、(1×1)、(1×2)等隧道和层状结构,即α-,β-,γ-和δ-MnO2,这种共同的结构单元使得MnO2在一定条件下可以发生晶型转变。此外,MnO2的性能与其晶体结构和表面形貌有着密切的关系[5-12]。如He等[13]通过水热法和改变阴离子类型将δ-MnO2纳米片转化成α-MnO2纳米线和β-MnO2纳米棒,催化结果表明,与β-MnO2纳米棒相比,α-MnO2纳米线对二甲醚具有更优异的催化活性。Yu等[4]利用水热法,用不同的锰前驱体制备了一系列β-MnO2微米棒催化剂,并研究了β-MnO2微米棒对不同染料的催化效果,发现β-MnO2微米棒对不同染料的降解速率依次为亚甲基蓝>酸性橙II >RhB >甲基橙。Saputra等[14]利用水热法以MnSO4·H2O和过硫酸铵为原料合成了α-MnO2纳米线,β-MnO2纳米棒和γ-MnO2纳米纤维,催化性能研究结果表明,α-MnO2由于其高的比表面积、氧缺失和双隧道结构,在氧化还原苯酚中表现出最高的活性,β-MnO2由于单隧道和稳定的结构而显示出最低的活性,γ-MnO2表现出中等活性。Sun等[15]在酸溶液中加热KMnO4和十二烷基硫酸钠(SDS)合成了超薄δ-MnO2纳米片,研究发现δ-MnO2纳米片对RhB显示出高的氧化降解性能。综上可知,合成具有确定晶型和表面形貌的MnO2,并研究晶体的生长机理将是开发利用MnO2催化性能的重要前提。
MnO2的制备方法有很多[16-19],其中水热法由于其化学反应一般发生在较高温度及压力条件下,离子活性增加,沉淀物可以发生溶解和再结晶成核、生长,制备的MnO2分散性较好、结晶度较高。本研究利用简单的水热法,制备了不同晶型的MnO2,探究了MnO2的生长机理及其相变过程,并分析了α-MnO2+γ-MnO2对RhB的催化降解性能,本研究将为废水处理工作提供一定的理论依据。
2 实 验
2.1 实验试剂
采用的实验试剂有高锰酸钾(KMnO4)、四水合氯化锰(MgCl2·4H2O)、过氧化氢30%(H2O2)、罗丹明B(RhB),所有试剂均为分析纯。
2.2 MnO2的制备
将0.06 mol/L MnCl2·4H2O溶液缓慢滴入0.04 mol/L KMnO4溶液中,并在室温下以一定速度进行磁力搅拌,0.5 h后将混合溶液移至反应釜内,180 ℃下反应不同时间(0.5、2、4、8、12 h)。反应结束后,自然冷却至室温,过滤并用去离子水和无水乙醇分别多次洗涤,最后在恒温干燥箱中80 ℃干燥10 h,得到黑色粉末状样品,即为目标产物。
2.3 RhB催化过程
量取60 mL RhB溶液(20 mg/L)置于200 mL的烧杯中,加入10 mg的MnO2粉末,于25 ℃恒温水浴锅中磁力搅拌0.5 h,达到吸附-脱附平衡后吸取5 mL反应溶液进行离心,取上层清液。然后向反应溶液中加入6 mL 30%的H2O2,当反应时间为2、5、10、20、30、60、90 min时分别吸取反应溶液,离心后测定上层清液的吸光度及吸收光谱。RhB溶液的降解率R通过式(1)计算:
(1)
式中:C0为RhB溶液的初始浓度(20 mg/L),Ct为反应t时刻RhB溶液的浓度。
为了对比研究催化降解情况:①增加RhB溶液的用量(100 mL);②无MnO2的条件下,只加入6 mL 30% H2O2催化RhB溶液(60 mL);③无H2O2的条件下,只加入10 mg MnO2催化RhB溶液(60 mL),其他实验条件不变。
2.4 表征方法
X射线粉末衍射仪(XRD,D8)用于实验样品的物相分析;扫描电子显微镜(SEM,SU8010)、高分辨透射电子显微镜(HRTEM,JEM-2100F)用于样品的表面形貌和微观结构的表征;紫外-可见分光光度计(UV-Vis,2550)用于RhB溶液的吸收光谱及降解率的表征。
3 结果与讨论
3.1 MnO2晶型及形貌
图1是改变水热反应时间所合成产物的XRD图谱。与MnO2的PDF标准卡片(JCPDS-ICDD Card No.44-0141)对比,水热反应0.5 和2 h样品的衍射图谱在2θ=12.7°、18.2°、28.8°、37.4°、41.9°、49.8°、56.4°等处出现明显的特征峰,分别对应四方晶系α-MnO2的 (110)、(200)、(310)、(211)、(301)、(411)、(600)晶面;水热反应4、8、12 h合成的样品的衍射图谱在28.8°、37.4°、41°、42.8°、46.1°、56.7°、59.3°、65°、67.3°、72.4°处出现明显特征峰,分别对应四方晶系β-MnO2(JCPDS-ICDD Card No 24-0735)的(110)、(101)、(200)、(111)、(210)、(211)、(220)、(002)、(310)、(112) 晶面。此外,与PDF标准卡片(JCPDS-ICDD Card No.4-0644)对比,水热反应0.5、2、4 h合成的MnO2的衍射图谱在22.4°、37.1°、42.6°处出现的三个特征峰,分别对应γ-MnO2的(120)、(131)、(300) 晶面。当延长反应时间到12 h时,β-MnO2的衍射峰强度明显增加,说明MnO2晶体在逐渐长大。通过以上XRD图谱分析可知,水热反应0.5 和2 h合成了α-MnO2主晶相,并伴有少量γ-MnO2;将水热时间延长至4 h,MnO2由α晶型转变为β晶型,且仍伴有少量γ-MnO2;当水热时间延长到12 h时,样品仅为β-MnO2。由此,本研究提出一种MnO2晶型转变机制,即:随着水热时间的延长,α和γ晶型的MnO2逐渐向β晶型转变,直至水热时间为12 h时,样品完全转变成β晶型MnO2。

图1 不同水热反应时间所得MnO2样品的XRD图谱Fig. 1 XRD patterns of MnO2 samples obtained with different hydrothermal reaction time
图2是在不同水热时间反应时获得的MnO2样品的SEM图像。从图可见,水热时间0.5 h所制备的样品主要为分布均匀、形貌规整的杆状α-MnO2,杆长度约为1~3 μm,每根杆的两端较中间位置细,杆直径约为15~90 nm,此外,样品中还存在少量微片状γ-MnO2杂质。随着水热时间的延长,杆状MnO2的直径逐渐变粗,微片状MnO2也略有增多。当水热时间增加到8 h时,MnO2由杆状转变成柱状,且表面附着少量微片状杂质。当水热时间继续延长到12 h后,杆状及微片状MnO2消失,转化成两端为棱锥状、表面平滑、排列疏松的柱状β-MnO2。

图2 不同水热反应时间所得MnO2样品的SEM图像(a)~(b) 0.5 h; (c) 2 h; (d) 4 h; (e) 8 h; (f) 12 hFig. 2 SEM images of MnO2 samples obtained with different hydrothermal reaction time (a)-(b) 0.5 h; (c) 2 h; (d) 4 h; (e) 8 h; (f) 12 h
图3(a)、(d)、(g)、(h)分别为水热反应0.5、4、8和12 h制备的MnO2的TEM图像。从图3(a)中可以看到,杆状α-MnO2具有两端细中间粗的形貌特点,杆的长度及直径分别约为1~3 μm及15~90 nm;从图3(d)、(g)及(h)中可见,随着水热时间的增加,制备的MnO2直径变粗;当水热反应4 h时,MnO2直径约为30~90 nm,水热反应8及12 h的柱状β-MnO2直径约为0.5~1 μm,这与SEM观察结果相符。图3(b) ~ (c)、(e)~(f)和(i)分别为水热反应0.5、4和12 h制备的MnO2的HRTEM图像,图3(b)中0.70和0.24 nm的晶面间距分别对应α-MnO2的(110)和(211)晶面,图3(c)中0.40 nm的晶面间距对应于γ-MnO2的(120)晶面。图3(e)~(f)和(i)中0.31和0.24 nm的晶面间距分别对应于β-MnO2的(110)和(101)晶面,这与XRD分析结果相符。

图3 不同水热反应时间所得MnO2样品的TEM及HRTEM图像 (a)~(c) 0.5 h; (d)~(f) 4 h; (g) 8 h; (h)~(i) 12 hFig. 3 TEM and HRTEM images of MnO2 obtained with different hydrothermal reaction time(a)-(c) 0.5 h; (d)-(f) 4 h; (g) 8 h; (h)-(i) 12 h
3.2 MnO2的生长机理
水热法是一种在密封的水热反应釜中进行的制备方法,由于其中间反应过程不能直接被观察到,所以通过设计中间阶段的水热反应研究其生长机理。对比水热反应0.5与2 h制备的MnO2的XRD图谱,可以发现二者衍射峰没有发生位置变化,产物均为α-MnO2和γ-MnO2,但是反应2 h的样品衍射峰更窄、更尖锐,即随着水热时间延长,晶体生长更加完善。将水热反应4 h样品的衍射峰与2 h样品的相比,可以发现特征衍射峰位置发生了明显的改变,α-MnO2的(110)、(200)、(411)等晶面溶解消失,28.8°、37.4°、56.7°等处出现特征峰,分别为β-MnO2的(110)、(101)、(211)等晶面,说明此时MnO2由α型转换为β型。此外,β-MnO2的
衍射峰强度随水热时间的延长迅速增强,表明β-MnO2的晶体在快速生长,但在22.4°、37.1°、42.6°处仍出现衍射峰,为γ-MnO2的特征峰,表明这一阶段主要发生α-MnO2、γ-MnO2向β-MnO2的转变。当水热时间为12 h时,β-MnO2的衍射峰更强更尖锐,且γ-MnO2的特征衍射峰消失,表明此时产物为结晶性更好、晶体生长更加完整的β-MnO2。
通过对比水热反应0.5~8 h获得产物的SEM及TEM图像也可以观察到α-MnO2、γ-MnO2向β-MnO2的转变。从图2(a) ~(e)中可以发现,随着水热反应时间的增加产物的直径增加,杆状α-MnO2(或柱状β-MnO2)与微片状γ-MnO2同时存在,并且由图3(e) ~ (f)可知晶面间距0.31和0.24 nm分别为β-MnO2的(110)、(101)晶面,表明水热反应4 h样品主要为β-MnO2;从图2(f)和图3(h)可见,当水热反应12 h后,微片状消失,样品仅为柱状β-MnO2。
[MnO6]八面体是构成α-、β-和γ-MnO2晶体的基本结构单元。α-MnO2是由[MnO6]形成的(2×2)双链隧道结构,由于其较大的隧道结构,中间的孔径中通常存在K+、Na+等阳离子,使其具有稳定的隧道结构[20];β-MnO2是(1×1) 单链隧道结构,且其隧道的孔径较小,孔径中通常不存在阳离子,使得β-MnO2的结构比α-MnO2更加稳定[21];γ-MnO2结构比较复杂,是由[MnO6]八面体形成的(1×1)和(2×1)隧道结构不规则交替生长而形成,常存在大量缺陷空位。可见,β-MnO2是热力学稳定相,在一定条件下其它晶型的MnO2倾向于向其转化。通过以上分析,推测水热法MnO2生长机理如下:刚开始时,反应溶液中K+较多,且[MnO6]八面体首先出现在溶液中,八面体通过一系列缩合反应形成杆状α-MnO2,随着反应的进行K+减少,少量γ-MnO2出现。当水热时间延长到一定程度,由于金属阳离子K+不足,晶格结构也趋于稳定态,α-MnO2和γ-MnO2隧道结构直接发生坍塌而形成β-MnO2,晶型转化示意图如图4所示。

图4 MnO2晶型转换示意图Fig. 4 Schematic illustration of MnO2 crystal transformation
3.3 MnO2的催化性能
MnO2的催化性能与其晶型结构紧密相关,已有文献报道,由于α-MnO2及γ-MnO2与单隧道结构的β-MnO2相比具有更大的隧道空间,因此,它们的氧化反应性能比β-MnO2高得多(α-MnO2>γ-MnO2>β-MnO2)[14,22-23]。本研究以水热时间为0.5 h时制备的样品(α-MnO2+γ-MnO2)为催化剂,研究其对RhB的降解性能。图5分别为60 mL RhB和100 mL RhB溶液在不同催化时间下的UV-Vis光谱图。左上角的光学照片反映了RhB溶液在催化过程中颜色变化情况,从图可见,当催化反应5 min时,60 mL 的RhB溶液的紫粉色几乎消失,100 mL RhB溶液在催化20 min时紫粉色也几乎消失,这说明此时溶液中的RhB大部分已被降解。RhB是三苯甲烷家族中的一种常见染料,它在呫吨环的两侧含有四个N-乙基。它的降解过程分为逐步N-脱乙基和共轭显色基团裂解两个过程[15,24]。从图5中发现,随着催化反应时间的增加,RhB溶液在可见光区的最大吸收峰(554 nm)处强度迅速降低,这意味着RhB分子的中心碳遭受了活性物质·OH的直接攻击,使得共轭显色基团裂解;同时,这个最大吸收峰的位置出现从554 nm到534 nm的蓝移现象,说明N-位脱乙基过程形成了一些中间产物[24-25]。由于蓝移现象明显弱于最大吸收峰的下降程度,由此可知,降解过程主要是发生在RhB显色基团的裂解。
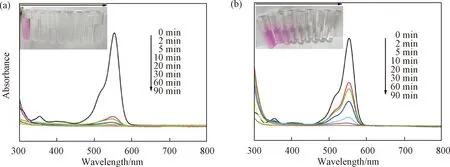
图5 不同体积RhB溶液的紫外-可见吸收光谱图 (a) 60 mL; (b) 100 mLFig. 5 UV-Vis absorption spectra of RhB aqueous solution with different volumes (a) 60 mL; (b) 100 mL
图6为不同条件下RhB的降解率曲线。曲线A和B分别为60 mL和100 mL RhB溶液的降解率变化曲线。由曲线A可知,催化反应5 min时RhB溶液的降解率为88%,待催化时间为10 min时,其降解率高达93%;由曲线B可知,当RhB溶液的用量增加时,催化降解时间随之增加,当催化时间为20 min时,RhB降解率即达88%,当延长催化时间到30 min时,RhB溶液的降解率高达93%。由此可知,此α-MnO2+γ-MnO2样品对于RhB具有较高的催化降解效率。曲线C及D分别为只加入H2O2和只加入α-MnO2+γ-MnO2样品时RhB的降解率随时间变化曲线。由曲线C可知,RhB的最高降解率约为40%左右,说明H2O2对RhB具有一定的降解能力;由曲线D可知,MnO2样品单独存在时RhB几乎不发生降解,由此证明,MnO2和H2O2对催化降解RhB溶液具有协同作用。
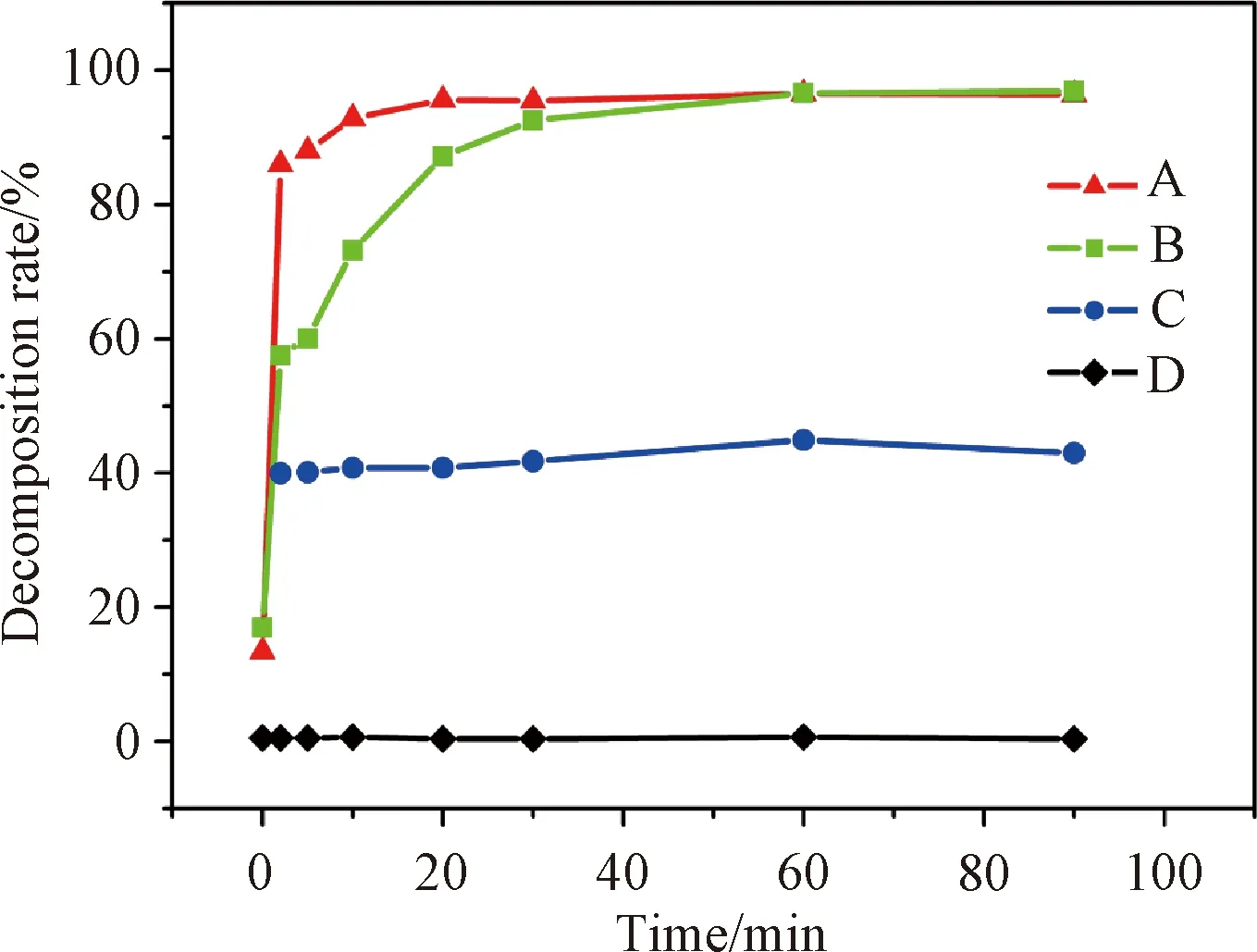
图6 RhB降解率随时间的变化曲线(A:RhB为60 mL;B:RhB为100 mL;C:只有H2O2;D:只有MnO2)Fig. 6 Time profiles of RhB degradation (A: RhB 60 mL; B: RhB 100 mL; C: without MnO2; D: without H2O2)
4 结 论
本研究以KMnO4、MnCl2·4H2O为原料,利用水热法实现了α-、β-及γ-MnO2的可控制备。当延长水热反应时间,由于阳离子的不足,α-MnO2和γ-MnO2晶格结构转变形成了β- MnO2,从而实现了α-MnO2、γ-MnO2到β- MnO2的转化。通过UV-Vis光谱研究发现,α-MnO2+γ-MnO2样品对RhB溶液表现出极好的催化降解能力,在催化10 min之后,60 mL 20 mg/L RhB溶液的降解率即可高达93%。该项研究将为MnO2的可控制备提供一定的理论基础,并为MnO2在水污染治理领域的实际应用提供依据。
