循环胆红素水平与新诊断非增殖期糖尿病视网膜病变及其危险因素相关性的病例对照研究
2022-02-28刘元桦李雪妍何佳林耿修文纪佳君赵立娜
刘元桦,李雪妍,苏 蕾,何佳林,耿修文,纪佳君,唐 松,赵立娜
(1.中山大学公共卫生学院营养系//广东省营养膳食与健康重点实验室,广东广州 510080;2.深圳市眼科医院//深圳市眼科学重点实验室,广东深圳 518000)
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病常见的微血管并发症,也是成人失明的主要原因之一[1]。DR 发病隐匿、进展缓慢,且早期无明显症状,往往导致诊断和干预的延误[2-3]。尽管对公认的风险因素如糖尿病病程、血糖、血脂和血压等进行强化控制可以减缓DR的进展,但全球DR的患病率仍不断上升[2,4]。由于DR 发病的隐匿性和不可逆性,探索早期DR 预测和干预的临床生物标志物具有重要的研究意义和临床价值。胆红素是胆汁中的主要色素,近年来的研究发现胆红素在体内发挥抗氧化作用,被认为是人体内的一种重要的内源性抗氧化剂[5],越来越多的研究报道胆红素水平与心血管疾病及糖尿病血管并发症的发生发展密切相关[6]。有研究报道总胆红素水平(total bilirubin,TBIL)能够预测2型糖尿病患者的截肢事件发生[7]。另外,一项队列研究提示TBIL与糖尿病肾病进展呈负相关[8]。然而,目前有关胆红素水平与DR的关系的研究较为缺乏且结果存在较多的不一致[9-12]。目前的研究中没有较全面地收集和调整可能影响胆红素水平的多种混杂因素,如饮食行为、生活方式和药物等[10,13-14]。此外,目前大多数的研究只关注TBIL,而没有进一步区分结合形式(direct bilirubin,DBIL)和非结合形式(indirect bilirubin,IBIL)胆红素与DR 的关系[10,15-16],而已有相关的研究报道不同形式的胆红素的抗氧化能力等功能特性有显著的差别[9,17]。因此,本研究开展基于社区的2 型糖尿病视网膜病变的人工智能眼底镜的筛查,纳入新诊断的非增殖期糖尿病视网膜病变(nonproliferative diabetic retinopathy,NPDR)的病人,并开展详细的问卷调查和体格检查收集相关的危险因素,全面的检测了不同形式的胆红素的水平,分析其与非增殖期糖尿病视网膜病变及其相关危险因素的关系。
1 材料与方法
1.1 研究设计和研究对象
采用基于社区的病例对照研究设计,在2020年1 月至2020 年12 月共招募2 型糖尿病患者409例[符合以下标准之一:糖尿病史、空腹血糖≥7.0 mmol、随机血糖≥11.1 mmol/L或糖化血红蛋白(glycated hemoglobin,HbA1c)≥6.5%][18]。排除患有癫痫病史、青光眼病史、接受过玻璃体手术、白内障、全身感染、风湿性心脏病、自身免疫性疾病、已确诊DR 且接受药物治疗的研究对象。在本研究中,我们最终按年龄、性别和糖尿病病程1:3匹配纳入78例NPDR 患者和234 例无DR 糖尿病患者。为了排除任何可能影响研究对象胆红素分布比较的伴随条件的影响,研究还纳入了同期筛查的一组年龄和性别匹配的78 名非糖尿病人作为对照。本研究遵循赫尔辛基宣言的原则,经中山大学公共卫生学院医学伦理委员会批准[中大公卫医伦〔2019〕第076号],所有参与者均签署了书面知情同意书。
1.2 糖尿病视网膜病变的评估
所有参与者均接受了标准化的眼底检查,采用人工智能眼底相机(SYSEYE RetiCam 3100,重庆,中国)通过非药物散瞳方式获取研究对象每只眼睛的视网膜照片,并由眼科医生根据国际DR 临床标准将糖尿病患者两只眼睛视网膜病变情况进一步确诊[19]。本研究中409 例糖尿病人共筛查出78 例非增殖期DR,1 例增殖期DR,最终纳入78 例非增殖期DR进入病例组(NPDR组)。
1.3 风险因素的评估
在本研究中,我们进行了详细的面对面问卷调查,收集参与者的相关信息,包括性别、年龄、糖尿病病程、疾病史、目前的吸烟状况和药物的使用等。所有参与者都接受了标准化的体格检查,以记录身高、体质量[通过计算来确定身体质量指数(body mass index,BMI)]和血压等。
1.4 实验室检测
采集每位参与者的空腹静脉血并离心(800×g,15 min,4 ℃),分离血清、血浆、白细胞和红细胞,并将所有分装的样本储存在-80 ℃。采用生化分析仪(BS-800 生化分析仪,迈瑞,中国深圳)检测相关生化指标。采用高效液相色谱法(HA-8180,Arkray,Shiga,Japan)检测糖化血红蛋白(HbA1c)。估计肾小球滤过率(estimated glomerular filtration rate,eGFR)由Lund-Malmö 修正方程计算。尿白蛋白/肌酐比值(urine albumin creatine ratio,UACR)=尿微量白蛋白(mg/L)/尿肌酐(g/L)。
1.5 统计方法
结果中分类变量采用数目(百分比)描述,连续变量采用均数±标准差或中位数M(P25~P75)表示。参与者的基本情况和临床特征采用Mann-WhitneyU检验、χ2检验或t检验进行比较(视情况而定)。血清胆红素水平与HbA1c 水平的关系采用Spearman 秩相关分析。血清胆红素与非增殖期糖尿病视网膜病变之间的关联采用Logistic 回归分析进行评估。在多因素logistic回归分析中,纳入了混杂因素和已知风险因素进行了校正。胆红素对NPDR的预测能力采用ROC 曲线分析。所有统计分析均使用SPSS 25.0 版软件(IBM Corporation,Chicago,IL)进行。检验水准α=0.05(双侧检验)。本研究剔除缺失问卷数据或样本的研究对象。
1.6 样本量计算
样本量计算是基于已有研究的基础上进行计算[11,20],本研究中的样本量在总胆红素分析中达到96.62%的功效,在结合胆红素分析中达到98.93%功效,在非结合胆红素分析中达到92.01%功效。
2 结果
2.1 研究对象基本情况
与无DR 糖尿病患者相比,NPDR 患者的糖尿病病程更长[7.0(3.0~12.0)vs.6.0(3.0~9.0)年,P=0.016]、收缩压[130.0(123.0~145.0)vs.127.0(116.0~137.0)mmHg,P=0.006]、HbA1c%水 平[8.4(7.1~9.5)vs.6.8(6.1~8.2),P<0.001]、空腹血糖水平[8.2(6.6~11.6)vs.6.9(5.5~8.5)mmol/L,P<0.001]和UACR 水平[53.3(13.9~182.8)vs.16.6(8.8~45.9)mg/g,P<0.001]更高;与无DR 糖尿病患者相比,NPDR 患者的TBIL[10.1(8.2~13.3)vs.12.2(8.9~15.6)μmol/L,P=0.003]、DBIL[3.4(2.5~4.4)vs.3.9(3.0~5.3)μmol/L,P=0.001]和IBIL[7.2(5.9~8.4)vs.8.4(5.9~10.5)μmol/L,P=0.006]水平较低。NPDR 患者与无DR 糖尿病患者的年龄、性别、近期吸烟者、BMI、舒张压、降糖治疗情况、降脂药物使用、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、eGFR 和C-反应蛋白(C-reactive protein,CRP)无差异,见表1。
表1 研究对象基本情况Table 1 Baseline characteristics of the research patients [(± s)or M(P25~P75)or n(%)]
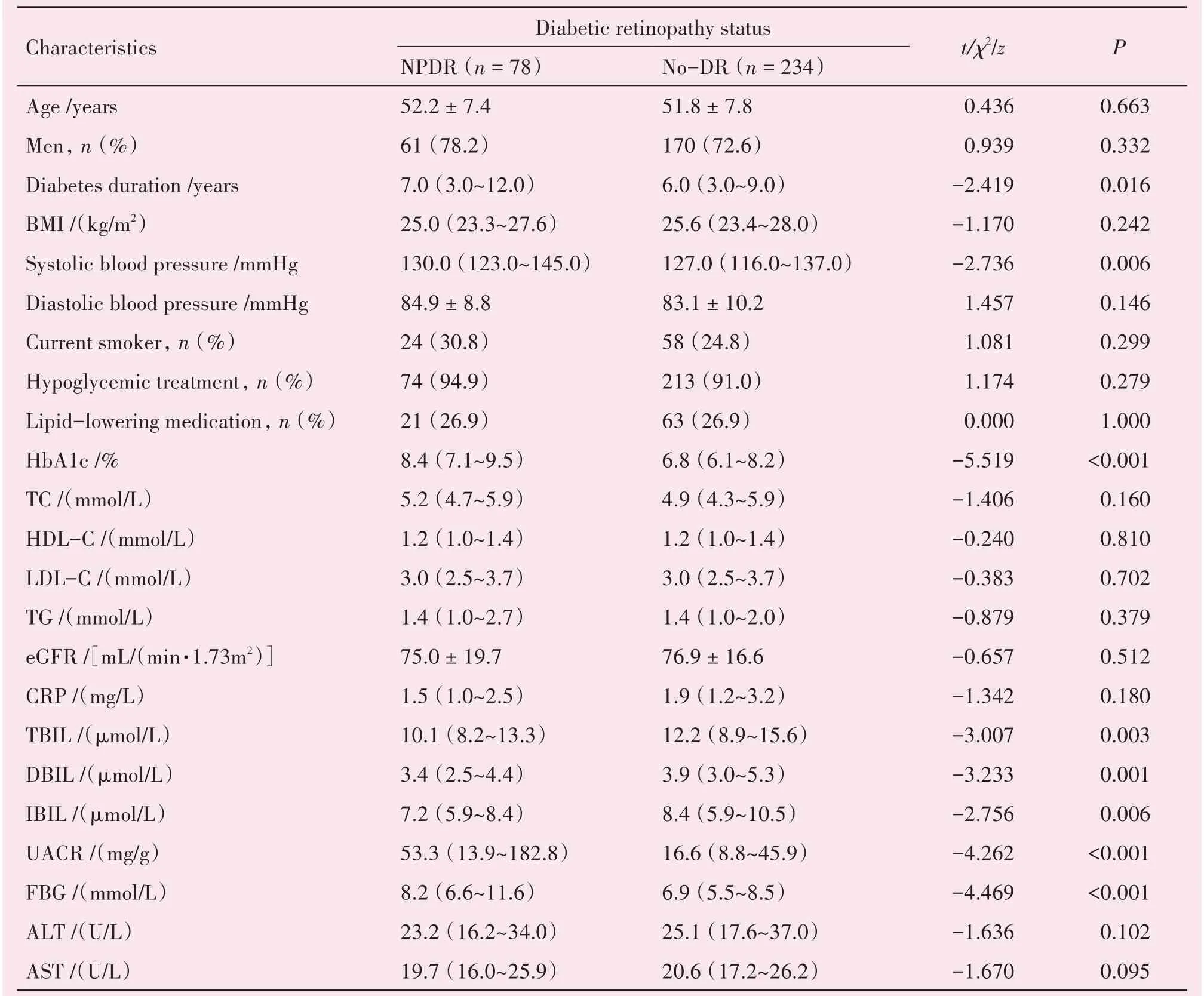
表1 研究对象基本情况Table 1 Baseline characteristics of the research patients [(± s)or M(P25~P75)or n(%)]
P values were compared by Mann-Whitney U test,Student t test or χ2 test as appropriate.BMI:Body mass index;HbA1c:Glycated hemoglobin;TC:Total cholesterol;HDL-C:High-density lipoprotein cholesterol;LDL-C:Low-density lipoprotein cholesterol;TG:Triglyceride;eGFR:Estimated glomerular filtration rate;CRP:C-reactive protein;TBIL:Total bilirubin;DBIL:Direct bilirubin;IBIL:Indirect Bilirubin;UACR:Urine albumin creatine ratio;FBG:Fasting blood glucose;ALT:Alanine aminotransferase;AST:Aspartate aminotransferase.
2.2 各组血清总胆红素、结合胆红素和未结合胆红素水平
NPDR 患者TBIL 水平[10.1(8.2~13.3)μmol/L]低于无DR 糖尿病患者[12.2(8.9~15.6)μmol/L,P=0.003]和非糖尿病人群[13.7(10.5~17.2)μmol/L,P<0.001](图1 A)。NPDR 组DBIL 水平[3.4(2.5~4.4)μmol/L]低于无DR 糖尿病患者[3.9(3.0~5.3)μmol/L,P=0.001]和非糖尿病人群[4.0(3.2~5.6)μmol/L,P=0.001](图1 B)。NPDR 组IBIL 水平[7.2(5.9~8.4)μmol/L]低于无DR 糖尿病患者[8.4(5.9~10.5)μmol/L,P=0.006]和非糖尿病患者[9.8(7.1~12.3)μmol/L,P<0.001](图1 C)。
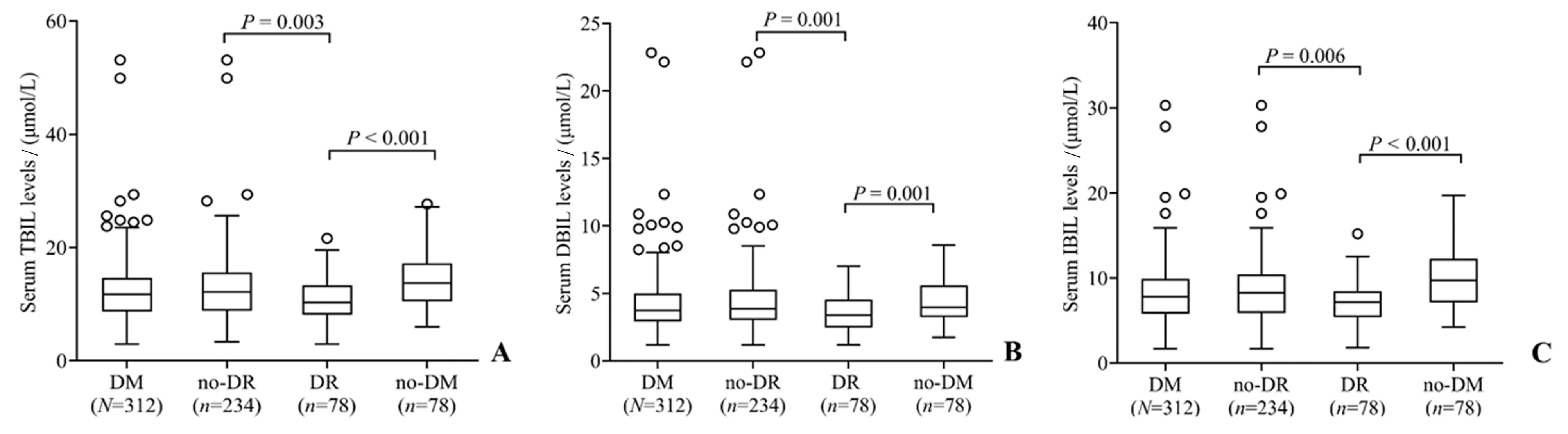
图1 各组血清TBIL、DBIL和IBIL水平情况Fig.1 Serum TBIL,DBIL and IBIL levels in each group
HbA1c 水平与胆红素水平的Spearman 秩相关分析结果显示TBIL 水平(rs=0.001,P=0.980)、DBIL 水平(rs=-0.007,P=0.907)、IBIL 水平(rs=-0.001,P=0.989)均为与HbA1c 水平无关(图2 A-C)。
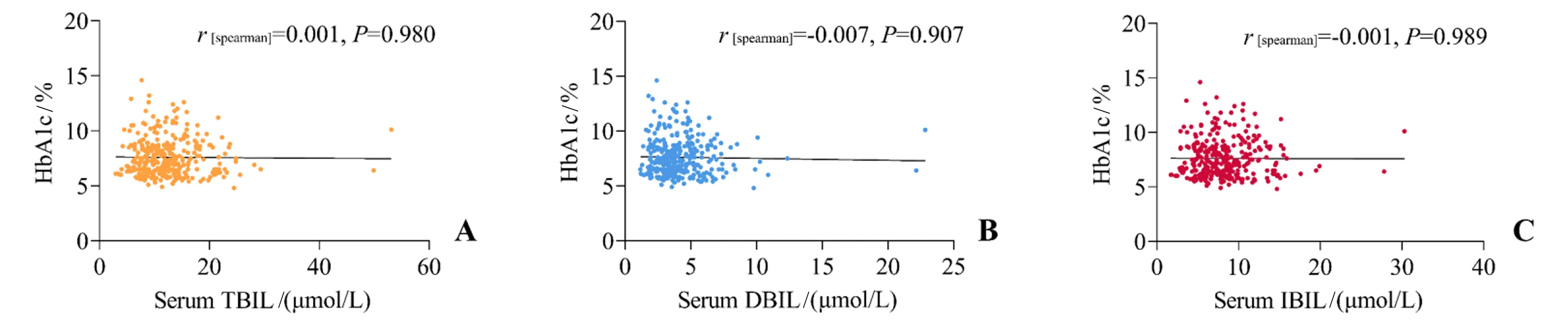
图2 血清TBIL、DBIL和TBIL水平与HbA1c的关系Fig.2 Correlation between the serum TBIL,DBIL and IBIL levels and HbA1c
2.3 血清胆红素和糖尿病视网膜病变的风险关系
TBIL 四分位数中NPDR 患病率分布从26.9%(第一四分位数)至12.8%(第四四分位数),Ptrend=0.018;在DBIL 四分位数中NPDR 患病率分布从38.0%(第一四分位数)到15.6%(第四四分位数),Ptrend=0.013;在IBIL 四分位数中NPDR 患病率分布从25.6%(第一四分位数)到15.6%(第四四分位数),Ptrend=0.010,见图3。

图3 各胆红素四分位数水平NPDR的患病率Fig.3 The prevalence of NPDR at each bilirubin quartile level
以性别、糖尿病病程、HbA1c 和收缩压为校正因子,纳入多因素logistic 回归分析,以血清胆红素最高四分位数作为参照组。在单变量分析中,TBIL第一四分位数(26.9%)、第二四分位数(33.3%)和第三四分位数(26.9%)的NPDR 患病率均高于最高四分位数(12.8%),比值比(odds ratio,OR)95%CI分别为2.51(1.09,5.75),P=0.030;3.40(1.51,7.67),P=0.003;和2.51(1.09,5.75),P=0.030。DBIL第一四分位数(38.0%)NPDR患病率高于最高四分位数(15.6%),OR95%CI 为3.32(1.54,7.13),P=0.002。IBIL 第二四分位数(38.0%)的NPDR 患病率高于最高四分位数(15.6%),OR95%CI 为3.32(1.54,7.13),P=0.002。校正相关因素后,多因素分析显示TBIL 第一四分位数、第二四分位数和第三四分位数发生NPDR 的风险均高于最高四分位数,OR 95%CI 分别为2.89(1.20,6.99),P=0.018;3.60(1.52,8.55),P=0.004;2.88(1.20,6.92),P=0.018;DBIL 第一四分位数发生NPDR 的风险高于最高四分位数,OR 95%CI 为3.36(1.49,7.55),P=0,003;IBIL 第二四分位数发生NPDR 的风险高于最高四分位数,OR 95%CI 为3.56(1.57,8.09),P=0.002,见表2。
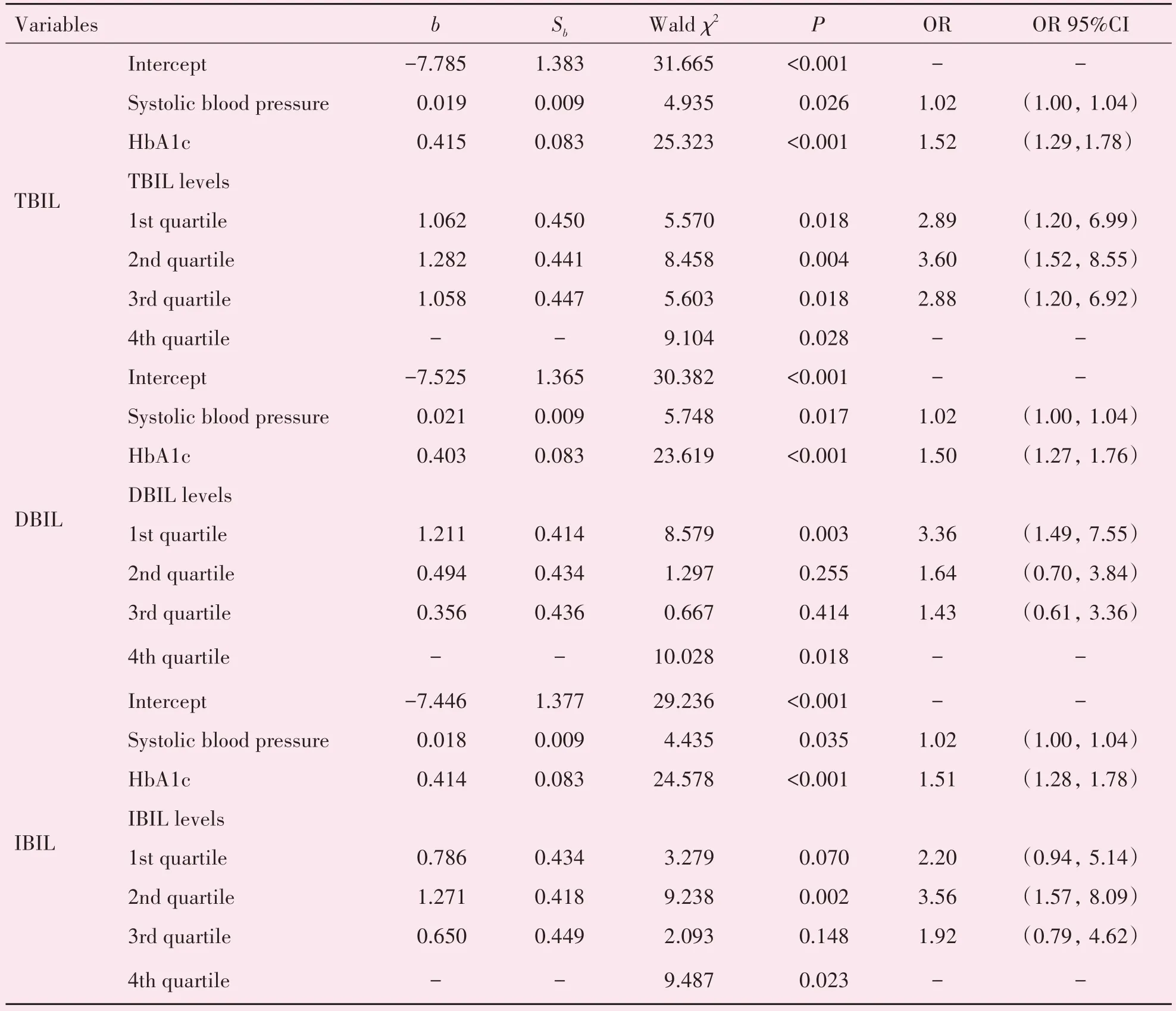
表2 胆红素与NPDR关系的多因素logistic回归分析Table 2 Multivariate logistic regression analysis for the association of bilirubin and NPDR
2.4 不同尿白蛋白/肌酐比值和糖化血红蛋白水平中胆红素与糖尿病视网膜病变风险
胆红素水平第一四分位数(Q1)和第二四分位数(Q2)为低胆红素水平,第三四分位数(Q3)和第四四分位数(Q4)为高胆红素水平。当HbA1c%≤7时,低IBIL 水平(Q1-Q2)NPDR 风险高于高IBIL 水平(Q3-Q4),OR95%CI 为3.44(1.04,11.38),P=0.043。当HbA1c% >7 时,低DBIL 水平(Q1-Q2)NPDR 风险高于高DBIL 水平(Q3-Q4),OR95%CI为2.05(1.09,3.86),P=0.026。当UACR ≤30 mg/g 时,低IBIL 水平(Q1-Q2)的NPDR 风险高于高IBIL 水 平(Q3-Q4),OR95%CI 为2.53(1.10,5.82),P=0.029。当UACR >30 mg/g 时,低DBIL水平(Q1-Q2)的NPDR 风险高于高DBIL 水平(Q3-Q4),OR95%CI=2.40(1.14,5.02),P=0.021。在其他亚组中,低胆红素水平和高胆红素水平之间NPDR风险无差异,见表3。
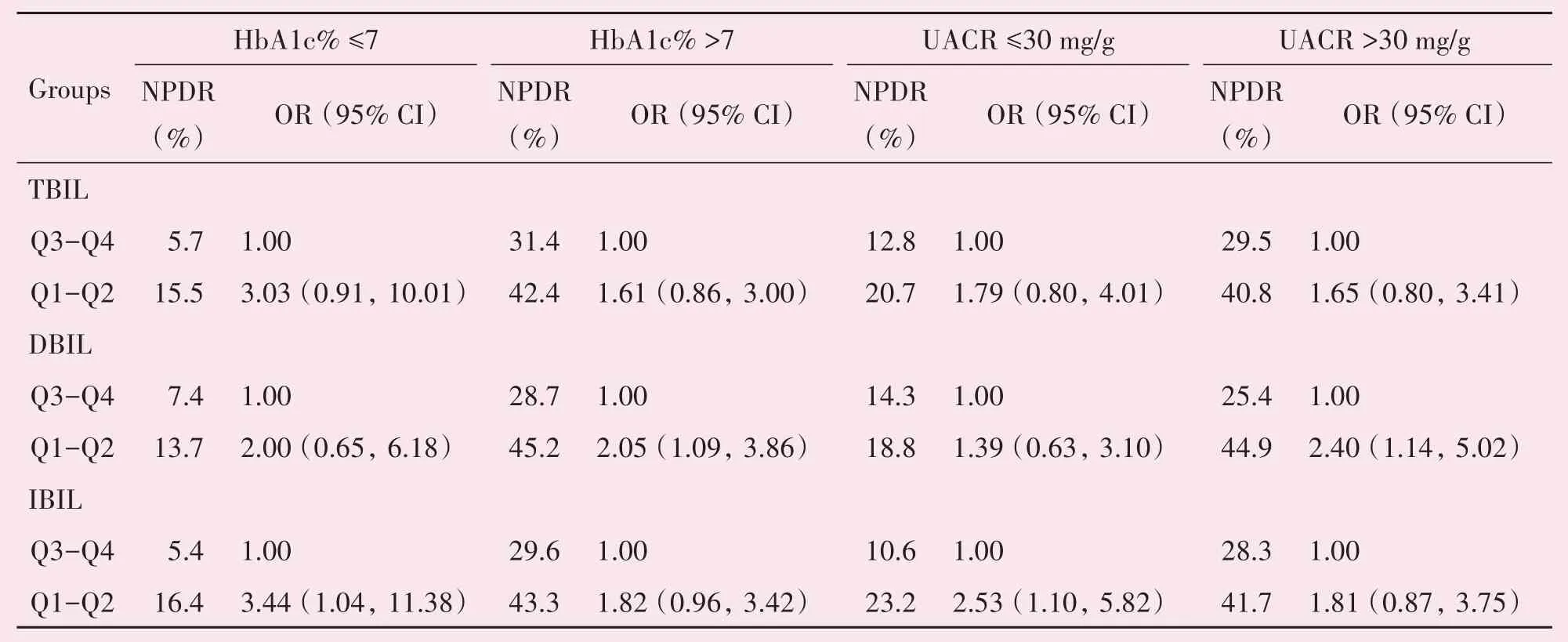
表3 不同HbA1c和UACR水平亚组中NPDR的风险Table 3 The risk of NPDR in subgroup according to HbA1c levels and UACR levels
我们进一步采用ROC 曲线分析DBIL、IBIL、HbA1c 和UACR 水平对NPDR 的预测能力。结果显示:DBIL、IBIL、HbA1c 和UACR 对NPDR 的发生具有预测能力,AUC 分别为0.63(0.56,0.70),P=0.001;0.61(0.54,0.68),P=0.005;0.66(0.59,0.74),P<0.001;0.71(0.64,0.77),P<0.001。DBIL、HbA1c 和UACR 结合的AUC 为0.77(0.71,0.83),P<0.001。IBIL、HbA1c 和UACR 结合的AUC为0.77(0.71,0.83),P<0.001,见图4。

图4 DBIL、IBIL、HbA1c和UACR预测NPDR的ROC曲线分析Fig.4 ROC curve of DBIL,IBIL,HbA1c and UACR to predict NPDR
3 讨论
在这项病例对照研究中,我们发现血清胆红素(TBIL、DBIL 和IBIL)与NPDR 风险呈负相关关系,为NPDR 的独立风险因素。此外,根据血糖水平和肾功能水平进行亚组分析,我们发现在血糖控制良好(HbA1c%≤7)或无微量白蛋白尿(UACR ≤30 mg/g)的糖尿病患者中,低IBIL 水平具有较高的NPDR风险;在血糖控制不良(HbA1c%>7)或有微量白蛋白尿(UACR >30 mg/g)的糖尿病患者中,低DBIL 水平具有较高的NPDR 风险。将DBIL 或IBIL 与HbA1c 和UACR 结合可进一步提高对NPDR 的预测能力。
与目前的研究结果一致,本研究中我们也观察到与未合并视网膜病变的2 型糖尿病患者相比,NPDR 患者的糖尿病病程更长,收缩压更高,血糖控制更差[2-3]。目前,血脂水平与DR 的关系仍存在争议,在荷兰开展的Hoorn研究提示TC和TG与DR发生发展呈正相关,但Sacks 等人发现DR 与这些脂质的相关性不太强[21-22]。本研究中糖尿病患者服用的降脂药物和血脂情况相似,这表明研究参与者的血脂控制相对较好,血脂水平与本研究对象中的NPDR的相关性不强。
胆红素是体内红细胞被破坏后代谢的产物,长期以来一直被认为是身体的代谢废物。近年来,胆红素的抗氧化特性在糖尿病血管病变中得到了越来越多的关注[23-25]。与之前两项不同人群的横断面研究的发现一致,本研究中也发现NPDR 患者的总胆红素水平低于无DR 糖尿病患者[20,26]。我们进一步发现,与无DR 糖尿病患者相比,NPDR 患者中所有形式的胆红素都较低,这可能进一步表明胆红素可能在糖尿病相关血管并发症发展中发挥作用。
目前有关胆红素水平与HbA1c 的关联的研究报道较少。Oda 发现胆红素水平与HbA1c 呈负相关,并且独立于空腹血糖水平[27]。然而,在我们的研究中没有观察到糖尿病患者的循环胆红素水平和HbA1c水平之间存在关联,提示胆红素水平可能是独立于糖化血红蛋白水平的危险因素。另外,我们进一步开展多因素的分析,在调整相关因素后[2],所有形式的胆红素水平均与NPDR风险呈负相关,其中TBIL 结果与先前发表的不同横断面研究结果一致[10,20,26]。而在本研究中,我们进一步发现了低DBIL 和IBIL 水平均增加了NPDR 风险,更深入地探索了循环胆红素与DR 的关系。目前,关于胆红素和糖尿病视网膜病变的队列研究比较缺乏,现有一项队列研究仅纳入了男性糖尿病患者,研究发现循环胆红素水平与DR风险之间可能存在U形关联[12]。因此循环胆红素水平的性别差异以及胆红素水平与DR的关系仍待进一步的前瞻性队列研究确认。
HbA1c 水平是糖尿病视网膜病变发生发展的独立危险因素,大多数2 型糖尿病患者的HbA1c 理想水平应<7%,可以防止糖尿病微血管并发症的发生[28]。然而,许多血糖控制良好的糖尿病患者仍发生了DR。本研究中我们进一步根据血糖水平开展了亚组分析,在血糖控制良好的(HbA1c%≤7)糖尿病患者中,IBIL 水平低的情况下发生NPDR 的风险较高,提示即使血糖控制良好,低IBIL 也可能增加NPDR 的风险,若血糖控制不良(HbA1c% >7),低DBIL 水平可能增加NPDR 的发生风险。此外,糖尿病肾脏并发症也是糖尿病微血管并发症之一,通常与DR相伴随发生发展[29]。根据肾脏功能开展进一步的亚组分析,研究结果表明,在没有肾损害的糖尿病患者中(UACR ≤30mg/g),低水平的IBIL 也会增加NPDR 的风险。此外,低水平的DBIL 会增加伴有肾损害的糖尿病患者(UACR >30 mg/g)发生NPDR 的风险。这些结果进一步表明,在不同状态下糖尿病患者中,不同形式的胆红素对NPDR 风险有不同的影响。这可能是由于不同形式的胆红素的抗氧化能力不同,如未结合形式的胆红素可通过激活糖尿病小鼠模型主动脉中的Akt/Enos 通路直接改善内皮功能障碍[9],不同形式胆红素对NPDR发生的机制值得进一步研究。
综上,目前的研究存在以下优点和局限性。优点是在这项基于社区开展的病例对照研究中筛选和纳入了新诊断的NPDR 病例,与增殖期DR 相比,NPDR 处于糖尿病视网膜病变的早期阶段,更有利于筛查DR 发生发展中的早期生物标志物。同时,病例组和对照组之间的年龄、性别和糖尿病病程等混杂因素通过匹配均衡,增加了病例组和对照组的可比性。同时,本研究还分别探讨和分析了不同形式的循环胆红素的分布及其与NPDR 的关系,并根据不同的血糖控制状态和肾功能对糖尿病患者进行进一步亚组分析糖尿病患者NPDR 的风险。本研究的局限性在于为单一中心病例对照研究,结果的外推及不同形式胆红素在NPDR 中的因果作用有待进一步证实,胆红素与NPDR 进展的潜在机制值得进一步研究。本研究发现循环胆红素浓度与NPDR 风险呈负相关关系,为NPDR 发生发展的独立因素。循环胆红素可能是预测、评估和治疗DR的有价值的早期临床生物标志物。
