腹腔镜卵巢内膜异位囊肿剥除术后卵巢低反应体外受精-胚胎移植的结局*
2022-02-26单学敏席思思杨秀丽
单学敏 席思思 尚 鶄 杨秀丽 薛 晴
(北京大学第一医院妇产科,北京 100034)
子宫内膜异位症最常见的病理类型为卵巢子宫内膜异位囊肿(ovarian endometrial cyst,OEC),腹腔镜囊肿剥除术是治疗OEC的一线方案。Goodman等[1]提出OEC手术后较术前显著降低患者抗苗勒管激素(anti-Mullerian hormone,AMH)水平,导致卵巢低反应(poor ovary response,POR)的发生。POR临床表现为超促排卵周期卵泡发育少、周期取消率高、获卵少和临床妊娠率低等,发生率为9%~24%[2]。造成POR的常见原因包括子宫内膜异位症、卵巢囊肿手术史、染色体的数量和结构异常、基因突变、盆腔炎及放化疗史等[3]。关于OEC术后合并POR患者的IVF-ET结局鲜有报道,本文回顾性比较我院2013年1月~2018年12月72例OEC术后POR与31例OEC未手术POR的体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)的结局,分析OEC术后患者妊娠结局的特点,探讨腹腔镜囊肿剥除术后POR对IVF-ET结局的影响。
1 临床资料与方法
1.1 一般资料
本研究103例,年龄27~40岁,平均34.4岁。BMI 24.27±3.41。继发不孕率41.7%(43/103),不孕时间中位数3(2,5)年。POR符合博洛尼亚诊断标准[4],其中72例为OEC术后POR(OEC术后组),31例为OEC未手术POR(OEC组)。OEC直径3~6 cm。本研究病例起始时间为2013年,彼时我院尚未开展AMH检测。2组一般资料比较无统计学差异(P>0.05),有可比性,见表1。

病例选择标准:①参照博洛尼亚标准诊断POR,前次 IVF周期常规方案获卵数≤3个或卵巢储备下降,窦卵泡数(antral follicle count,AFC)≤5个;②IVF治疗过程中年龄≤40岁;③腹腔镜单侧或双侧OEC剥除术,囊肿直径4~8 cm,术后病理证实为子宫内膜异位囊肿且未复发;④未手术治疗者符合OEC经阴道超声诊断标准[5](①盆腔内大小不等的圆形或椭圆形无回声区;②囊内伴细小密集回声或呈“云雾状”、“毛玻璃样”改变;③囊壁毛糙、增厚;④探头推挤囊肿与子宫,显示二者粘连不易分开;⑤囊肿大小随月经周期而变化)。排除标准:①输卵管积水;②先天性子宫畸形;③染色体核形分析异常;④子宫病变(包括黏膜下肌瘤、肌层或浆膜下肌瘤>5 cm、子宫腺肌病、子宫内膜癌);⑤卵巢因其他疾病(非OEC)施行手术;⑥反复移植失败(至少3次新鲜或冷冻胚胎移植周期,累积移植至少4枚优质胚胎后均未获得临床妊娠);⑦复发性流产(至少发生3次妊娠28周之前的胎儿丢失);⑧男方无精症。
1.2 方法
腹腔镜囊肿剥除术具体操作[6]:①充分暴露手术视野。如有盆腔粘连,首先分离盆腔粘连,恢复解剖。②腹腔镜术中先分离内膜异位囊肿与周围的粘连,吸净囊内巧克力样液体,并将囊内壁冲洗干净后剥除囊壁。创面以低功率的电凝或缝合止血。③手术完成后反复冲洗盆腹腔。
1.3 观察指标
主要观察指标:每新鲜移植周期临床妊娠率。次要观察指标:①获卵数、成熟卵母细胞数;②周期取消(因超促排卵效果不满意而取消取卵周期)率;③促性腺激素(gonadotropins,Gn)用量和使用时间;④优质胚胎数。
1.4 统计学处理

2 结果
OEC术后组Gn用量明显高于OEC组,获卵数、成熟卵母细胞(MⅡ卵母细胞)数及优质胚胎数均显著低于OEC组(P<0.05),见表2、3。OEC术后组早期流产率33.3%(2/6),OEC组20.0%(1/5),2组临床妊娠率、活产率差异无显著性(P>0.05),见表4。


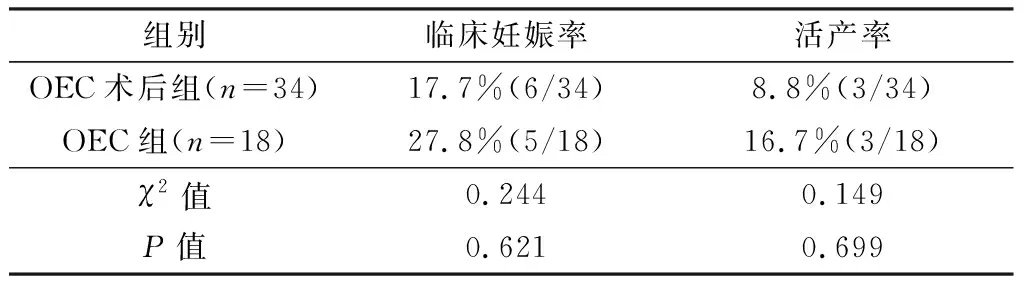
表4 2组IVF-ET妊娠结局比较
3 讨论
POR患者IVF-ET结局的主要影响因素为年龄、卵巢储备功能等[7,8]。子宫内膜异位组织可通过分泌多种细胞因子、趋化因子和生长因子,激活卵泡细胞中的特定信号通路,导致卵泡过早发育和加速卵泡闭锁[9,10],从而降低卵巢储备功能。Uncu等[11]比较育龄期女性OEC者与无OEC者AMH和基础窦卵泡数,结果显示OEC患者AMH水平及窦卵泡数均显著低于无OEC者。
腹腔镜囊肿剥除术目前是治疗OEC合并不孕患者的一线治疗方案[12],因可去除病灶、缓解盆腔痛并增加自然受孕率。Roustan等[13]提出OEC术后卵巢对促性腺激素的反应明显降低。ükür等[14]报道OEC术后组较OEC未手术组获卵数和MⅡ卵母细胞数[(7.5±5.5)个vs.(6.6±5.1)个;(5.5±4.9)个 vs. (5.2±4.3)个],差异无显著性(P>0.05),但周期取消率(13.7% vs. 0%)显著增高。Xing等[15]比较OEC术后组与卵巢未手术组超促排卵结局,OEC术后获卵数和MⅡ卵母细胞数显著低于卵巢未手术组[(7.98±5.05)个 vs.(9.90±6.06)个,(6.71±4.27)个vs.(8.61±5.61)个]。本研究结果显示OEC术后组较OEC组Gn用量显著升高,获卵数显著降低(P>0.05),提示OEC术后需要更多Gn用量,但未提高获卵数。手术损伤卵巢功能的机制可能为在剥除卵巢囊肿过程中意外去除一定体积的正常卵巢组织;电凝止血导致供应卵巢的血管损伤;电凝导致的局部炎症反应引起卵巢发生自身免疫反应从而破坏卵巢组织,降低卵巢储备功能[16~18]。可见,OEC术后可能降低卵巢对Gn的反应性,降低卵巢储备功能。
Roustan等[13]报道POR患者OEC术后组临床妊娠率、活产率分别为11.2%(14/125)、8.7%(9/104),显著低于未手术组20.6%(50/243)和18.8%(41/216),认为可能的原因为OEC术后降低胚胎质量及子宫内膜容受性。Hong等[19]报道OEC术后组与未手术组临床妊娠率及活产率差异无显著性(P>0.05),认为OEC术后组妊娠结局差主要因素为POR,并非OEC术后导致的胚胎质量差。本研究结果显示与OEC组比较,OEC术后组MⅡ卵母细胞数、优质胚胎数显著降低,提示手术亦可能影响卵母细胞成熟,进而影响卵母细胞质量及胚胎质量。OEC术后组临床妊娠率、活产率虽与OEC组差异无统计学意义(P>0.05),但可看出OEC术后组临床妊娠率及活产率低于OEC组,早期流产率高于OEC组的趋势,结合OEC术后组获卵数、MⅡ卵母细胞数及优质胚胎数均显著降低(P<0.05),提示OEC术后可能影响患者的卵巢储备,降低卵母细胞质量及胚胎质量,导致IVF-ET妊娠结局不良。
本研究OEC组患者OEC大小为3~6 cm,2008年欧洲人类生殖与胚胎学学会(European Society of Human Reproduction and Embryology,ESHRE)关于OEC治疗建议OEC直径≥4 cm即可进行腹腔镜下囊肿剥除术,手术既可去除病灶明确病理类型,又可增加正常卵泡的暴露,或可增加卵巢的反应性。2017年ESHRE提出对于OEC有生育要求患者需完善卵巢储备功能的评估,并充分考量手术治疗对卵巢造成的损伤[12]。Nickkho-Amiry等[20]提出OEC合并不孕患者IVF-ET治疗前手术指征应调整为:①卵巢肿瘤增长迅速、影像学检查提示肿瘤恶性可能;②因囊肿引起的严重盆腔疼痛;③囊肿位置影响穿刺取卵,在以上几种情况出现时再考虑手术治疗,而不单纯以囊肿大小作为手术指征。
综上所述,OEC术后一旦出现POR,将导致IVF-ET助孕结局不良。对于OEC直径3~6 cm合并POR者,在除外囊肿恶变风险且无明显盆腔痛者,可考虑先行IVF助孕治疗,待获得活产后再酌情手术治疗。
