香水莲花花蕊醇提物对黄嘌呤氧化酶的抑制作用及其主要成分
2022-02-25侯北伟尹峥桢姜洪芳姚正颖孙力军张俊杰
张 静, 侯北伟, 尹峥桢, 姜洪芳, 姚正颖, 孙力军, 张俊杰,①
(1. 江苏海洋大学食品科学与工程学院, 江苏 连云港 222005; 2. 南京野生植物综合利用研究所, 江苏 南京 211100)
痛风是一种由尿酸盐沉积引起的、与晶体相关的关节病。大量研究结果[1-3]表明:药用植物的醇提物、水提物以及乙酸乙酯提取物等对黄嘌呤氧化酶(XOD)具有较高的抑制率,其中黄酮类、酚酸类和生物碱类等活性成分均对XOD有抑制作用,具有较强的降尿酸功能。
香水莲花(Nymphaeasp.)为水生宿根草本植物,具有降血脂、抗氧化和抗衰老等功能[4-6]。香水莲花富含黄酮、多糖和多酚类等活性成分,其花蕊水提物对XOD有抑制作用[7],但其醇提物对XOD的抑制作用尚不明确。为此,作者以香水莲花花蕊为研究材料,研究其醇提物对XOD的抑制作用,并采用液质联用法确定其醇提物的主要成分,为可调节尿酸水平的功能性食品开发提供基础研究数据。
1 材料和方法
1.1 材料
紫色香水莲花的干燥花朵于2019年购于安徽芜湖,由南京野生植物综合利用研究所张卫明研究员鉴定。取雄蕊和雌蕊,用粉碎机粉碎后过80目筛,密封保存、备用。
甲酸(色谱级)、甲醇(色谱级)、乙腈(色谱级)、黄嘌呤(X7375-10G)和黄嘌呤氧化酶(X1875-5UN)购于美国Sigma公司;阳性对照品别嘌醇片购于合肥久联制药有限公司;没食子酸、鞣花酸和槲皮苷标准品(纯度≥98%)均购于瑞士Adamas公司;其他试剂均为分析纯,购于生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 醇提物制备 称取15 g样品粉末,按料液比1∶10(m∶V)加入体积分数70%的乙醇,浸提24 h后于60 ℃、40 kHz条件下超声提取45 min,常温下4 000 r·min-1离心15 min,滤渣重复提取1次;合并上清液,于50 ℃旋转蒸发至膏状,冷冻干燥后研磨,备用。
1.2.2 XOD抑制活性测定 XOD抑制活性的测定参照文献[7,8]的方法并加以改进。醇提物、别嘌醇片和3个标准品(没食子酸、鞣花酸和槲皮苷)均用二甲亚砜(DMSO)溶解,配制成不同质量浓度的样品,其中醇提物的质量浓度分别为0.50、0.75、1.00、1.25、1.50、1.75、2.00、2.25和2.50 mg·mL-1;别嘌醇质量浓度分别为1.0、2.0和3.0 μg·mL-1;3个标准品的质量浓度分别为0.5、1.0和2.0 mg·mL-1,均设置3个平行组。酶促反应体系包括待测样品200 μL(空白组为DMSO 200 μL)、1.5 mmol·L-1黄嘌呤溶液100 μL、5 U·mL-1XOD溶液3 μL,用磷酸盐缓冲液(pH 7.5)补充至10 mL;混匀后在室温条件下于波长295 nm处测定吸光度,参照文献[7]的方法计算不同质量浓度醇提物以及阳性对照和标准品对XOD的抑制率;并以供试样品的质量浓度为自变量x、抑制率为因变量y拟合回归方程,根据回归方程计算供试样品的半数抑制浓度(IC50)。
在上述酶促反应体系中固定XOD浓度不变,分别加入0.375、0.750、1.500和3.000 mmol·L-1黄嘌呤溶液以及0.00、1.75、2.00和2.25 mg·mL-1醇提物,按照上述方法测定吸光度,以反应时间为横坐标、吸光值为纵坐标作图,并根据直线斜率计算反应速率;采用双倒数作图法,以黄嘌呤溶液质量浓度的倒数为横坐标、反应速率的倒数为纵坐标作图,评价醇提物对XOD的抑制作用类型,并据此计算抑制动力学常数(Ki)。
1.2.3 醇提物主要成分分析 冷冻干燥后的醇提物和标准品没食子酸、鞣花酸和槲皮苷用乙腈溶解并配制成1 mg·mL-1待测样品,用0.4 μm有机系微孔滤膜过滤后备用。
采用Agilent 1200高效液相色谱仪(美国Agilent公司)进行HPLC分析。色谱柱为Eclipse XDB-C18分离柱(4.6 mm×250 mm,5 μm,美国Agilent公司)。以体积分数0.1%甲酸-水溶液(流动相A)和乙腈(流动相B)进行梯度洗脱,洗脱程序为:0~10 min,5%~13%B;10~15 min,13%~18%B;15~30 min,18%~23%B;30~40 min,23%~28%B;40~45 min,28%~33%B;45~50 min,33%~40%B;50~55 min,40%~100%B。流速0.8 mL·min-1;柱温35 ℃;进样量20 μL;醇提物检测波长为260和360 nm,标准品检测波长为360 nm。
采用Agilent 1290 Infinity LC/6460 QQQ MS液相色谱-质谱联用仪(美国Agilent公司)进行质谱分析。质谱条件: ESI离子源,喷雾电压4 kV,雾化气体N2,雾化压力344.75 kPa,雾化气流速10 L·min-1;碰撞气体为He,碰撞电压250 V,干燥温度350 ℃;扫描方式为负离子,离子范围m/z100~2 000;采用Qualitative DA Software B.08.00工作站对数据进行分析。
1.3 统计学分析
采用SPSS 22.0软件进行单因素方差分析,应用回归分析法计算IC50及Ki值;采用Origin 6.0软件作图。
2 结果和分析
2.1 香水莲花花蕊醇提物对XOD的抑制活性
不同质量浓度香水莲花花蕊醇提物对XOD的抑制率见图1;对XOD的抑制动力学分析结果见图2。
由图1可见:香水莲花花蕊醇提物对XOD的抑制率随其质量浓度升高而增大,总体上差异显著(P<0.05)。质量浓度为0.50~1.25 mg·mL-1时,抑制率随着质量浓度的升高快速增大;质量浓度为1.25~1.50 mg·mL-1时,抑制率增幅减小;质量浓度为1.50~2.50 mg·mL-1时,抑制率增幅再次增大。此外,香水莲花花蕊醇提物对XOD抑制作用的半数抑制浓度(IC50)为38.54 μg·mL-1(拟合方程y=3.91x+1.11,r2=0.994),明显大于阳性对照别嘌醇片的IC50值(0.015 μg·mL-1)。

不同小写字母表示差异显著(P<0.05)Different lowercases indicate the significant (P<0.05) difference.
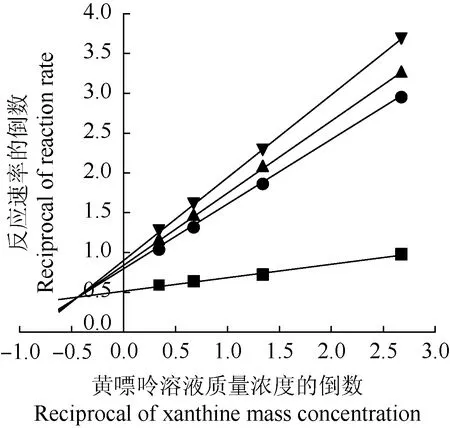
: 0.00 mg·mL-1; : 1.75 mg·mL-1; : 2.00 mg·mL-1; : 2.25 mg·mL-1.
由图2可见:随香水莲花花蕊醇提物质量浓度的提高,直线斜率和在纵轴上的截距均相应增加,且图中4条直线均相交于第2象限,说明香水莲花醇提物对XOD抑制类型为混合型抑制,且该抑制反应的动力学常数(Ki)为0.95 mg·mL-1。
2.2 香水莲花花蕊醇提物的主要组成成分
液相色谱和质谱分析结果表明:香水莲花花蕊醇提物的主要成分为没食子酸、鞣花酸和槲皮苷,且没食子酸的吸收峰为主要峰。对这3种化合物进行XOD抑制活性检测,结果显示:没食子酸和槲皮苷对XOD均无明显的抑制作用,而鞣花酸对XOD有较强的抑制作用,IC50值为7.56 μg·mL-1(拟合方程y=4.31x+6.81,r2=0.987)。
3 讨论和结论
前期研究表明:香水莲花花蕊水提物对XOD有抑制作用,抑制类型为竞争性抑制,半数抑制浓度(IC50)为145.80 μg·mL-1[7]。本研究结果表明:香水莲花花蕊醇提物对XOD也有抑制作用,但抑制类型为混合型抑制,IC50值仅为38.54 μg·mL-1,说明同种植物的不同溶剂提取物对XOD的抑制类型存在差异。
研究结果表明:香水莲花花蕊醇提物的主要成分为没食子酸、鞣花酸和槲皮苷,其中鞣花酸对XOD的IC50值为7.56 μg·mL-1,没食子酸和槲皮苷对XOD无抑制作用。桉(EucalyptusrobustaSmith)叶提取物中鞣花酸对XOD的IC50值为22.51 μg·mL-1[9],与本研究结果存在差异,这可能与反应体系及仪器设备造成的客观误差有关,但2个研究均证实鞣花酸对XOD具有一定的抑制作用。没食子酸对XOD的抑制作用为特殊的混合型抑制,但抑制效果较弱,而VC可协同提高没食子酸对XOD的抑制率[10];鞣花酸对XOD的抑制作用为竞争性抑制[9],而香水莲花花蕊醇提物对XOD的抑制作用为混合型抑制,说明该醇提物中除了鞣花酸,没食子酸及其他成分也对XOD的抑制作用有协同影响。且在香水莲花花蕊醇提物中,没食子酸的吸收峰为主要峰,因此,该醇提物中没食子酸及其他成分对XOD的抑制作用有待进一步研究。
综上所述,香水莲花花蕊醇提物对XOD具有一定的抑制作用,且抑制率随其质量浓度升高而增大,抑制作用类型为混合型抑制;该醇提物中的主要成分为没食子酸、鞣花酸和槲皮苷,其中鞣花酸对XOD具有一定的抑制作用,但醇提物中各成分之间的协同作用有待进一步研究。
