MsRCI2A/B/C基因超量表达对紫花苜蓿耐旱性的影响
2022-02-25李淳馨丛春龙战力峰许慧慧
才 华,李淳馨,丛春龙,战力峰,何 凯,董 理,许慧慧
(东北农业大学 生命科学学院,黑龙江 哈尔滨 150030)
紫花苜蓿(MedicagosativaL.)属多年生豆科植物,是世界上种植最广泛的牧草之一[1-3]。其不但具有蛋白质含量高的特点,而且产量也很高,素有“牧草之王”的美称[4-7]。然而我国北方地区降水量少、蒸发量大,干旱已成为制约紫花苜蓿生产的主要逆境因子[8]。植物受到干旱胁迫后,会启动一系列相关基因的表达,进而引起生理生化及代谢途径的应激反应,从而实现对干旱的响应[9-12]。多项研究表明,干旱胁迫后苜蓿细胞外渗液的电导率较低[13],而苜蓿幼苗中的脯氨酸显著累积[14],渗透调节物质K+[15]和内源激素ABA[16]的含量也明显增加。另外,逆境条件下活性氧的积累会导致苜蓿膜系统损伤和细胞伤害,而干旱胁迫下苜蓿也会通过超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等氧化酶类的响应来减缓和抵御细胞伤害[17]。
RCI2(rare cold inducible 2)是高度保守的小分子疏水多肽,其所编码的小的膜蛋白属于PMP3(plasma membrane protein 3)蛋白。RCI2/PMP3类基因作为多基因家族普遍存在,与非生物胁迫响应紧密相关[18],具有调节离子稳态、稳定细胞膜的作用。RCI2蛋白在盐、干旱和冷胁迫中都发挥着一定的作用,并通过超量表达RCI2转基因植物的抗逆性得以证实[19-22]。例如,Mitsuya等[19]发现,与野生型植物相比,AtRCI2A过表达植物生长受盐的影响较小,AtRCI2A的过表达可限制与盐胁迫相关的脂质过氧化过程,还可以减轻盐胁迫引起的光氧化伤害;水稻基因OsRCI2-5(受干旱和强冷诱导)过表达可有效增强耐旱性[20];超量表达樟毛属滨患木植株中的ALTMP1和ALTMP2基因,可以提高烟草的耐盐、耐旱、耐冷及渗透胁迫等能力[21-22]。
紫花苜蓿中存在6个RCI2基因,分别是Ms-RCI2A/B/C/D/E/F。根据其C末端氨基酸的序列特征,将这6个RCI2基因分为Ⅰ、Ⅱ类,其中MsRCI2A-C为Ⅰ类,C末端不含有疏水氨基酸;MsRCI2D-F为Ⅱ类,C末端含有疏水氨基酸。Long等[23]研究表明,MtRCI2A-C可以功能互补酵母pmp3突变体,并定位于细胞膜,而MtRCI2D和MtRCI2E不能功能互补酵母pmp3突变体,不仅位于细胞膜,内膜中也有定位,包括内质网膜;MtRCI2E和MtRCI2D基因在盐胁迫下表达变化并不显著,而MsRCI2A和MtRCI2A基因的表达受盐胁迫影响最大。综上所述,RCI2基因与众多非生物胁迫相关,但在苜蓿中与干旱相关的研究较少。本研究克隆了紫花苜蓿MsRCI2A、MsRCI2B和MsRCI2C基因,分析3个基因在20% PEG6000模拟干旱条件下的表达差异;采用农杆菌介导法获得超量表达MsRCI2A、MsRCI2B和MsRCI2C的转基因苜蓿,对干旱条件下转基因苜蓿表型和生理指标水平进行评价,确定转基因苜蓿的耐旱性,以期为苜蓿基因工程改良提供基因资源,并为提高干旱地区的苜蓿产量提供转基因育种材料。
1 材料与方法
1.1 试验材料
供试紫花苜蓿种子龙牧806,购自黑龙江省畜牧研究所。根癌农杆菌LBA4404感受态细胞,购自上海唯地生物技术有限公司。各种载体和菌株均由东北农业大学生命科学学院植物生物工程实验室保存并提供;所用引物(表1)的合成及测序工作由北京睿博兴科生物技术有限公司完成。
1.2 试验方法
1.2.1 材料培养与处理 紫花苜蓿龙牧806种子经春化处理后,置于铺有润湿滤纸的平皿中,将平皿置于温度22~25 ℃的光照培养箱中培养(16 h光照,8 h黑暗)。待幼芽长到2~3 cm时移入蛭石中培养,浇灌1/5 Hoagland营养液。15 d后移至1/5 Hoagland营养液中进行水培养,培养条件不变。
待幼苗适应4~5 d后,使用质量分数20%的PEG6000模拟干旱处理,在干旱胁迫处理前(0 h)及处理后的2,4,8,12和24 h分别取紫花苜蓿叶和根各200 mg,样品标记后迅速于液氮中速冻后,置于-80 ℃冰箱中储存备用。每个时间点、每个组织设置3个生物学重复。
1.2.2MsRCI2A/B/C基因扩增及表达分析 根据RCI2类基因家族成员登录号(表2)查找目的基因序列,设计扩增基因的引物(表1)。使用RNA提取试剂盒(康为世纪公司生产)提取紫花苜蓿总RNA,参照反转录试剂盒(Vazyme公司)反转录成cDNA作为模板进行PCR扩增。
分别提取干旱胁迫处理后紫花苜蓿叶和根中的RNA,反转录获得cDNA后用qPCR检测Ms-RCI2A/B/C基因的表达水平,所用引物见表1。目的基因表达量的相对变化采用2-ΔΔCt法计算,每个株系设置3次生物学重复。

表2 苜蓿中RCI2类基因家族成员的登录号Table 2 Accession number of RCI2 gene family members in alfalfa
1.2.3MsRCI2A/B/C植物表达载体的构建 对MsRCI2A/B/C基因扩增产物进行克隆测序,设计相应的带有酶切位点XmaⅠ、SpeⅠ的引物(表1中下划线部分),通过PCR扩增、酶切连接的方法直接连接到线性植物表达载体pMDC123,分别构建植物表达载体pMDC123-MsRCI2A/B/C。
1.2.4 转MsRCI2A/B/C基因苜蓿的获得 采用冻融法,将构建成功的植物表达载体转化到根癌农杆菌LBA4404中,借助农杆菌介导法,诱导苜蓿子叶节再生植株,以1.0 mg/L草铵膦筛选抗性植株。通过RT-PCR和qRT-PCR方法进行检测,获得超量表达的转基因苜蓿A12、A22、B13、B19、C2和C10。
1.2.5 相关生理指标的检测 对野生型株系WT(对照)和6个超量表达的苜蓿株系(A12、A22、B13、B19、C2和C10)进行扦插,枝条浸蘸生根粉,在蛭石中生根10周左右。选取长势相同的苜蓿株系,用20% PEG6000溶液浇灌模拟干旱处理,在胁迫0,6和12 d后,对超量表达的转基因苜蓿A12、A22、B13、B19、C2、C10及WT的表型进行拍照观察。然后用TYS-B叶绿素仪(中国峰龙化学仪器公司)测定植株的相对叶绿素含量(SPAD)。采用抽真空法,利用电导率仪(上海仪电科学仪器公司)测定叶片相对电导率。选取叶片和根部组织,于液氮中冻存,用于各生理指标(丙二醛(MDA)、脯氨酸和可溶性糖含量及超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性)的测定。同时以正常水分条件下生长的苜蓿为对照。各指标均采用可见分光光度法测定,按照苏州科铭生物有限公司试剂盒说明书进行操作。
1.3 数据整理与分析
使用Microsoft Excel 2000对试验数据进行整理,使用GraphPad prism 5.0对最终数据作图,用ttest对数据进行差异显著性分析。
2 结果与分析
2.1 紫花苜蓿、蒺藜苜蓿及拟南芥中RCI2类基因序列比对
为了确定基因的同源性,将测序获得的Ms-RCI2A/B/C基因序列与Phytozome数据库中下载的8个拟南芥AtRCI2s基因和3个蒺藜苜蓿Mt-RCI2s基因进行了多序列比对分析,结果见图1和表3。由图1和表3可知,苜蓿中的RCI2类基因成员间序列高度相似,与拟南芥RCI2基因氨基酸序列的一致性均低于90%;MsRCI2A/B/C基因C末端不含有疏水氨基酸,属于Ⅰ类RCI2[23]。另外,紫花苜蓿MsRCI2A/B/C基因与蒺藜苜蓿Mt-RCI2A/B/C基因的相似性均大于97.58%,但也存在个别氨基酸的差异。
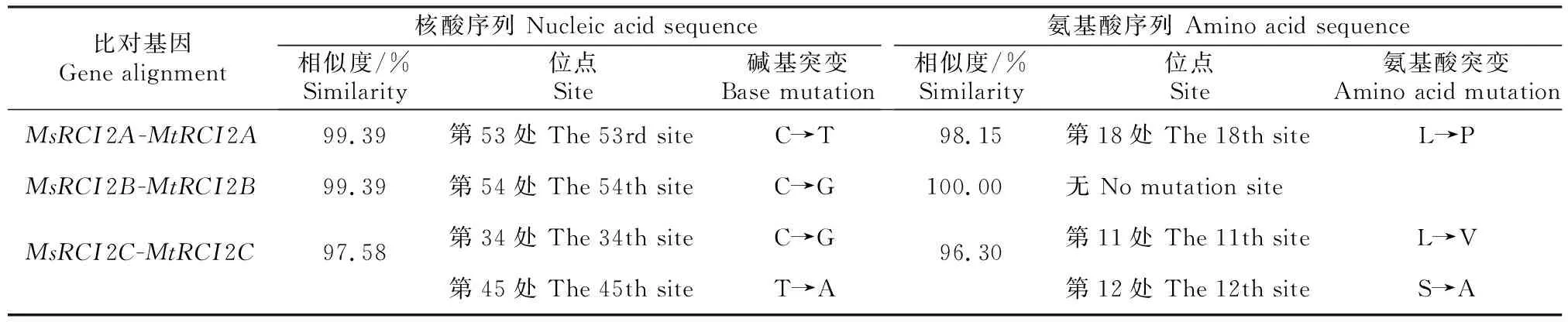
表3 紫花苜蓿MsRCI2A/B/C基因和蒺藜苜蓿MtRCI2A/B/C基因序列的比对Table 3 Sequence alignment of MsRCI2A/B/C genes and MtRCI2A/B/C genes
2.2 干旱胁迫下RCI2类基因表达的差异
在20% PEG6000模拟干旱胁迫处理前及处理后的2,4,8,12和24 h,分别取紫花苜蓿叶和根,分析干旱胁迫下RCI2类基因的相对表达量,结果见图2。由图2可见,紫花苜蓿叶片中的MsRCI2A/B/C基因均受干旱诱导明显上调,MsRCI2A和MsRCI2C基因在干旱胁迫处理2 h即极显著上调(P<0.01),而MsRCI2B的表达相对缓慢,在处理8 h时极显著上升(P<0.01)。在根中,MsRCI2A/B/C基因在干旱胁迫处理2 h时表达极显著下降(P<0.01)。由此可见,MsRCI2A、MsRCI2B、MsRCI2C基因均属于干旱早期应答的基因,虽其在根和叶中表达变化趋势相反,但3个基因在同一组织中的表达趋势相似。
2.3 超量表达MsRCI2A/B/C基因苜蓿的获得
采用农杆菌介导苜蓿子叶节的方法,获得干旱抗性转基因苜蓿。对抗性转基因苜蓿进行RT-PCR和qRT-PCR检测,结果见图3和4。由图3和4可知,成功获得了超量表达MsRCI2A基因的转基因苜蓿A12、A22,超量表达MsRCI2B基因的转基因苜蓿B13、B19及超量表达MsRCI2C基因的转基因苜蓿C2、C10。
2.4 干旱胁迫下转基因紫花苜蓿的表型特征
对转基因株系A12、A22、B13、B19、C2和C10与野生型苜蓿(WT)同时进行20% PEG6000模拟干旱胁迫处理,在干旱胁迫0,6 和12 d后,对正常水分条件下和干旱胁迫下的转基因苜蓿与野生型苜蓿(WT)的表型进行观察,结果见图5。由图5可见,在正常条件下,WT和各转基因株系在表型上并无太大差异;但在干旱胁迫处理6 d时,WT的生长受到明显抑制,而各转基因株系的生长几乎未受到影响;在干旱胁迫处理12 d时,WT叶片枯萎现象严重,而各转基因株系只有部分叶片发黄枯萎。基于干旱胁迫下的表型观察发现,与WT相比,转基因株系抗旱性更强。
2.5 干旱胁迫对转基因苜蓿叶绿素含量和叶片相对电导率的影响
为了确定干旱胁迫对苜蓿生理指标的影响,测定了6个转基因紫花苜蓿与野生型紫花苜蓿(WT)植株叶片的叶绿素含量及相对电导率,结果见图6。由图6可知,在正常条件下,除C2和C10外,各转基因株系叶绿素含量与WT并无明显差异;干旱胁迫6 d时,WT植株的叶绿素含量下降最为明显;胁迫12 d时,各转基因株系的叶绿素含量极显著高于WT(P<0.01),A12、A22、B13、B19、C2和C10植株的叶绿素含量分别是WT叶绿素含量的3.08,3.46,3.23,3.00,3.23和3.22倍。相对电导率的变化与叶绿素含量的变化相反,胁迫6 d后,WT植株叶片的相对电导率明显上升,胁迫12 d时转基因各株系的相对电导率均极显著低于WT植株(P<0.01)。
2.6 干旱胁迫对转基因苜蓿MDA含量和抗氧化酶活性的影响
为了研究干旱胁迫下苜蓿膜脂氧化程度和抗氧化能力,测定了6个转基因紫花苜蓿和野生型紫花苜蓿WT根和叶中的MDA含量及抗氧化酶活性,结果见图7。图7显示,在正常生长条件下,WT和转基因苜蓿叶片和根中的MDA含量并无太大差异;干旱胁迫6 d时,WT植株叶和根中的MDA极显著高于转基因株系(P<0.01);胁迫12 d时,WT植株叶和根中的MDA含量分别是转基因植株的2.2和2.3倍。可见各转基因株系膜脂损伤程度更低,耐旱性更强。与之对应,正常条件下转基因紫花苜蓿株系叶和根中的SOD、POD和CAT活性均高于WT植株,其中B13、B19、C2和C10叶片中的SOD活性是WT的2倍,B13、B19、C2和C10叶和根中的POD活性也均显著高于WT(P<0.05)。在干旱胁迫6 d时,大多数转基因株系叶和根中的SOD、POD、CAT活性均显著或极显著高于WT;而在胁迫12 d时,6个转基因株系叶和根中的SOD、POD、CAT活性持续上升,均显著或极显著高于WT,其中以CAT活性差异最为显著。由此可知,MRCI2A/B/C基因的超量表达,可以激活植株干旱胁迫下的抗氧化酶系统,从而使转基因植株的抗氧化能力强于野生型,并降低了膜脂氧化水平。
2.7 干旱胁迫对转基因苜蓿渗透调节能力的影响
PEG6000模拟干旱是通过调节植物渗透压的变化造成植物生理性干旱。为了分析转基因株系细胞的渗透调节能力,测定了6个转基因紫花苜蓿株系及野生型紫花苜蓿(WT)干旱胁迫前后根、叶中脯氨酸和可溶性糖含量的变化,结果见图8。由图8可见,在正常条件下,各转基因株系紫花苜蓿根、叶中的可溶性糖含量与WT无显著性差异;干旱胁迫6 d时,除A12外,其他株系叶中的可溶性糖含量显著升高,而根中变化不明显;干旱胁迫12 d时,转基因各株系叶和根中的可溶性糖含量分别是WT的1.75和1.70倍。脯氨酸含量的变化与可溶性糖含量相似,在正常条件下,转基因苜蓿中的脯氨酸含量与WT 差异不显著;干旱胁迫6 d后,各转基因株系根和叶中的脯氨酸含量均明显上升,极显著高于WT(P<0.01);干旱胁迫12 d时,转基因株系与WT的差异更为显著(P<0.01)。由此可见,在干旱胁迫条件下,MsRCI2A/B/C基因的超量表达可增强转基因植株的渗透调节能力,进而对苜蓿细胞起到一定的渗透保护作用。
3 讨论与结论
RCI2类基因可响应多种非生物胁迫,超量表达的RCI2类基因可显著提高植物对非生物胁迫的抗性,如超量表达紫花苜蓿MsRCI2A基因可以提高拟南芥的耐盐性[19];超量表达OsRCI2类基因可以提高水稻的抗旱性[24]。本研究结果表明,紫花苜蓿叶中的MsRCI2A、MsRCI2B、MsRCI2C基因在干旱胁迫条件下相对表达量明显上调,以MsRCI2A基因的变化幅度最大;而在根中3个基因的相对表达量均明显下降,且在根中的变化幅度更为显著。这表明MsRCI2A、MsRCI2B、MsRCI2C3个基因在干旱胁迫下响应迅速,且均参与了干旱的早期应答。但是即使3个基因高度同源,其对非生物胁迫的响应也存在差别。值得注意的是,干旱胁迫条件下MsRCI2s基因在紫花苜蓿根和叶中的表达存在相反的变化趋势。拟南芥8个AtRCI2s基因中,At-RCI2A/B/D/F4个基因在根中的表达量明显高于叶片;而在叶片中,除AtRCI2C外的其他7个基因均表现为干旱上调表达,其中以AtRCI2A/F的上调最为显著[18]。玉米中的8个PMP3基因在干旱条件下的表达模式也各不相同,但并未显示出地上和地下明显相反的表达模式[25]。虽然目前对Ms-RCI2A/B/C基因在苜蓿根和叶中的差异表达机制尚不明确,但可以确定的是,其在根和叶中响应干旱胁迫的分子机制并不相同。
我国干旱地区主要集中在北方,而干旱胁迫会对植物造成一系列的伤害,进而影响植物的形态、生理和生化功能[26]。本研究中,MsRCI2A/B/C基因的超量表达可明显提高苜蓿的耐旱能力,主要表现为转基因苜蓿抗氧化能力及渗透调节能力提高,膜脂氧化程度下降,细胞膜稳定性增强。基于此,认为该类基因可应用于苜蓿耐旱的分子育种。
由于RCI2是较小的膜蛋白,并不能单独进行离子转运,因此很多研究推测其可能是通过修饰或调控其他膜蛋白而发挥功能。有研究表明,RCI2与糖渗透酶(Mal31)、氨基酸渗透酶(Gap1 和Agp1)、 S-甲基甲硫氨酸通透酶(Mmp1)和氨通透酶(Ydr307w、 Mep2)存在相互作用[27-28]。说明与这些酶相互作用或许可以改变物质的通透性和细胞的渗透压。本研究发现,干旱胁迫后,转MsRCI2A/B/C基因紫花苜蓿植株可溶性糖和脯氨酸含量大量积累,推测MsRCI2s蛋白可能通过调控其他膜蛋白或者与其他蛋白相互作用改变可溶性物质的积累和转运,从而间接参与干旱应答过程,然而具体的调控机理还有待进一步研究。
综上所述,紫花苜蓿MsRCI2A/B/C基因可响应干旱胁迫,但其在根和叶中存在不同的表达模式。MsRCI2A/B/C基因的超量表达均可提高紫花苜蓿对干旱胁迫的耐性,说明这3个基因可应用于苜蓿的遗传改良。
