基于腰椎螺旋CT图像以卷积神经网络技术全自动识别并重建椎间盘的可行性
2022-02-25熊祚钢叶喜林臧天龙吴海萍徐辉雄
熊祚钢,吴 敏,叶喜林,臧天龙,吴海萍,徐辉雄
[1.南华大学衡阳医学院研究生院,湖南 衡阳 421001;2.同济大学附属第十人民医院超声科,4.放射科,上海 200072;3.上海市平安好医健康检测中心放射科,上海 200030;5.上海市平安科技(深圳)有限公司,上海 200030]
近年腰背痛患者日趋增多,腰椎间盘突出是最常见原因[1]。CT常用于诊断椎间盘疾病。随着设备与技术的发展,低剂量螺旋CT扫描已逐步替代椎间盘轴位扫描,显示腰椎间盘病变与椎间孔、神经根关系及椎管狭窄程度更优[2-3]。人工智能(artificial intelligence, AI)技术已广泛用于分析医学图像,能显著提高医师的诊断效率[4-6],用于脊柱图像分割与征象识别[7-8]较多,而针对椎间盘重建的研究相对少见。本研究观察基于卷积神经网络椎间盘全自动识别及重建腰椎螺旋CT图像的可行性。
1 资料与方法
1.1 一般资料 回顾性分析2019年1月—12月400例就诊于上海市第十人民医院及上海市平安好医健康检测中心并接受腰椎螺旋CT扫描的腰痛患者,男214例,女186例,年龄20~75岁,平均(34.9±6.5)岁。以其中320例为训练集,验证集和测试集各40例。训练集男170例,女150例,年龄20~40岁,平均(34.0±4.8)岁;验证集男21例,女19例,年龄23~40岁,平均(38.0±4.3)岁;测试集男23例、女17例,年龄22~75岁,平均(41.4±13.1)岁,其中23例存在畸形(3例同时存在腰椎侧弯和腰骶移行椎畸形)。
纳入标准:训练集和验证集年龄20~40岁,有腰痛症状,腰部螺旋CT扫描层厚<3 mm;测试集年龄不受限制,其余纳入标准同上,且影像学诊断腰椎间盘突出、膨出。排除标准:非椎间盘疾病(如肿瘤、骨折等)引起的腰痛,图像存在伪影(如金属植入物等),图像质量不佳。
1.2 仪器与方法 采用Philips Brilliance 64通道螺旋CT机、GE Bright Speed 16排螺旋CT机及联影公司uCT 510 16、32或64层CT机。通过影像归档和通信系统(picture archiving and communication systems, PACs)获取腰椎螺旋CT扫描数据,格式符合医学数字影像和通讯(digital imaging and communications in medicine, DICOM)标准。
1.2.1 图像预处理及训练数据集标注 对原始DICOM数据以层厚1.25 mm进行薄层重建,同时生成骨窗与软组织窗图像。由2名具有10年以上工作经验的放射科主治医师以ITK-SNAP软件进行标注,将骶椎标注为红色,L5椎体标注为绿色,L1~L4椎体标注为黄色,椎间盘标注为蓝色,见图1。
1.2.2 AI系统学习与测试 ①分割、定位椎体与椎间盘;②提取椎间盘三维CT数据,经计算获得椎间盘正交坐标系;③重建椎间盘轴位CT图像并以DICOM格式输出。见图2。
1.2.3 AI系统腰椎间盘分割模块与重建模块 采用深度学习(deep learning, DL)3D V-Net模型完成分割
任务。训练策略:以预置模型将目标脊柱影像分为4类模块,S1椎体作为脊柱的基准定位标志为第一类别模块(红色),L5椎体作为第二类别模块(绿色),L1~L4椎体作为第三类别模块(黄色),椎间盘作为第四类别模块(蓝色)。
利用3D V-Net模型从原始DICOM数据中提取椎间盘区域数据,计算椎间盘几何中心,建立基于x、y、z轴3个主方向的椎间盘3D坐标系(图3);根据第一、第二主方向重建椎间盘轴位图像,依据第三主方向高度将椎间盘分为4等份,由上至下依次生成5幅轴位图像(图2B),以DICOM格式输出。
1.2.4 AI系统测试 采用Dice系数评价分割结果,系数取值范围为0~1(越接近1表明准确性越高)。
对每个椎间盘生成5幅AI重建图像。由1名具有10年以上工作经验的放射科主治医师于GE AW4.6后处理工作站重建图像,对每个椎间盘生成5幅图像,层厚为1.25 mm。
由2名具有15年以上工作经验的放射科副主任医师以盲法对人工重建和AI重建图像质量进行主观评分。评分标准:未清晰显示组织结构(椎间盘、硬膜囊、神经根及椎间孔)、不能满足诊断需求为1分;完整显示椎间盘为2分;显示椎管内结构及神经根、椎间孔结构为3分;清晰显示组织结构(椎间盘、硬膜囊、神经根、椎间孔)及椎间盘与硬膜囊、神经根关系为4分。
1.3 统计学分析 采用SPSS 26.0统计分析软件。以±s表示年龄,采用方差分析进行多组间比较,两两比较采用LSD-t检验;采用χ2检验比较性别;以秩和检验比较图像质量评分。以加权Kappa检验分析2名医师评分结果的一致性:加权Kappa系数值<0.20为一致性较差,0.21~0.40为一般,0.41~0.60为中等,0.61~0.80为较强,0.81~1为强。P<0.05为差异有统计学意义。
2 结果
训练集、验证集和测试集患者性别差异无统计学意义(χ2=0.291,P=0.864);年龄差异有统计学意义(F=25.704,P<0.001),测试集年龄大于训练集和验证集(P均<0.05)。
AI分割骶椎椎体、L5椎体、L1~L4椎体及椎间盘的Dice系数分别为0.953、0.940、0.940及0.926,平均0.940。
采用AI系统针对测试集40例患者的腰椎螺旋CT数据完成了197个椎间盘重建;2例因腰椎侧弯畸形致L1-2椎间盘未完整显示、1个椎间盘因L5骶化移行椎畸形致L5-S1椎间盘体积小于最小重建阈值而未能重建。
2名医师对197幅AI重建图像及人工重建图像的中位评分结果均为4分,差异无统计学意义(P均>0.05);评分一致性加权Kappa值为0.862[95%CI(0.778,0.946),P<0.001]。见表1及图4、5。
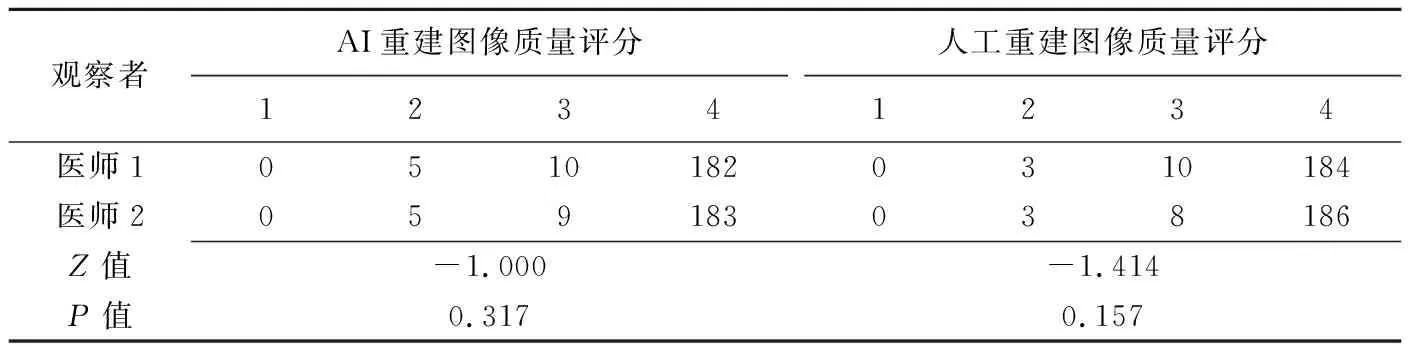
表1 2名放射科医师对AI重建与人工重建CT图像的质量评分结果比较(幅,n=197)
3 讨论
腰椎间盘疾病是导致腰痛最常见原因之一[1]。临床工作中,CT是影像学检查腰椎疾病的首选工具。对于腰椎间盘疾病患者,相比椎间盘轴位扫描,低剂量螺旋CT连续扫描可获取更多图像信息,使诊断更为准确,并能缩短扫描时间、降低辐射损伤[3]。为更好地显示椎间盘与周围结构关系,常需对CT图像进行重建等后处理,导致医师工作量增加[2];如医师经验不足或于疲乏状态下处理图像,易使图像显示不完整而导致误诊、漏诊[9]。AI技术用于诊断脊柱疾病可提高医师工作效率[7-8]。FORSBERG等[10]以DL模型在识别MRI中的腰椎椎体,其准确性达98.8%;OKTAY等[11]报道,支持向量法定位椎间盘的误差为2.6~3.6 mm,几乎达到影像科主治医师水平,可帮助医师快速图像定位;但JAKUBICEK等[12]将卷积神经网络法用于分割存在脊柱畸形或扫描不完整图像时,AI识别准确率为87.1%。有学者[13]认为AI识别准确率下降的原因可能是模型对发育异常的S1和L5椎体存在定位错误。考虑到脊柱侧弯导致部分椎体扫描不全、腰骶移行椎畸形等情况可能影响模型评价效果,本研究采用四分类预置模型策略对模型进行训练,首先分割L5椎体及骶椎、判断是否存在移行椎畸形,之后依次向上分割L1~L4椎体,结果显示该模型可准确识别L1~S1各椎体与椎间盘,其分割平均精度为0.940,对椎间盘的分割精度达0.926,表明模型可精准分割图像中的椎间盘结构。
本研究在AI辅助完成椎间盘分割基础上重建椎间盘轴位CT图像。标准椎间盘轴位CT图像是判断椎间盘突出类型及其与神经根关系、椎管狭窄程度的关键,亦为外科医师制定手术策略的重要依据[14]。本研究中AI重建的197个椎间盘图像均能满足诊断需求、完整显示椎间盘及椎管、神经根等结构,图像质量与人工重建效果相当;2名放射科医师其中对5个椎间盘的AI重建图像的评分为2分,其椎间孔、神经根显示不清的可能原因是存在椎间盘疾病。
本研究存在的局限性:训练集均为40岁以下患者青中年,缺乏老年人群可能存在的严重腰椎退变;未进一步验证系统分类诊断腰椎间盘突出的效能。
综上所述,AI辅助系统能对腰椎螺旋CT图像中的椎间盘进行全自动识别及重建,图像质量可达人工重建标准,可行性令人满意,临床应用前景广阔。
