橄榄ISSR和RAPD遗传多样性分析和核心种质构建
2022-02-25赖瑞联陈瑾冯新韦晓霞陈义挺沈朝贵吴如健
赖瑞联, 陈瑾, 冯新, 韦晓霞, 陈义挺, 沈朝贵, 吴如健
橄榄ISSR和RAPD遗传多样性分析和核心种质构建
赖瑞联, 陈瑾, 冯新, 韦晓霞, 陈义挺, 沈朝贵, 吴如健*
(福建省农业科学院果树研究所,福州 350013)
为揭示中国橄榄()种质资源的遗传多样性,采用ISSR和RAPD标记对橄榄主要分布区的86份种质资源进行遗传多样性分析并构建核心种质。结果表明,基于UPGMA遗传相似系数,86份种质资源可分为3个大类;基于STRUCTURE模型聚类,可分为4个类群,这基本符合橄榄的地域性分布规律。采用ISSR和RAPD获得的中国橄榄种质资源的整体遗传多样性水平分别为0.284±0.169和0.244±0.163,多态性位点百分率分别为92.56%和100%,总遗传分化系数分别为0.127和0.142,基因流分别为3.423和3.025,群体间遗传相似系数分别为0.930和0.939,个体间遗传相似系数分别为0.736和0.732。因此,中国橄榄种质资源丰富的遗传多样性主要来源于个体间的遗传分化或变异,且这种遗传多样性存在明显的地域性差异。
橄榄;遗传多样性;核心种质;ISSR;RAPD
橄榄()又名青果,是国家卫健委公布的药食同源原料。作为《中国药典》记载的传统中药材,橄榄各组织均有良好的药用价值,其果实味甘涩酸、性平,具有生津、利咽、清肺、解毒等功效;根微苦性平,能够清咽、祛湿、舒筋;核仁味甘性平,可润燥、解毒。最近的研究表明,橄榄富含多酚、类黄酮、氨基酸、脂肪酸、维生素C和矿质元素等药用成分,在抗氧化[1–2]、抗病毒[3]、抗菌消炎[4]以及缓解糖尿病[5]等方面均有很好的药理活性。通常认为,中国是橄榄种质资源起源和遗传多样性中心[6]。作为我国重要的特色中药资源,开展橄榄种质资源研究对其资源保护和开发利用具有重要意义。
单重复序列间隔区(inter-simple sequence repeats,ISSR)和随机扩增DNA多态性(random amplified poly- morphic DNA, RAPD)是物种遗传多样性研究中常见方法[7–8]。在橄榄种质资源遗传多样性研究中, ISSR和RAPD反应体系已建立并进行了改良[9–14]。杨培奎等[15–16]采用ISSR技术认为广东省粤东地区和潮汕地区橄榄遗传多样性水平较低,且与来源地和品种名关系不大;刘天亮[17]采用ISSR技术认为橄榄遗传多样性与地理环境存在相关性,且福建省内橄榄品种遗传多样性较为丰富;张明贤等[18]采用ISSR技术对福州市主栽橄榄品种和优株进行了鉴定。聂珍素[19]采用RAPD技术认为福建省橄榄遗传分化较大,遗传背景较复杂。此外,SRAP (sequence- related amplified polymerphism)[19]和AFLP (amplified fragment length polymerphism)[20–21]等技术也在橄榄遗传多样性研究中应用。然而,目前橄榄种质资源遗传多样性研究多集中在较小地区范围内,且受样本数量限制,研究结果难以代表整个中国橄榄种质资源遗传多样性和亲缘关系特征。此外,当前研究方法主要使用单一技术分析橄榄遗传背景,缺乏彼此之间相互验证,在一定程度上削弱了研究结果的准确性和可靠度。
核心种质构建一直是物种种质资源研究的热点[22]。常用的核心种质取样策略主要包括随机取样策略(completely random sampling strategy, R)和系统取样策略,其中系统取样策略又包括C (constand strategy)、P (proportional strategy)、L (logarithmic strategy)、S (square root strategy)、G (genetic diversity dependent strategy)和M (maximization strategy)等。Yonezawa等[23]提出遗传冗余度(degree of genetic redundancy)为0.2~0.9,核心种质的最适取样比例为20%~30%,同时认为G策略明显优于R、P、L、C策略。在橄榄核心种质构建方面,杨培奎[24]提出, 基于ISSR分析结果,依据Nei & Li计算遗传距离和非加权配对法(UPGMA法)聚类,采用G策略按样本量总数的25%取样时能获得具有较高代表性的橄榄核心种质库。为进一步揭示中国橄榄种群的遗传多样性,本研究基于ISSR和RAPD对主要分布区和产区的86份橄榄种质资源进行研究,系统揭示中国橄榄种质资源的遗传多样性特征,并初步构建核心种质,以期为橄榄种质资源保存研究和开发利用提供科学依据。
1 材料和方法
1.1 材料
试验所用的86份橄榄种质资源采自农业农村部福州橄榄种质资源圃,涵盖了福建、广东、广西、四川和浙江等中国橄榄主要分布区的种质资源(表1)。
1.2 方法
基因组DNA提取 采集生长健壮、无病虫害的橄榄当年新抽嫩叶,清水洗净后用滤纸吸干, 迅速去除叶脉,随后采用改良CTAB法提取橄榄基因组DNA。采用1.5%的琼脂糖凝胶电泳检测橄榄基因组DNA的纯度,用超微量紫外光分光光度计测定A260和A280,计算A260/A280和基因组DNA浓度。质量和纯度检测合格后,置于-20 ℃冰箱中保存备用。
PCR扩增 采用混样基因组DNA对26对ISSR引物[17,24]进一步筛选,选取12对扩增效率高、条带清晰、重复性高、多态性好的引物进行ISSR-PCR扩增(表2)。ISSR-PCR扩增体系为DreamTaq Green PCR Master Mix (2×) 12.5L,DNA模板50 ng, 引物0.8mol/L,用高压ddH2O补足至终体积25L。反应程序为95 ℃预变性5 min;然后95 ℃变性30 s,退火45 s,72 ℃延伸2 min,共35次循环;再72 ℃延伸10 min。从26对RAPD引物[19,25]中选取9对最适引物进行RAPD-PCR扩增(表2), 扩增体系为DreamTaq Green PCR Master Mix (2×) 12.5L, DNA模板50 ng,引物0.8mol/L,用高压ddH2O补足至终体积25L。反应程序为94 ℃预变性4 min;然后94 ℃变性1 min,退火1.5 min, 72 ℃延伸2 min,共45次循环;再72 ℃延伸10 min。PCR扩增结束后采用1.5%的琼脂糖凝胶电泳检测条带, 并拍照保存。

表1 橄榄种质资源信息
1.3 数据处理和统计
根据ISSR和RAPD电泳图谱,将任意位点条带记为1,相应位点没有条带记为0,构建1、0二元数据矩阵。采用Popgene 32分析橄榄的遗传多样性指数,包括观测等位基因数(observed number of alleles,)、有效等位基因数(effective number of alleles,)、Nei’s基因多样性参数(Nei’s genetic diversity,)、Shannon’s信息指数(Shannon’s information index,)、多态性位点数(number of polymorphism loci,)和多态性位点百分率(percentage of polymorphism loci,)等;采用NTSYS 2.10e分析遗传相似系数,基于遗传距离采用UPGMA法制作聚类树状图;参照Evanno等[26]的方法采用STRUCTURE 2.2构建橄榄种质资源模型聚类图。

表2 试验所用ISSR和RAPD引物
1.4 核心种质构建
利用ISSR和RAPD电泳图谱二元矩阵,参照杨培奎等[24]的方法,依据Nei & Li计算遗传距离,采用UPGMA法进行聚类。采用G策略确定各亚组的取样比例,组内取样利用多次聚类随机取样的方法逐步删减达到总样本量的25%,若组内只有1份样本则直接选取构成核心种质。比较分析核心种质和初始种质的遗传多样性差异。
2 结果和分析
2.1 遗传多态性分析
从图1和表3可见,12条ISSR引物对86份橄榄种质资源共扩增出242条带,其中231条多态性条带,每条引物扩增20.17条带和19.25多态性条带, 多态性百分率为95.45%。其中UBC889扩增的多态性条带最少,多态性条带百分率仅为82.61%,而UBC818、UBC825、UBC826、UBC840、UBC841和UBC855扩增的多态性百分率均为100%。9条RAPD引物扩增出160条带,其中156条为多态性条带,每条引物扩增17.78条带和17.33多态性条带,多态性百分率为97.50%。其中S58扩增的多态性条带最少,多态性条带百分率仅为88.89%,而SBS- A5、SBS-A15、SBS-I1、SBS-Q4和SBS-Q9的多态性百分率均为100%。这说明中国橄榄种质资源具有较高水平的遗传多态性,可能存在较高频率的遗传变异。
2.2 聚类分析
采用NTSYS 2.10e构建了86份橄榄种质资源的遗传进化树(图2)。基于ISSR分析,福建南安的‘埔垱1号’ (28)与其他种质资源的亲缘关系较远,其他85份橄榄种质资源主要分为3大类(I-1、I-2、I-3)。I-1包含44份来自福建和3份来自广东的种质资源,其中I-1中福建福安的‘葡萄’(1)与其他种质资源的遗传距离较远,其余46份种质资源又可分为2个亚类(I-1-1和I-1-2)。I-1-1包含23份种质资源,主要来自福建中部或北部的福安、闽侯、闽清等地区;I-1-2的23份种质资源主要来源于福建省纬度较低的莆田、上杭、永定、云霄、漳浦、诏安,少数来自广东的电白和高州等。可见,中国橄榄种质资源亲缘关系的地域性差异较为明显。I-2包含21份种质资源,其中4份来源于福建,分别是‘闽侯自来圆’ (11)、‘上杭三棱榄’ (40)、‘云霄穗橄榄’ (47)和‘长泰野生榄’ (52);8份来源于广东的电白、高州、化州、揭西、饶平、信宜,其中还有2份与广东较近的广西浦北和大部分的四川种质资源,初步认为广东、广西和四川的橄榄种质资源遗传距离较近;此外,福建的‘上杭三棱榄’可能引种自广东,这对橄榄同物异名现象起到了一定的校正作用。I-3包含17份种质资源,其中大部分来自浙江瑞安和平阳,还有6份福建、1份广东、1份广西和1份四川的种质资源,说明浙江橄榄种群与福建橄榄种群的种质资源存在较多的遗传交流,其遗传相似性更高。整体上,基于ISSR的分类结果符合橄榄种质资源的地域性分布,与所属生态类型存在较大的相关性,来源于同一地区或生态类型区的种质资源普遍存在较高的遗传相似性。
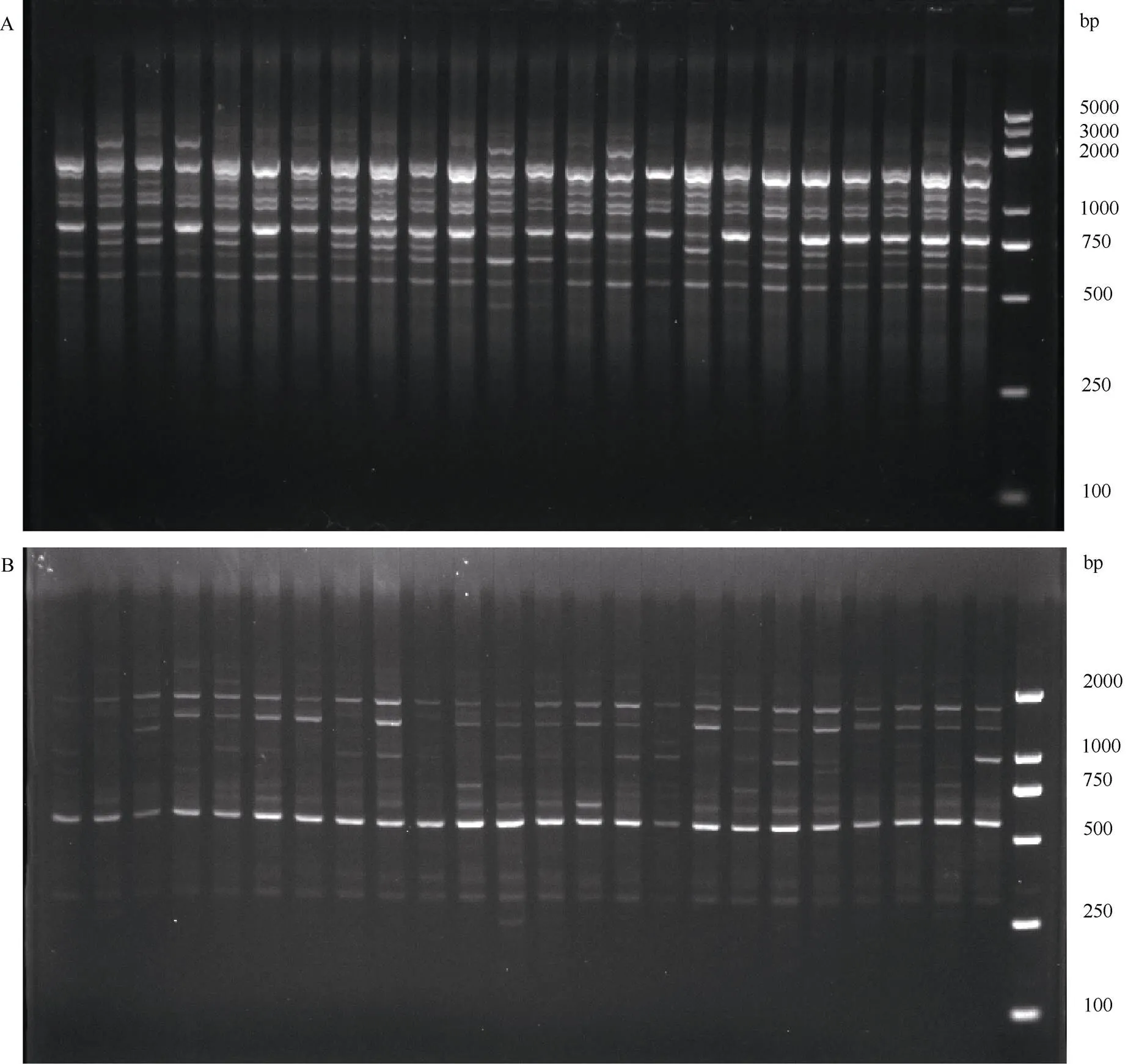
图1 ISSR和RAPD引物的扩增结果。A: 引物UBC855; B: 引物SBS-A5; A和B所用Marker分别为DL5000和DL2000 Marker。
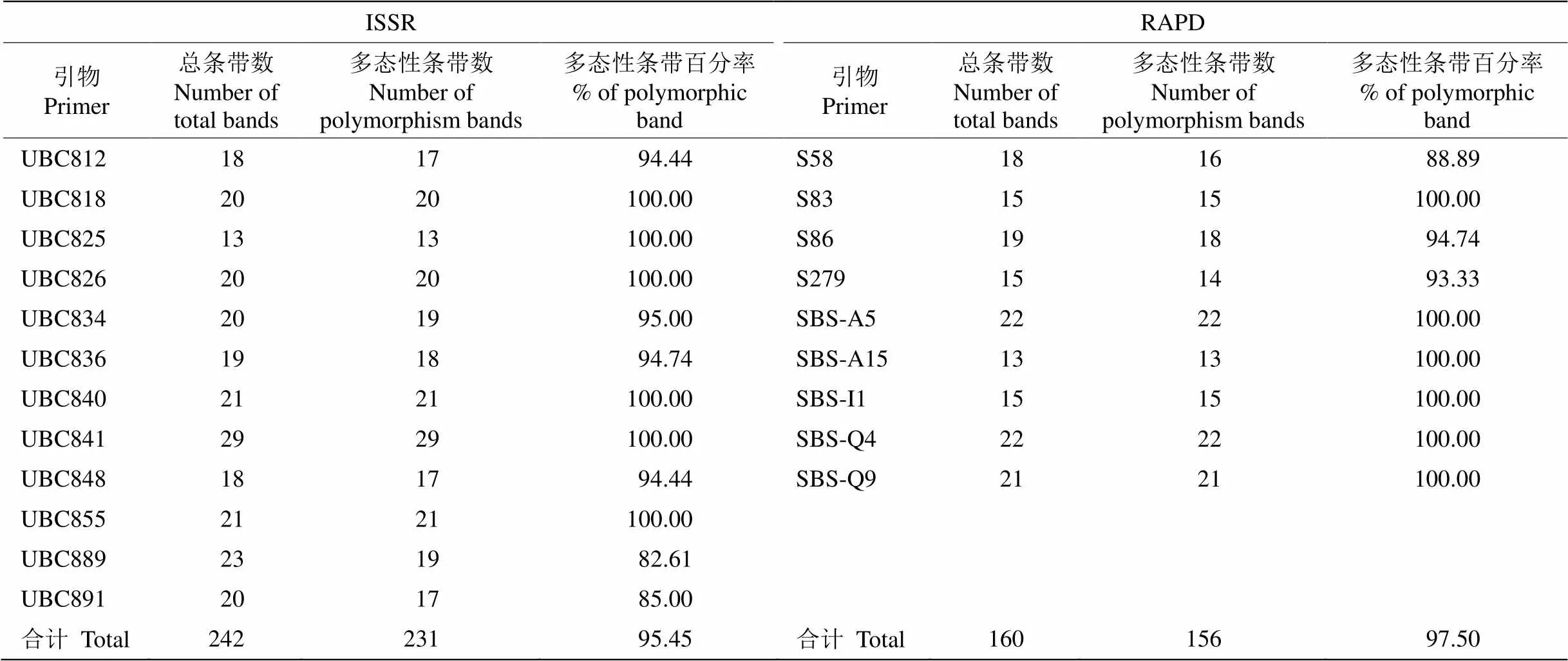
表3 橄榄的ISSR和RAPD扩增结果
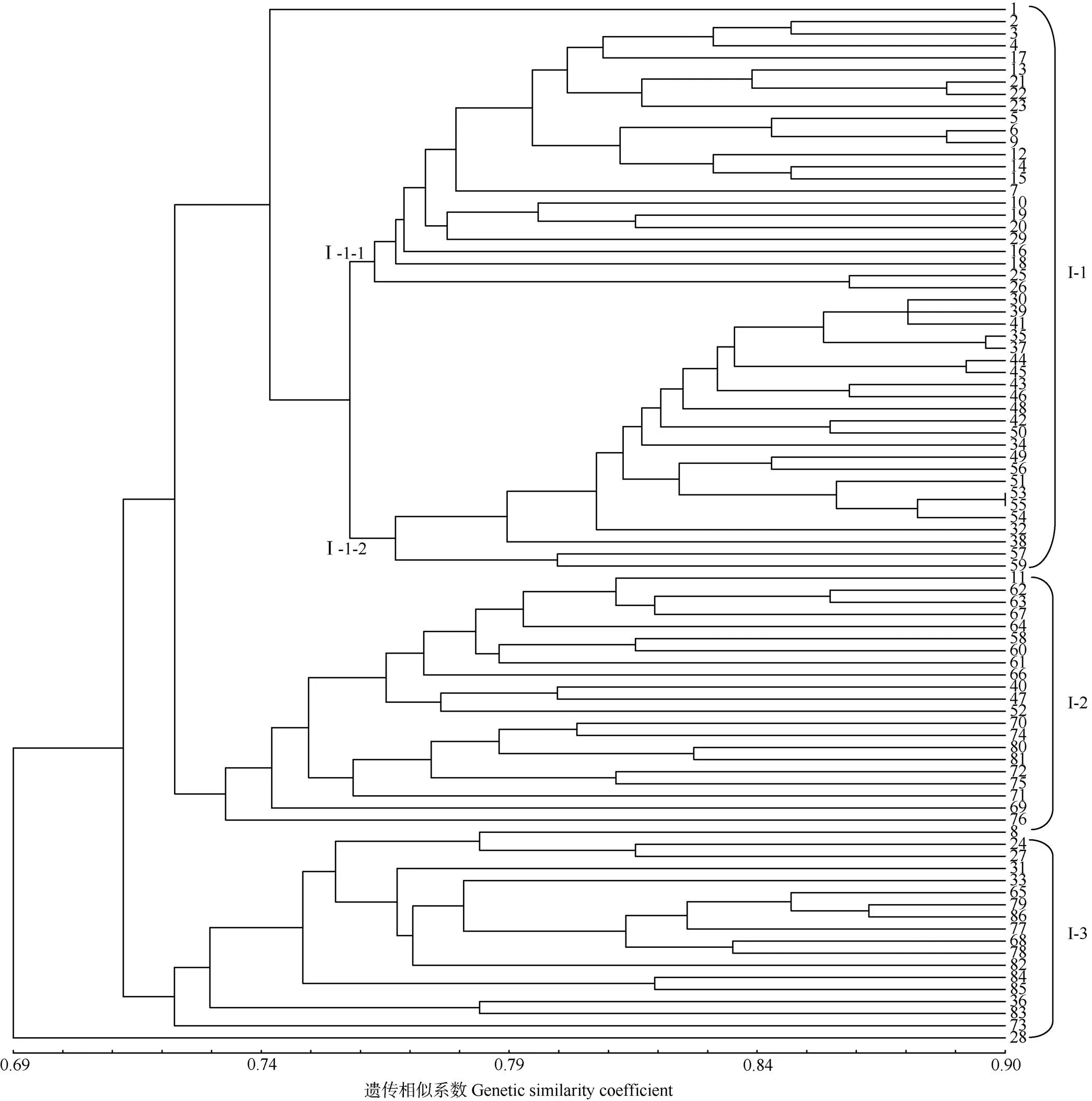
图2 基于ISSR的橄榄聚类分析。1~86见表1。
基于RAPD分析(图3),来源于福建福安的‘葡萄’(1)、四川合江的‘合江二梭子’ (74)与其他种质资源的遗传距离较远,其余84份种质资源可分为3个大类(II-1、II-2和II-3)。其中II-1和II-2各包含23份种质资源,数量和样本与基于ISSR聚类的I-1- 1和I-1-2完全一致。II-3包含38份样本,涵盖了基于ISSR聚类的I-2和I-3的绝大部分样本,仅仅缺失四川合江的‘合江二梭子’ (74),但增加了福建南安的‘埔垱1号’ (28)。从聚类的结果上看,基于ISSR和RAPD的分类具有极高的相似度,仅仅2份种质资源的归属存在差异。进一步分析表明,II-3又可分为3个亚类群(II-3-1、II-3-2和II-3-3),其中II-3-1包含了I-3中的全部样本,此外还增加了福建南安的‘埔垱1号’ (28)和福建上杭的‘小目榄’ (40); II-3-2包含了I-2的21份样本中的15份,仅仅缺失福建闽清的‘甜榄35号’ (24)、福建上杭的‘上杭小目榄’ (40)、福建长泰的‘野生榄’ (52)、广东电白的‘马路香榄’ (58)、四川合江的‘合江二梭子’ (74)和浙江瑞安的‘瑞安5号’ (83);此外,II-3-3特异性从I-2分离出2份种质资源,分别为福建闽清的‘甜榄35号’ (24)和浙江瑞安的‘瑞安5号’ (83)。可见,基于ISSR和RAPD的聚类结果仅‘葡萄’(1)、‘埔垱1号’ (28)和‘合江二梭子’ (74)的归属在大分类上存在较大差异,整体相似度达到96.51%,二者分类结果得到了相互验证,具有较高的准确性和可靠性。
假设86份橄榄种质资源群体数为2~12,重复计算7次,结果表明,基于ISSR和RAPD获得的对数似然函数值随群体数的增加呈先上升后趋于平缓,并未出现明显的拐点(图4: A-1, B-1)。对K变化趋势的分析表明,值取4时,ISSR和RAPD试验获得的K值均达到峰值,分别为404.58和403.43 (图4: A-2, B-2)。因此,基于ISSR和RAPD均将86份橄榄种质资源分为4个类群。
从各样本归属相应群体的概率(值)上看,基于ISSR的橄榄种质资源后验概率为0.547~0.996, 其中福建‘闽侯大粒黄’ (17)的分布概率值最低,仅为0.547,而福建诏安的‘新营2号’ (54)、广东饶平的‘新塘1号’ (66)、广西浦北的‘猪榄3号’ (70)和浙江平阳的‘平阳6号’ (77)分布概率均达到0.996。此外,57份样本的分布概率均在0.9以上,占总体样本的66.28%,说明本研究的聚类结果可信度较高。4个类群分布标注为i-1、i-2、i-3和i-4 (图5: A),i-1包含24份种质资源均来源于福建,所归属样本也与基于ISSR的NTSYS聚类结果I-1-1一致;i-2中的18份样本的组成成分较为复杂,其中7份来源于福建,8份来源于浙江,广东、广西和四川各1份,与I-3的样本基本一致;i-3中共有23份样本,其中20份来源于福建,3份来源于广东,与I-1-2的结果一致;i-4包含的橄榄样本中,4份来源于福建、8份来源于广东、2份来源于广西、5份来源于四川和2份来源于浙江,与I-1的结果一致。基于RAPD的橄榄种质资源后验概率为0.336~ 0.995,其中福建闽侯的‘上湾檀香’ (8)、福建南安的‘埔垱2号’ (30)和浙江瑞安的‘瑞安3号’ (84)的概率值较低, 分别为0.342、0.397和0.336。从聚类的结果来看, 基于STRUCTURE的橄榄种质资源RAPD聚类与NTSYS聚类几乎一致(图5: B),从而进一步验证了上述结果的准确性。
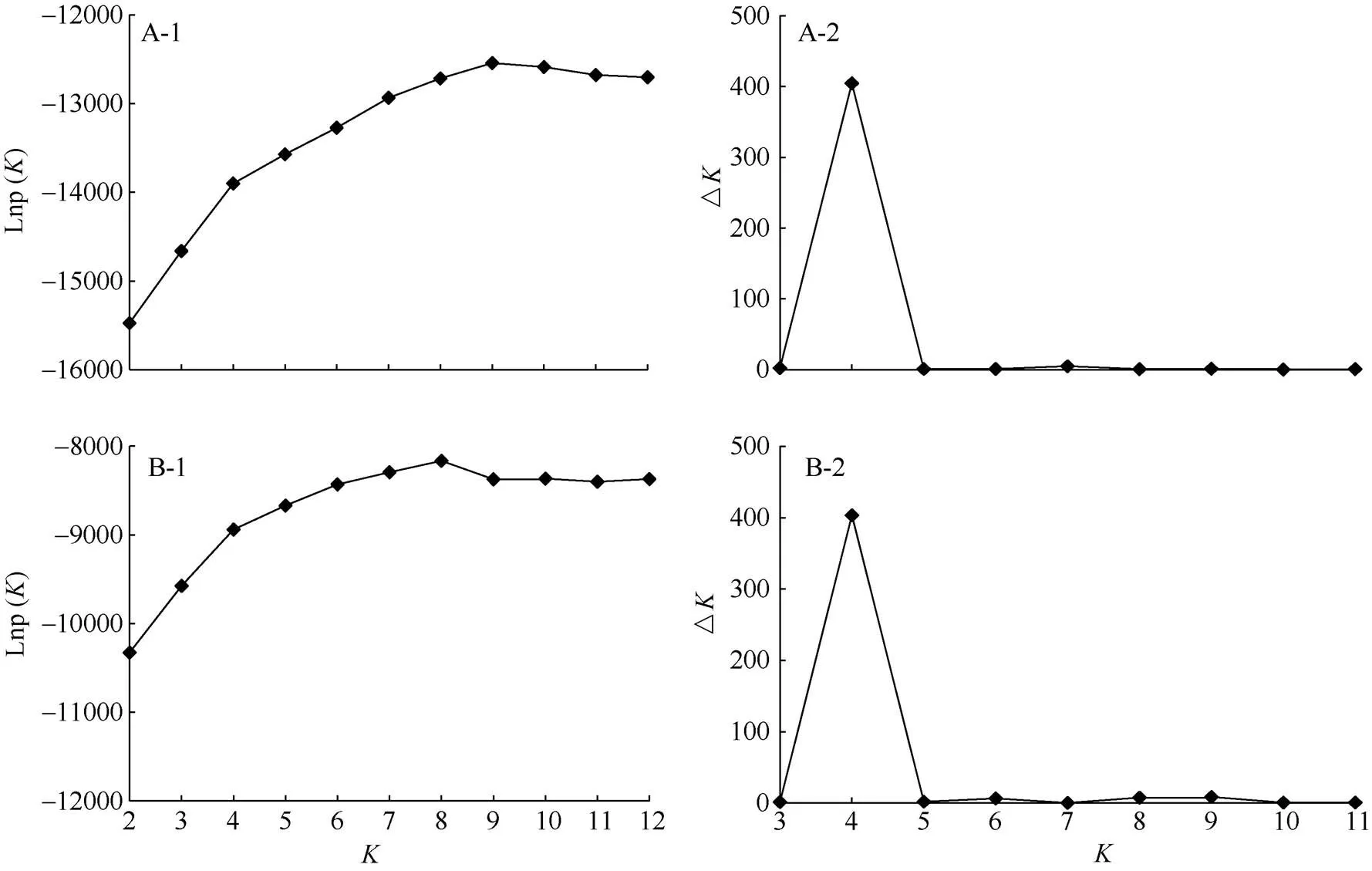
图4 ISSR (A)和RAPD (B)聚类对数似然函数值随K变化趋势及△K随K变化趋势
2.3 遗传多样性分析
UPGMA聚类和STRUCTURE聚类结果比较一致,采用Popgene 32对不同聚类群体间的遗传多样性指数进行分析(表4), 基于ISSR聚类的3个群体的观测等位基因、有效等位基因、Nei’s基因多样性指数、香农信息指数、多态性位点数和多态性位点百分率依次是I-1>I-2>I-3,但群体间的差异不大,尤其是Nei’s基因多样性指数的差异非常小,从整体上看, 基于ISSR不同聚类群体的遗传多样性水平较为一致。基于RAPD聚类的3个群体中,观测等位基因、多态性位点数和多态性位点百分率依次是II-3>II-2>II-1,与有效等位基因和香农信息指数的变化趋势不一致,而Nei’s基因多样性指数依次是II-1>II-2>II-3,说明基于RAPD聚类的橄榄群体间存在遗传多样性差异。
2.4 遗传分化与遗传距离分析
从表5可见,基于ISSR分析,中国橄榄种质资源的总遗传分化系数(G)为0.127,即87.3%的遗传分化存在于群体内,12.7%的遗传分化来源于群体间,说明群体内存在丰富的遗传分化或遗传变异。中国橄榄的基因流(N)为3.423,远远大于1.0,说明聚类获得的不同群体间存在丰富的基因交流, 可能与不同地区频繁的种质交流有关。群体内部个体间的遗传多样性(H)为0.244,总遗传多样性(H)为0.279,两者之间的差异较小,说明橄榄遗传多样性主要来源于群体内个体间,但群体间也存在一定水平的遗传多样性。与ISSR相比,基于RAPD聚类结果的总遗传分化系数较大,而H、H和N均小于ISSR。
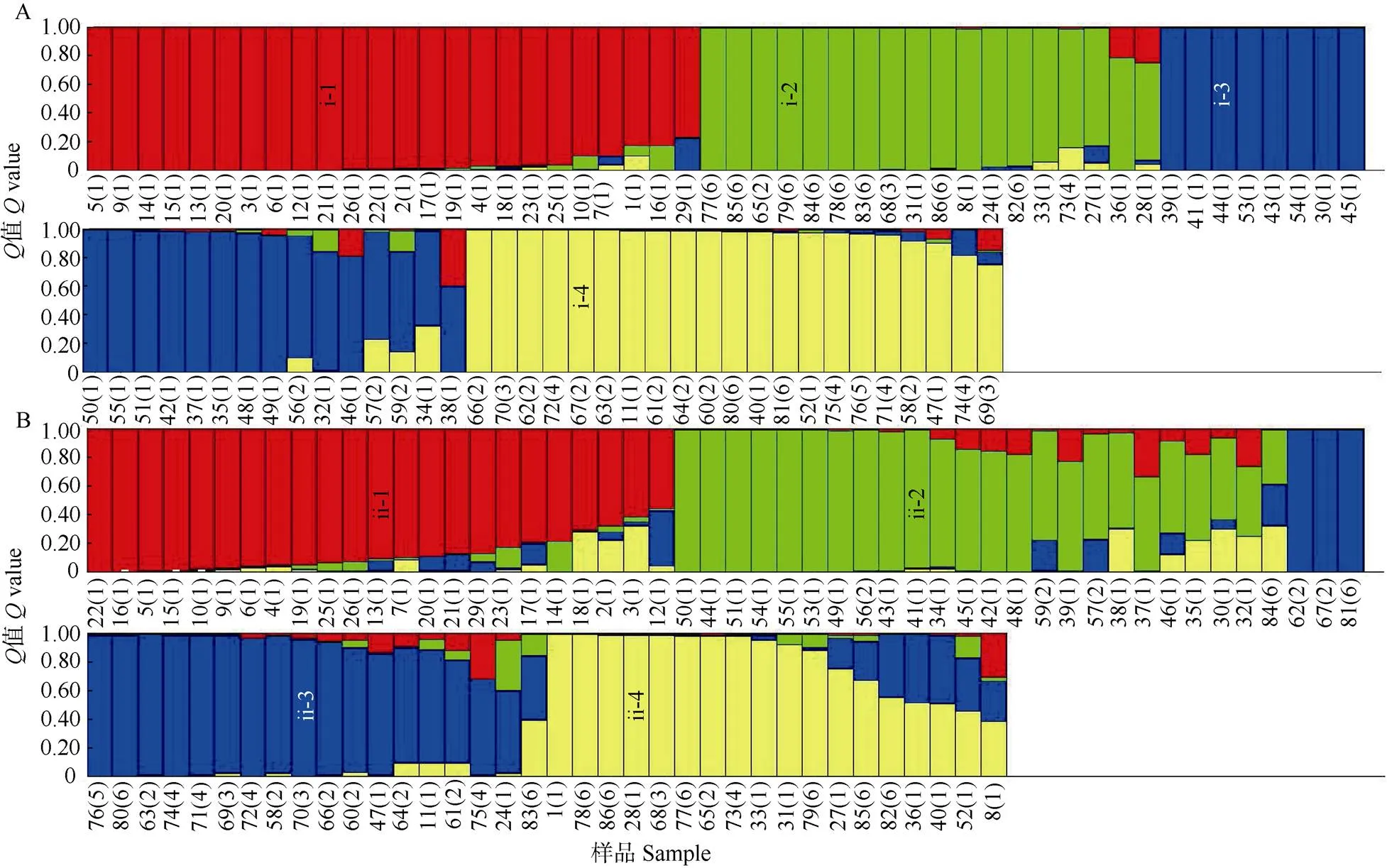
图5 基于STRUCTURE 2.2的橄榄ISSR (A)和RAPD (B)聚类。1~86见表1。
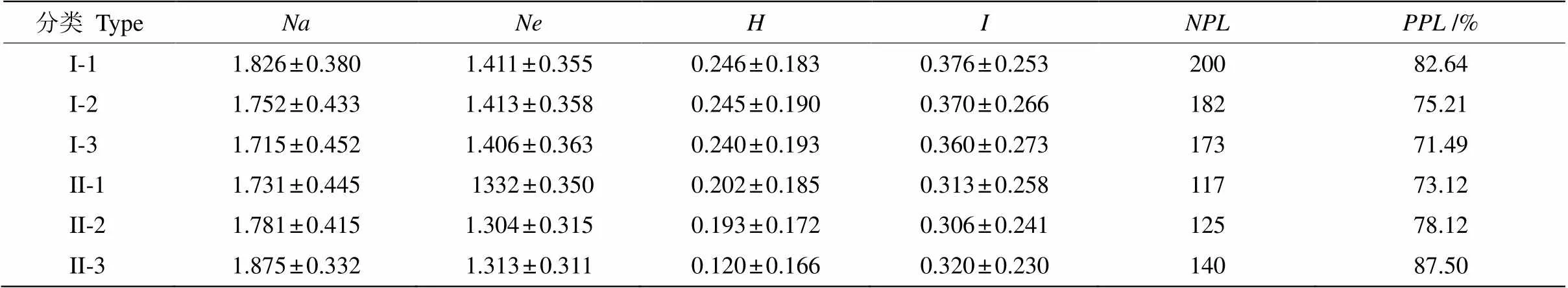
表4 橄榄群体的遗传多样性
: 观测等位基因数;: 有效等位基因数;: Nei基因多样性指数;: Shannon’s信息指数;: 多态性位点数;:多态性位点百分率。
: Observed number of alleles;: Effective number of alleles;: Nei’s genetic diversity index;: Shannon’s information index;: Number of polymorphism loci;: Percentage of polymorphism loci.

表5 橄榄群体的遗传分化系数
从橄榄群体间的遗传距离和遗传相似性来看,基于ISSR或RAPD的不同类群间遗传相似性较高,遗传距离较近,群体间的平均遗传相似系数分别为0.930和0.939,说明整体上中国橄榄种质资源群体间的遗传相似性较高。基于ISSR,86份橄榄种质资源的平均遗传相似系数为0.736,遗传相似性最高的是福建的‘诏安新营2号’和‘诏安材榄’,为0.897,而遗传相似性最弱的是福建的‘上湾檀香’和四川的‘合江三白元’,仅为0.591。基于RAPD,86份橄榄种质资源的平均遗传相似系数为0.732,遗传相似性最高的是浙江的‘平阳2号’和‘瑞安1号’, 为0.919,而遗传相似性最弱的是福建的‘葡萄’和‘小个子’,仅为0.50。可见,中国橄榄种质资源的遗传多样性与分布地域存在一定的相关性,同一地区或生态类型区的橄榄种质资源具有较高的遗传相似性。从整体上看,其遗传多样性可能主要来源于个体间的差异。
2.5 核心种质构建
采用G策略按25%取样构建86份橄榄种质资源的核心种质,核心种质在ISSR的3个群体间的取样量较为一致,RAPD中II-1和Ⅱ-2的取样量也基本相同,但II-3的取样量较少。依据Nei & Li计算遗传距离并多次UPGMA聚类获得基于ISSR构建的核心种质包括‘葡萄’、‘大目埕橄榄王’、‘上湾檀香’、‘清榄1号’、‘闽清2号’、‘福榄1号’、‘南安埔垱1号’、‘南靖南高3号’、‘三都岛4号’、‘上杭三棱榄’、‘漳浦18号’、‘漳浦7号’、‘长泰野生榄’、‘凤湖榄’、‘新塘1号’、‘猪榄2号’、‘合江二百圆’、‘合江大梭子’、‘合江丁香鼓’、‘瑞安2号’、‘瑞安5号’、‘瑞安3号’,其中福建13份,广东2份,广西1份,四川3份,浙江3份。这些样本保留了初始种质25.58%的样本量,核心种质的多态性位点保留率达到了94.20%,而观测等位基因、有效等位基因、Nei’s基因多样性指数、香农信息指数的保留率分别为97.29%、101.76%、103.52%和102.31% (表6)。此外,保留种质除样本数量多于核心种质,其余多样性指标均小于核心种质或与核心种质接近, 说明基于ISSR构建的中国橄榄核心种质基本保存了初始种质的绝大部分基因资源。
基于RAPD构建的橄榄核心种质包括‘葡萄’、‘四季橄榄3号’、‘大目埕橄榄王’、‘上湾檀香’、‘黄皮长营26号’、‘大粒黄’、‘檀头’、‘梅溪镇建新2号’、‘福榄1号’、‘池2号’、‘延平剑洲’、‘上杭三棱榄’、‘永定务田3号’、‘西滨刘坂3号’、‘云霄白榄’、‘漳浦18号’、‘漳浦7号’、‘电白二头尖榄’、‘四和1号’、‘凤湖榄’、‘合江二梭子’、‘瑞安2号’和‘瑞安5号’,其中福建17份、广东3份、四川1份、浙江2份。核心种质保留了初始种质的26.74%样本量,其多态性位点保留率为89.38%,观测等位基因、有效等位基因、Nei’s基因多样性指数和香农信息指数的保留率分别为94.70%、101.02%、101.24%和99.74%, 保留种质和核心种质的多样性指数并无明显差异但样本数量远远多于核心种质(表6)。值得注意的是,基于ISSR和RAPD构建的核心种质均保留了‘葡萄’、‘大目埕橄榄王’、‘上湾檀香’、‘福榄1号’、‘上杭三棱榄’、‘漳浦18号’、‘漳浦7号’、‘凤湖榄’、‘瑞安2号’和‘瑞安5号’,说明这些种质资源具有重要保存价值。

表6 橄榄核心种质和初始种质遗传多样性比较
: 观测等位基因数;: 有效等位基因数;: Nei基因多样性指数;: Shannon’s信息指数;: 多态性位点数;:多态性位点百分率。
: Observed number of alleles;: Effective number of alleles;: Nei’s genetic diversity index;: Shannon’s information index;: Number of polymorphism loci;: Percentage of polymorphism loci.
3 结论和讨论
3.1 中国橄榄种质资源遗传多样性存在明显的地域性差异
本研究中,基于ISSR和RAPD标记技术,绝大部分橄榄种质资源的分类结果相似度较高,说明获得的橄榄种质资源遗传结构具有较高准确性和可靠度。其中,大部分福建的橄榄种质资源聚为一
类,广东、广西和四川的样本聚为一类,浙江和少数几个其他地区的种质聚为一类。可见,中国橄榄种质资源遗传多样性的地域性差异较为明显,与所属分布区生态类型存在较大相关性。该结果与前人的研究基本一致[17]。其中,广东、广西和四川的橄榄种群遗传相似性较高,可能具有相同的起源,而整体上福建橄榄种群和浙江橄榄种群的亲缘关系较近。通常,植物的遗传多样性主要来源于遗传变异和基因交流,且受多个因素共同影响。首先由于地理位置关系,福建和浙江橄榄主栽区域的橄榄种质资源交流频繁,造成2地间的种质资源存在丰富的基因交流,再加上浙江和福建同属于中国橄榄冻害危险性区域,经过长年累月环境适应性筛选,种质资源的进化方向和遗传变异的方向较一致,2种群间又存在高频率的基因交流,因此其遗传距离更近。而广东、广西和四川橄榄种质资源亲缘关系较近,很可能这些地区之间存在相同的橄榄起源。然而,值得注意的是,部分橄榄种质资源的归属并不完全按照地域性分布,如福建‘上杭三棱榄’和福建‘云霄穗橄榄’,与广东橄榄种群的遗传距离更近, 而这两份橄榄种质资源均可能由广东引种而来。结合已有研究结果表明,基于分子标记技术能够在一定程度上对中国橄榄种质资源的同物异名现象进行校正,可作为橄榄品种鉴定的重要依据[21,27]。
3.2 中国橄榄种质资源个体间的遗传分化或变异形成了相对丰富的整体遗传多样性
种质资源遗传多样性反映的是种群之间或种群内个体间基因组成的差异,对物种的起源、进化以及开发利用研究具有重要参考价值。其中,Nei’s遗传多样性指数是种质资源遗传多样性研究的关键指标,本研究中,基于ISSR的中国橄榄种质资源整体遗传多样性水平(0.284±0.169)高于Nybom[28]报道的多种植物的平均水平(0.22~0.23),说明整体上,中国橄榄种质资源遗传多样性水平相对丰富。同时,也高于广东潮汕橄榄和粤东地区橄榄的遗传多样性水平[24]。此外,中国橄榄种质资源存在高水平的遗传多态性,可能存在高频遗传变异。而总遗传分化系数较低,说明大部分遗传分化来源于群体内部。群体间的平均遗传相似系数远高于个体间, 进一步说明个体间的遗传变异是造成其高水平遗传分化的主要原因。值得注意的是,中国橄榄种质资源总遗传多样性水平仍高于群体内遗传多样性, 说明群体间的遗传分化或变异依然存在,也是导致其遗传多样性呈现地域性差异的原因。基于ISSR和RAPD获得的基因流远远大于1.0,表明中国橄榄种质资源种群之间存在丰富的遗传信息交流[29–30]。因此,中国橄榄种质资源个体间的遗传分化或变异形成了相对丰富的遗传多样性,但群体间的遗传多样性差异依然存在,而群体间高频率的遗传信息交流导致其群体间遗传距离不断缩小。
3.3 橄榄核心种质库构建策略
核心种质是评价和利用种质资源的重要切入点,是原始种质的一个核心子集,必须同时具备代表性、多样性和异质性的特点。通过遗传相似系数或遗传距离筛除相同或相近的株系,重复聚类多次剔除构建核心种质是常用的技术手段之一[31]。本研究中,基于ISSR和RAPD构建的核心种质存在一定的差异,但均保留了‘葡萄’、‘大目埕橄榄王’、‘上湾檀香’、‘福榄1号’、‘上杭三棱榄’、‘漳浦18号’、‘漳浦7号’、‘凤湖榄’、‘瑞安2号’和‘瑞安5号’等10份橄榄种质资源,说明这些种质资源具有重要保存价值。然而,虽然橄榄核心种质的构建最大限度保留了种质的基因库,但并不意味着保留种质可以淘汰,一方面核心种质或多或少丢失了部分原始种质类型,另一方面所构建核心种质无法满足某些性状要求时依然要从保留种质中获取。此外,采用基因型数据构建的核心种质忽略了表型性状、农艺性状等方面的特征,往往不够全面,还需要结合叶[32]、花[33]、果[34]等数据精确构建核心种质。橄榄核心种质是种质资源保存和研究的重点,后续还应进一步对其开展全面的鉴定评价,并在橄榄育种中充分有效地利用。同时,应进一步加大现有资源圃的种质资源的收集保存工作,使其更加全面地覆盖中国橄榄大部分种质资源,甚至越南、泰国、柬埔寨、老挝、缅甸、菲律宾和马来西亚等世界其他分布区的橄榄种质资源。在全面收集橄榄种质资源的基础上构建更具有代表性的橄榄核心种质,为橄榄研究、育种和生产提供重要基础。
[1] CHANG Q, SU M H, CHEN Q X, et al.Physicochemical properties and antioxidant capacity of Chinese olive (L.) cultivars [J].J Food Sci, 2017, 82(6): 1369–1377.doi: 10.1111/1750-3841.13740.
[2] ZENG H L, MIAO S, ZHENG B D, et al.Molecular structural characteristics of polysaccharide fractions from(Lour.) Raeusch and their antioxidant activities [J].J Food Sci, 2015, 80(11): H2585–H2596.doi: 10.1111/1750-3841.13076.
[3] CHEN F Z, YANG L P, HUANG Y N, et al.Isocorilagin, isolated from(Lour.) Raeusch, as a potent neuraminidase inhibitor against influenza A virus [J].Biochem Biophys Res Commun, 2020, 523(1): 183–189.doi: 10.1016/j.bbrc.2019.12.043.
[4] KUO Y H, YEH Y T, PAN S Y, et al.Identification and structural elucidation of anti-inflammatory compounds from Chinese olive (L.) fruit extracts [J].Foods, 2019, 8(10): 441.doi: 10.3390/foods8100441.
[5] YEH Y T, CHIANG A N, HSIEH S C.Chinese olive (L.) fruit extract attenuates metabolic dysfunction in diabetic rats [J].Nutrients, 2017, 9(10): 1123.doi: 10.3390/nu9101123.
[6] LAI R L, CHEN J, FENG X, et al.Advances on germplasm resource evaluation and cold resistance research in Chinese olive of China [J].Chin J Trop Crop, 2017, 38(11): 2188–2194.doi: 10.3969/j.issn.1000- 2561.2017.11.031.
赖瑞联, 陈瑾, 冯新, 等.中国橄榄种质资源评价与抗寒性研究进展 [J].热带作物学报, 2017, 38(11): 2188–2194.doi: 10.3969/j.issn.1000-2561.2017.11.031.
[7] WANG M, PENG J Q, CAO J W, et al.Studies on genetic diversity of 48 wild species of magnoliaceae in Yunnan [J].J Trop Subtrop Bot, 2020, 28(3): 277–284.doi: 10.11926/jtsb.4161.
王猛, 彭继庆, 曹基武, 等.云南木兰科48种野生植物资源的遗传多样性研究 [J].热带亚热带植物学报, 2020, 28(3): 277–284.doi: 10.11926/jtsb.4161.
[8] PAN D R, ZENG H Y, CHEN G S, et al.Genetic diversity of chewing cane germplasms using RAPD and ISSR markers [J].J Trop Subtrop Bot, 2007, 15(3): 183–190.doi: 10.3969/j.issn.1005-3395.2007.03.001.
潘大仁, 曾惠阳, 陈观水, 等.RAPD和ISSR分子标记对果蔗种质资源的遗传多样性研究 [J].热带亚热带植物学报, 2007, 15(3): 183–190.doi: 10.3969/j.issn.1005-3395.2007.03.001.
[9] YANG P K, ZHUANG D H, MA R J.Establishment of ISSR system forusing orthogonally designed experiments [J].S China Fruits, 2010, 39(2): 31–33.doi: 10.13938/j.issn.1007-1431.2010.02.020.
杨培奎, 庄东红, 马瑞君.利用正交试验建立橄榄的ISSR-PCR反应体系[J].中国南方果树, 2010, 39(2): 31–33.doi: 10.13938/j.issn.1007-1431.2010.02.020.
[10] LIU T L, PAN D M, XU C T, et al.Optimization of ISSR-PCR reaction system in olive [J].Biotechnol Bull, 2010(7): 137–141.doi: 10.13560/j.cnki.biotech.bull.1985.2010.07.033.
刘天亮, 潘东明, 许长同, 等.橄榄ISSR-PCR反应体系的优化 [J].生物技术通报, 2010(7): 137–141.doi: 10.13560/j.cnki.biotech.bull.1985.2010.07.033.
[11] NIE Z S, LAI Z X, PAN D M, et al.Genomic DNA extraction and optimization of RAPD amplifying conditions ofreausch [J].Subtrop Agric Res, 2005, 1(2): 6–8.doi: 10.3969/j.issn.1673-0925.2005.02.002.
聂珍素, 赖钟雄, 潘东明, 等.橄榄基因组DNA提取及RAPD扩增条件优化 [J].亚热带农业研究, 2005, 1(2): 6–8.doi: 10.3969/j.issn.1673-0925.2005.02.002.
[12] MEI Z Q, YANG L Q, ZHANG T D, et al.Improved RAPD analysis of(Lour.) Raeusch from Sichuan Province along Yangtze Rriver in China [J].Annu Res Rev Biol, 2014, 4(1): 51–60.doi: 10.9734/ARRB/2014/5015.
[13] MEI Z L, ZHANG X Q, LIU X Y, et al.Genetic analysis ofin different areas of China by improved RAPD and ISSR [J].C R Biol, 2017, 340(11/12): 558–564.doi: 10.1016/j.crvi.2017.09.006.
[14] CHENG J L, YIN Z C, MEI Z Q, et al.Development and significance of SCAR marker QG12-5 for(Lour.) Raeusch by molecular cloning from improved RAPD amplification [J].Genet Mol Res, 2016, 15(3): 15038347.doi: 10.4238/gmr.15038347.
[15] YANG P K, ZHENG D X, MA R J, et al.Genetic diversity analysis ofL.landrances in Chaoshan area by ISSR [J].Guang- dong Agric Sci, 2013, 40(23): 129–132.doi: 10.3969/j.issn.1004-874X.2013.23.031.
杨培奎, 郑道序, 马瑞君, 等.潮汕橄榄地方品种(系)遗传多样性的ISSR分析 [J].广东农业科学, 2013, 40(23): 129–132.doi: 10.3969/j.issn.1004-874X.2013.23.031.
[16] YANG P K, ZHUANG D H, MA R J, et al.The ISSR analysis of genetic diversity ofL.germplasm resources in eastern Guangdong [J].Chin Agric Sci Bull, 2011, 27(24): 86–92.
杨培奎, 庄东红, 马瑞君, 等.粤东地区橄榄种质资源遗传多样性的ISSR分析 [J].中国农学通报, 2011, 27(24): 86–92.
[17] LIU T L.ISSR analysis of germplasm resources of FujianRaeusch [D].Fuzhou: Fujian Agriculture and Forestry University, 2010: 14–42.
刘天亮.福建省橄榄(Raeusch)种质资源的ISSR分析 [D].福州: 福建农林大学, 2010: 14–42.
[18] CHEN M X, ZHANG Q J, CHEN Q X, et al.ISSR analysis of main cultivated and fresh-eating(Lour.) Raeusch in Fuzhou City [J].Mod Agric Sci Technol, 2011(21): 129–130,133.doi: 10.3969/ j.issn.1007-5739.2011.21.078.
陈明贤, 张庆举, 陈清西, 等.福州市主栽橄榄品种与若干鲜食橄榄优株的ISSR分析 [J].现代农业科技, 2011(21): 129–130,133.doi: 10.3969/j.issn.1007-5739.2011.21.078.
[19] NIE Z S.RAPD analysis of album () genetic resources in Fujian Province [D].Fuzhou: Fujian Agriculture and Forestry University, 2005: 24–48.
聂珍素.福建橄榄(L.)资源的RAPD分析 [D].福州: 福建农林大学, 2005: 24–48.
[20] WANG Y P, CHEN Q, ZHOU Z Q, et al.Optimization of AFLP reaction system in[J].J Fruit Sci, 2012, 29(3): 505–511.doi: 10.13925/j.cnki.gsxb.2012.03.033.
王燕平, 陈勤, 周志钦, 等.橄榄基因组AFLP扩增体系的优化 [J].果树学报, 2012, 29(3): 505–511.doi: 10.13925/j.cnki.gsxb.2012.03.033.
[21] ZHOU J H, WANG Y P, CHEN Q, et al.Genetic diversity analysis with AFLP on fresh Chinese olive cultivars resources in Guangdong Province [J].Guihaia, 2014, 34(1): 4–9.doi: 10.3969/j.issn.1000-3142.2014.01.002.
周俊辉, 王燕平, 陈勤, 等.用AFLP分析广东省鲜食橄榄品种资源遗传多样性 [J].广西植物, 2014, 34(1): 4–9.doi: 10.3969/j.issn.1000-3142.2014.01.002.
[22] ODONG T L, JANSEN J, VAN EEUWIJK F A, et al.Quality of core collections for effective utilization of genetic resources: Review, discussion and interpretation [J].Theor Appl Genet, 2013, 126(2): 289– 305.doi: 10.1007/s00122-012-1971-y.
[23] YONEZAWA K, NOMURA T, MORISHIMA H.Sampling strategies for use in stratified germplasm collections [M]// HODGKIN T, BROWN A H D, VAN HINTUM T J L, et al.Core Collections of Plant Genetic Resources.Chichester, UK: John Wiley & Sons, 1995: 35–53.
[24] YANG P K, ZHUANG D H, MA R J.Studies on sampling schemes of core collection ofL.in eastern Guangdong, China [J].J Trop Subtrop Bot, 2012, 20(3): 277–284.doi: 10.3969/j.issn.1005- 3395.2012.03.011.
杨培奎, 庄东红, 马瑞君.粤东橄榄资源核心种质取样方案的研究 [J].热带亚热带植物学报, 2012, 20(3): 277–284.doi: 10.3969/j.issn.1005-3395.2012.03.011.
[25] CHEN R Q.Analysis of genetic diversity of Chinese white olive () in Fujian Province using 18S-26SrDNA-PCR-ITS [D].Fuzhou: Fujian Agriculture and Forestry University, 2005: 12–24.
陈瑞庆.福建橄榄()遗传多态性上的研究 [D].福州: 福建农林大学, 2005: 12–24.
[26] EVANNO G, REGNAUT S, GOUDET J.Detecting the number of clusters of individuals using the software STRUCTURE: A simulation study [J].Mol Ecol, 2005, 14(8): 2611–2620.doi: 10.1111/j.1365-294X.2005.02553.x.
[27] YANG P K, ZHUANG D H, MA R J.Application of ITS sequences in the identification of local variety resources of olive [J].S China Fruits, 2015, 44(2): 23–26.doi: 10.13938/j.issn.1007-1431.20140543.
杨培奎, 庄东红, 马瑞君.ITS序列在橄榄地方品种资源鉴定中的应用 [J].中国南方果树, 2015, 44(2): 23–26.doi: 10.13938/j.issn.1007-1431.20140543.
[28] NYBOM H.Comparison of different nuclear DNA markers for esti- mating intraspecific genetic diversity in plants [J].Mol Ecol, 2004, 13 (5): 1143–1155.doi: 10.1111/j.1365-294X.2004.02141.x.
[29] WRIGHT S.Evolution and the Genetics of Populations.A Treatise in Four Volumes.Volume 4.Variability within and Among Natural Popu- lations [M].Chicago, London: University of Chicago Press, 1978.
[30] IRWIN E D, BENSCH S, IRWIN J H, et al.Speciation by distance in a ring species [J].Science, 2005, 307(5708): 414–416.doi: 10.1126/ science.1105201.
[31] JANSEN J, VAN HINTUM T.Genetic distance sampling: A novel sampling method for obtaining core collections using genetic distances with an application to cultivated lettuce [J].Theor Appl Genet, 2007, 114(3): 421–428.doi: 10.1007/s00122-006-0433-9.
[32] WAN J F, WU R J, WEI X X, et al.Diversity analysis of the leaf phenotypic characters of Chinese olive germplasm resources [J].Chin J Trop Crop, 2012, 33(6): 975–980.doi: 10.3969/j.issn.1000-2561.2012.06.002.
万继锋, 吴如健, 韦晓霞, 等.橄榄种质资源叶片表型性状多样性分析 [J].热带作物学报, 2012, 33(6): 975–980.doi: 10.3969/j.issn.1000-2561.2012.06.002.
[33] WEI X X, LAI R L, CHEN J, et al.Studies on genetic diversity on inflorescence phenotypic characteristics ofgerm- plasm resource [J].J Trop Subtrop Bot, 2019, 27(1): 1–10.doi: 10.11926/jtsb.3940.
韦晓霞, 赖瑞联, 陈瑾, 等.橄榄种质资源花序表型性状遗传多样性研究 [J].热带亚热带植物学报, 2019, 27(1): 1–10.doi: 10.11926/ jtsb.3940.
[34] WU R J, WAN J F, WEI X X, et al.Fruit character diversity analysis and numerical classification of Chinese olive germplasm resources [J].J Fruit Sci, 2015, 32(5): 797–805.doi: 10.13925/j.cnki.gsxb.20150129.
吴如健, 万继锋, 韦晓霞, 等.橄榄种质资源果实表型性状多样性分析及其数量分类研究 [J].果树学报, 2015, 32(5): 797–805.doi: 10.13925/j.cnki.gsxb.20150129.
ISSR and RAPD Genetic Diversity Analysis and Core Germplasms Construction of
LAI Ruilian, CHEN Jin, FENG Xin, WEI Xiaoxia, CHEN Yiting, SHEN Chaogui, WU Rujian*
(Fruit Research Institute, Fujian Academy of Agricultural Sciences,Fuzhou 350013, China)
To reveal the genetic diversity of germplasm resources ofin China, the genetic diversity of 86 germplasms selected from the major distribution areas was studied by using ISSR and RAPD markers, and core germplasms were constructed.The results showed that 86 germplasms could be divided into 3 groups based on UPGMA genetic similarity, and 4 groups by using STRUCTURE cluster analysis, which basically conform to the regional distribution ofin China.The overall genetic diversity coefficient using ISSR and RAPD was 0.284±0.169 and 0.244±0.163, the percentage of polymorphism loci was 92.56% and 100%, the genetic differentiation coefficient was 0.127 and 0.142, the gene flow was 3.423 and 3.025, the average genetic similarity coefficient between populations was 0.930 and 0.939, and the average genetic similarity coefficient between individuals was 0.736 and 0.732.Therefore, it was suggested that the rich genetic diversity ofin China mainly caused by the genetic differentiation or variation among individuals, and there were obvious regional differences.
; Genetic diversity; Core germplasm; ISSR; RAPD
10.11926/jtsb.4437
2021-04-29
2021-06-02
福建省自然科学基金项目(2019J01110);农业农村部物种品种资源保护(热带作物)项目(151821301354052701);福建省农业种质资源创新专项([2021]53)资助
This work was supported by the Natural Science Foundation of Fujian Province (Grant No.2019J01110); the Project of Species and Varieties Protection (Tropical Crops) of Ministry of Agriculture and Rural Affairs (Grant No.151821301354052701); and the Project for Agricultural Germplasm Resources Innovation in Fujian (Grant No.[2021]53).
赖瑞联(1990~ ),男,博士研究生,研究实习员,从事果树生物技术与遗传资源研究。E-mail: lairl0618@163.com
通信作者Corresponding author.E-mail:wurujian@126.com
