禾谷镰刀菌拮抗放线菌21-3 的筛选及鉴定
2022-02-25张艳茹郎剑锋郭富超王鹏韩阳超张强
张艳茹,郎剑锋,郭富超,王鹏,韩阳超,张强
(1.河南科技学院资源与环境学院,河南 新乡 453003;2.新乡工程学院生物工程学院,河南 新乡 453700)
由禾谷镰刀菌(Fusarium graminearum)侵染引起的小麦赤霉病是小麦生产上的一种重要病害,受气候变化、耕作制度及抗病品种缺乏等多种因素的影响,该病害在我国长江中下游和黄淮麦区频繁流行,严重影响小麦的安全生产[1-2].除造成作物减产之外,禾谷镰刀菌还可产生脱氧雪腐镰刀菌烯醇(DON)、雪腐镰刀菌烯醇(NIV)及玉米赤霉烯酮(ZEN)等毒素,进而危害食品安全[3].
虽然生产上缺少抗病品种,但使用化学防治等多种措施相结合的方式也在一定程度上减少了小麦赤霉病的发生.近年来,利用微生物及其衍生物进行生物防治的措施也受到研究者的广泛关注[4-5].已有大量研究发现,芽孢杆菌属、假单胞菌属及链霉菌属的多个菌株对禾谷镰刀菌都具有很好的抑制效果.例如,解淀粉芽孢杆菌(Bacillus amyloliquefaciens)AX-3 对禾谷镰刀菌具有较强的拮抗能力,而且能够产生抗菌物质macrolactin A[6].贝莱斯芽孢杆菌(B. velezensis)ZQT-31 能够抑制禾谷镰刀菌的正常生长,并导致菌丝出现畸形[7].绿针假单胞菌(Pseudomonas chlororaphis)ZJU60 分泌的吩嗪-1- 甲酰胺可以直接影响组蛋白乙酰转移酶FgGcn5 的活性,从而抑制禾谷镰刀菌的生长与毒素合成[8].链霉菌(Streptomyces sp.)DEF09 能够有效控制小麦赤霉病的发生[9].草地链霉菌(S. pratensis)S10 对禾谷镰刀菌的菌丝生长和DON毒素都具有抑制作用[10].本研究从土壤中分离到1 株对禾谷镰刀菌具有明显拮抗作用的链霉菌21-3,通过对该菌株拮抗活性进行研究,以期为小麦赤霉病的生物防治提供理论基础.
1 材料与方法
1.1 供试材料
菌株:禾谷镰刀菌(Fusarium graminearum)、瓜类炭疽病菌(Colletorichum lagenerium)、大斑凸脐蠕孢(Exserohilum turcicum)、假禾谷镰刀菌(F. pseudograminearum)、美澳型核果褐腐菌(Monilinia fructicola)、粉红聚端孢菌(Trichothecium roseum)、灰略红链霉菌(Streptomycetaceae griseorubens)21-3均为河南科技学院资源与环境学院植物病理学实验室分离保存菌株.
PDA 培养基:马铃薯200.0 g、葡萄糖20.0 g、琼脂15.0 g、水1.0 L.
YG 培养基:葡萄糖10.0 g、酵母提取物10.0 g、琼脂15.0 g、水1.0 L、pH 值为7.0.
高氏1 号培养基:可溶性淀粉20.0 g、K2HPO40.5 g、NaCl 0.5 g、MgSO4·7H2O 0.5 g、KNO31.0 g、FeSO4·7H2O 0.01 g、琼脂15.0 g、水1.0 L.
KMB 培养基:蛋白胨20.0 g、甘油10.0 g、K2HPO41.5 g、MgSO4·7H2O 1.5 g、水1.0 L、pH 值为7.2.
发酵培养基:葡萄糖25 g、蛋白胨25.0 g、酵母提取物5.0 g、MgSO4·7H2O 2.0 g、K2HPO4·3H2O 2.0 g、KH2PO42.0 g、CaCO35.0 g、水1.0 L、pH 值为7.2.
1.2 拮抗放线菌的分离筛选
土壤样本于2021 年1 月采集于河南科技学院东区试验田小麦根际土壤,并在河南科技学院资源与环境学院植物病理学实验室进行后续试验.土壤样本用无菌水进行梯度稀释,将不同梯度稀释液涂布于含有质量浓度为50 mg/mL 的重铬酸钾的高氏1 号培养基表面,28 ℃条件下培养7 d 后,挑取不同单菌落进行划线纯化.
1.3 菌株21-3 的分类鉴定
1.3.1 形态及生理生化鉴定 具体方法参照《放线菌快速鉴定与系统分类》[11]进行.
1.3.2 分子生物学鉴定 利用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACC TTGTTACGACTT-3′)对菌株21-3 的16S rDNA 序列进行PCR 扩增.扩增产物由生工生物工程(上海)股份有限公司进行纯化测序.获得序列后,在GenBank 数据库比对并下载相关菌株的16S rDNA 序列.采用ClustalX 1.83 软件进行比对分析后,用Mega 7.0 软件采用邻接法构建系统发育树.
1.4 菌株21-3 无菌发酵液的获得
菌株21-3 在高氏1 号培养基上生长7 d 后,用打孔器获取2 个1 cm 大小的菌饼,分别接种在50 mL PDB 等不同培养基中,28 ℃、180 r/min 培养5 d.将发酵液12000 r/min 离心20 min 后,收集上清液并用0.22 μm 微孔滤膜过滤,进而获得无菌发酵液.
1.5 菌株21-3 无菌发酵液对禾谷镰刀菌的抑制作用
采用含毒介质法,将不同培养基培养获得的无菌发酵液与加热融化后并冷却到50 ℃左右的PDA 培养基进行混合,分别按照体积比为1%、2%、4%及10%配制成含有不同梯度无菌发酵液的培养基.待培养基凝固后,在平板中心接入0.5 cm 大小禾谷镰刀菌菌饼,以不加无菌发酵液的PDA 培养基为对照,25℃下培养3 d 后计算抑菌率.每个处理重复3 次.

1.6 菌株21-3 对不同植物病原真菌的拮抗作用
采用皿内对峙法,用灭菌牙签挑取待测放线菌菌体于PDA 平板四点(距平板中心25 mm 处),先在25 ℃下培养2 d,之后在平板中央接入0.5 cm 大小的不同植物病原真菌菌饼,25 ℃下培养5 d 后测量抑菌带宽度(沿放线菌菌落与平板中心方向,放线菌菌落边缘至真菌菌落边缘的距离).
2 结果与分析
2.1 菌株21-3 对禾谷镰刀菌的抑制作用
菌株21-3 对禾谷镰刀菌的抑制作用如图1 所示.

图1 菌株21-3 对禾谷镰刀菌的抑制作用Fig.1 Strain 21-3 against F. graminearum on PDA plate
由图1 皿内对峙结果可知,菌株21-3 的存在对禾谷镰刀菌的菌落生长具有显著的抑制作用.经计算,该菌株对禾谷镰刀菌的抑菌率为69.9%±1.3%.从而说明菌株21-3 对禾谷镰刀菌具有较好的拮抗能力.
2.2 菌株21-3 的鉴定
2.2.1 形态特征及生理生化特征鉴定 菌株21-3 在高氏1 号培养基上的形态特征如图2 所示.

图2 菌株21-3 在高氏1 号培养基上的形态特征Fig.2 Morphological characteristics of the strain 21-3 on the Gause’s synthetic agar medium
由图2 可知,在形态特征方面,菌株21-3 在高氏1 号培养基上生长7 d 后的菌落较小,边缘整齐,气生菌丝白色,基内菌丝黄色.显微观察发现,该菌株菌丝无隔膜,分支状,孢丝螺旋状排列.
菌株21-3 的生理生化特征见表1.

表1 菌株21-3 的生理生化特征Tab.1 Physio-biochemical characteristics of strain 21-3
由表1 菌株21-3 的生理生化特征可以看出,菌株21-3 能够利用葡萄糖、蔗糖、甘露醇;不能利用果糖、麦芽糖、阿拉伯糖,能够水解淀粉、利用纤维素;不能使明胶液化、牛奶凝固,不产生黑色素和硫化氢.
根据以上特征,可初步将菌株21-3 鉴定为链霉菌.
2.2.2 分子鉴定 将菌株21-3 的16SrDNA 序列于GenBank 数据库进行比对后,选择相关菌株的16SrDNA序列,并采用邻接法构建系统发育树.基于16S rDNA 序列采用邻接法构建的系统发育树如图3 所示.

图3 基于16S rDNA 序列采用邻接法构建的系统发育树Fig. 3 Phylogenetic tree based on 16S rDNA sequences
由图3 可知,菌株21-3 与S.griseoflavusLMG 19344,以及S. griseorubens WZ903、BCCO 10_1270聚在一起,处于一个分支.结合形态学特征以及生理生化特征,最终将菌株21-3 鉴定为灰略红链霉菌.
2.3 菌株21-3 无菌发酵液对禾谷镰刀菌的抑制作用
为验证菌株21-3 无菌发酵液对禾谷镰刀菌的抑菌作用,并筛选出适合的培养基种类.分别利用4 种不同培养基对菌株21-3 进行发酵培养,并获得相应的无菌发酵液.不同培养基获得的菌株21-3 无菌发酵液对禾谷镰刀菌的抑菌率如图4 所示.
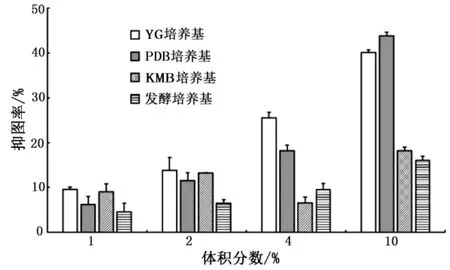
图4 不同培养基获得的菌株21-3 无菌发酵液对禾谷镰刀菌的抑菌率Fig.4 Inhibition rate of strain 21-3 culture filtrate in different medium against F. graminearum
由图4 可知,不同无菌发酵液对禾谷镰刀菌的菌落生长都具有一定的抑制作用,但抑菌能力各不相同.在体积分数为10%时,YG 培养基和PDB 培养基获得的无菌发酵液的抑菌作用最强,抑菌率都在40%以上.KMB 培养基与发酵培养基获得的无菌发酵液的抑菌率相对较低.随着发酵液浓度降低,抑菌率也逐渐下降.当体积分数为1%时,4 种培养基获得的无菌发酵液的抑菌率都低于10%.由此说明,菌株21-3无菌发酵液中存在能够抑制禾谷镰刀菌菌落生长的代谢物质, 并且不同培养条件下产生的抑菌物质组分或活性存在差异.
2.4 菌株21-3 对不同植物病原真菌的拮抗作用
采用皿内对峙的方式验证菌株21-3 对禾谷镰刀菌以外的其他植物病原真菌的抑制作用结果见表2.

表2 菌株21-3 对不同植物病原真菌的拮抗作用Tab.2 Strain 21-3 against pathogenic fungi on PDA plate
由表2 可以看出,菌株21-3 对桃褐腐病原美澳型核果褐腐菌的抑制作用最强,抑菌带宽为9 mm 左右.西瓜炭疽病病原瓜类炭疽病菌,抑菌带为8 mm 左右.对玉米大斑病病原大斑凸脐蠕孢菌和小麦茎基腐病病原假禾谷镰刀菌的抑菌带都为6 mm 左右. 而对苹果霉心病病原粉红聚端孢菌的抑制能力最低,抑菌带为4.8±0.5 mm.以上结果说明,菌株21-3 具有一定的抑菌谱.
3 结论与讨论
链霉菌产生的抗生素可以抑制多种病原菌的生长,从而可以用于植物病害的生物防治[5].本研究从小麦根际土壤中分离到一株链霉菌21-3,该菌株对禾谷镰刀菌具有较强的抑制作用.通过形态学特征、生理生化反应及16S rDNA 序列分析,将菌株21-3 鉴定为灰略红链霉菌.菌株21-3 在4 种不同的培养基中培养后,所获得的无菌发酵液都可以抑制禾谷镰刀菌的菌落生长,但是抑菌效果存在差异.此外,菌株21-3 对瓜类炭疽病菌等5 种植物病原真菌表现出拮抗作用,从而说明该菌株具有防治多种植物病害的潜力.
研究表明,灰略红链霉菌具有木质素降解的能力,从而有利于促进堆肥腐熟[12-13].在抑菌作用方面,灰略红链霉菌对大肠杆菌、金黄色葡萄球菌、白色念珠菌等多种病原菌具有抑菌活性[14-17].此外,灰略红链霉菌对于一些植物病原真菌也具有较强的抑制效果,如立枯丝核菌[18]、大丽轮枝菌[19]、尖孢镰刀菌[20]等.本研究发现灰略红链霉菌21-3 对禾谷镰刀菌等多种植物病原真菌具有明显的抑菌能力,但该菌株对小麦赤霉病的防病效果还需后续试验研究.
朱本伟等[14]发现灰略红链霉菌M506 在不同培养基中获得的粗提物对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和苏云金芽孢杆菌均具有不同的抑制活性,由此推测该菌株在不同条件下产生的次级代谢物组分和活性均有不同.与此类似,本研究中的菌株21-3 在不同培养基中培养后,无菌发酵液所产生的抑菌作用也各有差异.在对灰略红链霉菌抑菌机制方面的研究发现,菌株E44G 可以产生蛋白酶、几丁质酶,进而对立枯丝核菌和尖孢镰刀菌起到抑制作用[18,20].菌株TRM11107 能够产生拒霉素和特曲霉素,从而实现对白色念珠菌和金黄色葡萄球菌的抗菌能力[17].所以,对菌株21-3 发酵条件、抑菌机理还需进一步研究.
