创伤性异位骨化的发病机制及诊疗进展
2022-02-25占新华综述牛云飞审校
曾 恒,占新华 综述 牛云飞 审校
创伤性异位骨化(traumatic heterotopic ossification,THO)是指创伤后在非骨骼组织(肌肉、肌腱及其他软组织)内形成病理性骨组织,常发生于关节置换术后,髋关节置换术后发病率高达约30%。THO大部分没有明显的临床症状,少部分患者会引起局部肿胀、疼痛,关节活动受限,严重影响患者生活。THO的发生机制尚不完全清楚,在治疗上也存在很大争议,本文主要就THO的发病机制及诊疗进展进行综述。
1 发病机制
目前,对THO发病机制的认识尚不完全清楚,多数学者认为THO的形成须具备3个条件;成骨的前体细胞、成骨诱导物及其信号传导通路、局部微环境。局部组织在长期慢性炎性刺激以及静脉瘀滞的条件下,正常骨组织细胞向周围软组织释放多种成骨诱导因子,原始的间充质干细胞(msenchymal stem cells,MSCs)及其他细胞在成骨诱导因子的刺激下分化为成骨细胞,从而形成成熟板层状新生骨。Foley等依据组织学变化将THO分为六个阶段;(1)血管周围淋巴细胞浸润;(2)淋巴细胞迁移到软组织;(3)反应性纤维增生;(4)新生血管的形成;(5)软骨形成;(6)软骨内骨化。
1.1 成骨前体细胞 THO过程需要能分化为成骨或软骨的前体细胞,近年来,细胞谱系示踪技术及细胞植入技术的应用为稳定追踪细胞群及评估细胞成骨能力提供了有效途径。目前MSCs、内皮细胞、成纤维/成脂肪祖细胞、肌卫星细胞、肌腱/肌腱祖细胞等在THO过程中扮演的角色得到了越来越多的认识。软组织遭受创伤刺激后,细胞受损且在组织缺氧的微环境作用下,淋巴细胞、巨噬细胞等炎性细胞被募集至结缔组织周围,激发受损组织释放骨生成诱导因子。MSCs被认为是参与形成THO的主要细胞群,未定向MSCs在成骨诱导因子刺激下改变了原始的分化方向,继而转向分化为软骨细胞及骨细胞。Lounev等利用Cre-loxP细胞谱系示踪技术,发现内皮细胞标记物(Tie2阳性)在骨形成蛋白-2/4在成骨的各个阶段均存在。这为可能参与成骨提供了证据。Medici等发现,THO的软骨及成骨组织具有内皮起源特性,血管内皮细胞通过上皮-间质转换从而产生MSCs,进而在局部炎性反应及组织缺氧微环境下MSCs分化为成骨细胞。此外动物模型实验证明造血干细胞也具备有分化为成骨细胞的潜能,因此也可能是引起THO的前体细胞之一。
1.2 成骨诱导因子及信号传导通路 THO的病理过程大致可以分为两个步骤;(1)结缔组织产生炎性反应和破坏;(2)成骨和软骨的形成。异位骨化过程中存在许多重要信号传导通路,目前报道参与这一过程的主要分子有骨形成发生蛋白(bone morphogenetic proteins,BMP)、缺氧诱导因子1-α(hypoxia inducible factor1-α,HIF1-α)、转化生长因子-β(transforming growth factor-β,TGF-β)、维甲酸受体 (retinoic acid receptor,RAR )、炎性因子、骨硬化蛋白等。BMP是转化生长因子家族超成员信号调节蛋白,广泛参与细胞调节活动,BMP能使Smad(1、5、8)蛋白磷酸化,磷酸化后的Smad(1、5、8)蛋白在细胞核内与Smad4结合形成复合物诱导前体细胞转化为骨组织,BMP在整个THO过程中起着非常关键的作用。Yoshida等发现,Tob蛋白是BMP-Smad信号通路的负性调节剂,Tob蛋白与Smad(1、5、8)受体结合,通过抑制Smad蛋白调节受体的活性而负向调节成骨细胞的增殖和分化,这也表明了BMP-Smad信号通路的重要性。
1.3 局部组织微环境 组织微环境的改变也是THO的重要影响因素,创伤后局部血管破坏造成缺氧环境,这些改变了HIF-1α的稳定性,并由此产生血管内皮生长因子、碱性成纤维细胞生长因子、血小板衍生的生长因子和血管生成素-2等多种血管生成因子,从而使血管内皮细胞运动、聚集和增殖,因而THO的形成机制可能是由于微环境缺氧条件下,局部炎性反应导致组织释放成骨诱导因子诱导成骨前体细胞形成异位骨化。炎性因子与THO的形成有着紧密联系,组织损伤后引发炎性因子释放从而诱导局部发生炎性反应,致使BMP、TGF-β等成骨诱导因子水平增高,进而诱导成骨前体细胞分化及血管生成,活化的TGF-β可招募MSCs等成骨前体细胞参与局部THO的形成。
2 诊 断
大多数THO无明显临床症状,部分表现为创伤后关节活动受限,极少数THO可引起疼痛、局部肿胀及关节僵硬等症状,严重影响患者生活质量。
2.1 影像学检查 目前临床上对于THO的诊断主要依靠影像学检查,X线是应用最广泛、最经济有效的检查手段,但早期异位骨化没有明确的骨小梁形成,仅显示为模糊的钙化灶区域,因此在骨化初期X线不能观察到THO 的形成。CT可以显示THO的位置和形态,在发现微小骨化病灶上优于X线,检出率也显著高于X线,但CT诊断出THO时成熟板层骨已形成,因此对于早期诊断意义不大。MRI对软组织有较强的分辨率,在MRI图像上可观察到早期异位骨化,表现为 T加权相上局灶性等低信号,在T加权相上表现为低信号灶及周围水肿区域的高信号,但MRI对骨组织的显影不及X线和CT,早期不成熟的HO往往与血肿、肿块或感染灶相类似,联合MRI和CT表现可以更有利于明确诊断。
2.2 核医学检查 THO的诊断常常滞后于临床表现,三相核素骨扫描是检测异位骨化最敏感的检测方法,最早可在损伤后2周内显示,可以监测异位骨组织的骨代谢活动,甚至通过定量监测示踪剂摄取率来判断骨组织成熟度和成骨活跃性,以此来选择最佳手术时机。单光子发射计算机断层扫描/CT对异位骨化的检测也是十分敏感的,能够提供更为精准的定位及病变性质,然而由于核医学检查价格昂贵,且需要注射放射性药物,因此限制了其在临床上的使用。Hastings和Graham根据临床和影像学表现,将肘关节异位骨化分为3级(表1)。

表1 创伤性异位骨化Hastings和Graham分级
2.3 超声检查 超声对局部软组织损伤和钙化比较敏感,能很好地将THO与血肿、血栓等区分,早期未成熟的THO可表现为周围软组织肿胀,病变区域可出现不连续、边界不清的混合高、低混合回声,典型表现为云状改变,贺倩倩等利用小鼠模型描述了THO不同发展阶段的声像特征,验证了彩色多普勒超声可以早期诊断THO,而且可以连续观察异位骨组织的成熟过程。超声具有便携方便、价格低廉、检查方式简单的优势,给早期诊断及评价异位骨化提供了良好的检查方法。
2.4 实验室检验 目前尚未发现有效的证据支持实验室检验可以作为诊断的指标,但具有提示作用,组织损伤期间血清碱性磷酸盐水平显著升高,因此其在预测THO上的作用价值一直被研究者们怀疑,然而目前尚无研究显示出有效的证据支持。赵航和肖海军发现,骨硬化蛋白低于179.49 ng/L,BMP-4高于273.69 ng/L时提示异位骨化形成的风险极高,骨硬化蛋白和BMP-4对THO的诊断提示有着较高的特异度和敏感度。
3 预防与治疗
THO的治疗方式大体可以分为预防性治疗和手术切除,非甾体抗炎药和放射性治疗是目前应用最广、最有效的预防,常用药物包括吲哚美辛、布洛芬及双氯芬酸钠等。手术切除是唯一根治性治疗方式。
3.1 药物治疗
3.1.1 非甾体抗炎药 非甾体类抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)是目前最常用的预防性治疗药物,其机制是抑制环氧化酶阻止前列腺素合成从而减轻全身及局部炎性反应,继而抑制炎性细胞分泌成骨诱导因子。口服NSAIDs可以预防THO的发生,但同时也会引起各种胃肠道不良反应,如胃溃疡、胃穿孔等的发生增加。吲哚美辛在体外可以抑制成骨细胞的活性,同时不对伤口愈合产生负面影响,因此体外局部运用NSAIDs可能是预防THO的最佳方法,同时避免了各种胃肠道不良反应。Zhu等经Mate分析发现选择性和非选择性非甾体抗炎药对预防全髋关节置换术并发THO具有相同的效果。Migliorini等通过贝叶斯网络荟萃分析随机临床试验(RCTs)比较了所有可用的NSAIDs预防全髋关节置换术后THO的发生,26项研究6396例病例被纳入,涉及的药物有双氯芬酸钠、萘普生、塞来昔布等,其结果表明塞来昔布预防效果最好。作者对近年来所报道取得良好预防效果常用NSAIDs剂量及疗程列举如表2。
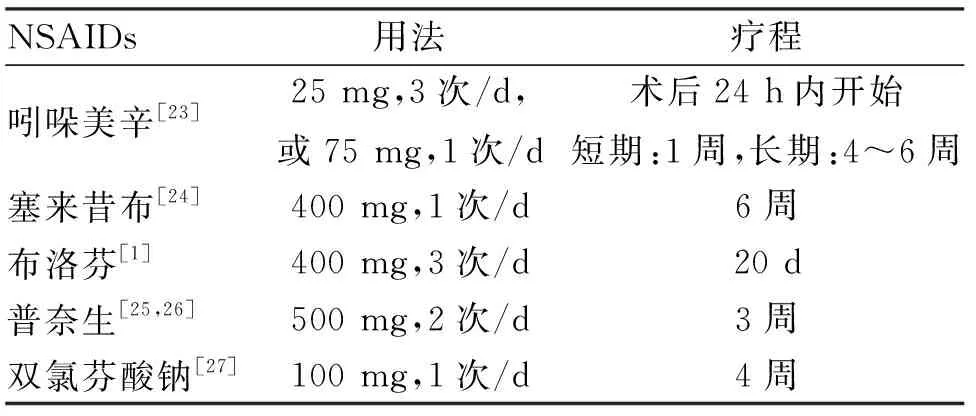
表2 创伤性异位骨化常用NSAIDs剂量及疗程
3.1.2 其他药物 四磷酸盐的作用机制是抑制非晶形磷酸钙转化成磷酸钙,从而减慢骨矿化过程,但不能阻止骨基质形成,即仅能延迟而不能阻止THO的骨化过程,因而停药后容易复发。成骨分化是一个高度依赖ATP的过程,AMP激活蛋白激酶(AMPK)是一种细胞内的能量稳态传感器,AMPK在能量不足时被激活,能量过剩时则被抑制。Lin等发现,二甲双胍可抑制BMP6诱导的成骨细胞Smad1/5磷酸化,同时上调Smad6的表达及激活AMPK,预防THO的产生。
3.2 放射性治疗 THO形成过程中,周围软组织中MSCs首先转化为骨祖细胞,骨祖细胞增殖并分化为骨和软骨细胞,利用骨祖细胞的放射敏感性,低剂量辐射作用可以预防THO的发生。放射性治疗是对高危患者有效的预防性治疗手段,但射线具有致癌作用,因此放疗预防THO存在一定风险。Cai等对选择性NSAIDs、非选择性NSAIDs及放疗对全髋关节置换术(THA)后预防THO的疗效进行Mate分析,发现放疗是预防全髋关节置换术后THO总体(Brooker Ⅳ、Ⅰ、Ⅱ和Ⅲ级)发生率降低最有效的治疗方式。Morcos等发现,对于THA后未接受预防性治疗已经发展为THO的患者,低剂量放疗也能有效防止THO进一步发展。目前推荐创伤后72 h内行单次7~8 Gy剂量单次局部放疗方案,该放射剂量也可以有效预防THO的进展,特别是高危患者首选7 Gy的单一剂量,也有报道称放射剂量20~24 Gy预防效果最佳,多次照射预防比单次效果好,术前照射也能取得有效预防。
3.3 小分子生物制剂 THO是在一定微环境和调控因子作用下,由一系列成骨前体细胞分化为骨细胞的病理过程。该过程受到诸多信号分子调控,通过受体激动剂或抑制剂靶向调控信号通路实现预防和治疗THO是近年来的研究热点。BMP-Smad信号转导通路受体拮抗剂能降低BMP,减少骨基质的产生,从而抑制THO。基于这一原理,Strong等在高能量爆炸致伤大鼠模型上研究ALK3-Fc(BMP配体-陷阱)在软组织内抑制间充质祖细胞早期和晚期成骨分化的作用,发现ALK3-Fc抑制了炎性反应相关基因表达,用ALK3-Fc处理的大鼠模型间充质祖细胞成骨分化显著减少,这就说明ALK3-Fc能预防THO的发生。维甲酸受体(retinoic acid receptor,RAR)是软骨形成的抑制性受体,以三种亚型(RARα、RARβ和RARγ)存在,维生素A能非选择性激动RAR而抑制软骨的形成。Shimono等研究证实三种受体亚型中RARγ起主要作用,RARγ通过降低Smad 1/5/8蛋白磷酸化并致使其在蛋白酶体中被破坏从而减少BMP的信号传导,继而减少MSCs分化成具有成骨潜能的细胞。另一种针对BMP-Smad信号通路预防THO的策略是降低ATP或ADP形式中可用磷酸水平,减少局部可利用能量,如局部应用腺苷三磷酸双磷酸酶水解ATP和ADP以抑制THO的发生。Mao等利用小鼠模型发现苦参碱抑制TGF-β诱导的Smad2/3磷酸化从而降低了THO的发生率。然而,针对信号转导通路的预防治疗研究基本处于动物模型阶段,尚未开展临床试验。
3.4 基因治疗 Runx2基因表达是MSCs向成骨细胞谱系表达的必需条件,成骨细胞的早期分化主要受Runx2的表达调控,如果成骨细胞中缺失Runx2基因,其早期分化将完全被抑制。Tu等发现,miR-203通过作用于靶标Runx2在体内具有抑制异位骨化的作用。Mishra等将siRNA包埋并递送至多功能细胞C2C12中,siRNA沉默Runx2的表达,从而抑制了THO的形成。
3.5 手术治疗 当THO患者具有显著临床症状,影响患者关节功能活动时,应当采取手术切除。手术治疗是THO最直接最有效的治疗方式,可以部分甚至完全恢复受累关节的功能,但仅限于成熟THO,对于手术时机存在较多争议,多数研究建议在术后6~8个月切除,有专家认为,尽早切除THO是安全有效的,而且能预防复发,实现更好地功能恢复,术前等待的时间越长导致的残疾就会越严重。然而,手术治疗THO花费较高,且容易反复。Cole等记录并回顾性分析14年髋关节术后THO切除患者原发伤、THO的危险因素以及术后THO的切除时间等,其结果表明早期手术切除THO可有效减少复发。然而并非所有的异位骨化都适用于手术切除,原发性异位骨化禁止采用使用手术治疗,否则将会加重病情,甚至造成关节永久性功能活动丧失。
3.6 中医药治疗 中医学认为,THO多为组织损伤或术后致使筋脉损伤从而气滞血瘀、经脉痹阻或致血溢脉外,卫外不固,风寒湿邪乘虚而入,筋骨痹阻。治法当以补气活血、化瘀止痛、软坚散结为主。临床上可选择中药内服、中药熏洗、小针刀松解等预防THO。张慧法等使用活血止痛汤[当归12 g, 川芎5 g, 赤芍6 g, 桃仁6 g, 大黄10 g, 丹皮6 g, 枳壳6 g, 地鳖虫15 g, 乳香6 g, 没药6 g, 三七粉3 g(冲服),陈皮6 g, 泽兰泻各10 g,玄胡10 g]活血通络、行瘀止痛、利水消肿,每日1剂, 2~3次口服, 连服15 d,其在预防HO发生率方面与布洛芬效果相当,最重要的是活血止痛汤胃肠道不良反应发生率显著低于布洛芬。杨文雪等从分子水平证实中药补肾舒脊颗粒能显著降低BMP-7,同时正向调节骨硬化蛋白水平,有效控制组织中的炎性因子水平,补肾舒脊颗粒对骨化因子的改善效果甚至优于塞来昔布。
综上所述,THO是常见的骨科疾病,特别是关节置换术后多发,目前THO的确诊主要依靠影像学检查,口服NSAIDs及放疗可以实现有效预防,对于成熟THO,手术切除是唯一有效治疗方式,但存在较高复发风险;有研究报道小剂量单次照射(6~7 Gy)联合口服吲哚美辛(25 mg tid 疗程,6周)可以实现良好的复发预防效果,切除术后复发率仅为1.3%。目前临床上暂无统一的预防和治疗方案,几种常见的预防与治疗方式各有优缺点。
