高中化学键与分子间作用力习题教学探析
2022-02-25童韬
童韬



摘 要:化学键与分子间作用力是高中化学的重要知识点,为使学生深入理解,牢固掌握化学键及分子间作用力知识,并灵活应用于解题中,教师应结合学生实际,做好相关习题的汇总,组织学生开展习题教学活动,为学生认真剖析不同习题类型的解题思路,使其更好地把握不同化学键以及分子间作用力的规律,指引其更好地解题。文章结合相关习题,对高中化学键与分子间作用力习题教学进行探析。
关键词: 高中化学;化学键;习题教学;探析;剖析;规律;解题思路
中图分类号:G633.8 文献标志码:A 文章编号:1008-3561(2022)09-0089-03
化学键以及分子间作用力均是物质微粒间的相互作用,其中化学键的作用强于分子间作用力。化学键分为离子键、共价键、配位键、金属键等,分子间作用力包括范德华力、氢键。为使学生掌握不同化学键与分子间作用力的特点,并灵活应用于解题中,教師应积极开展习题教学,并对习题教学进行探究,以提高学生解题能力。
一、做好习题筛选,保证习题质量
在化学键与分子间作用力解题过程中,学生仅仅掌握相关的概念是不行的,还应注重通过相关习题的练习,锻炼分析问题的灵活性。为保证授课质量,教师应积极查阅相关资料做好习题筛选。授课中应做好近年来各省份高考、模拟习题的汇总,明确各习题考查的知识点,做好经典习题的优选,使学生通过思考,解答习题,巩固所学知识,更好地理解化学键与分子间作用力本质,积累相关的解题经验,做到举一反三。
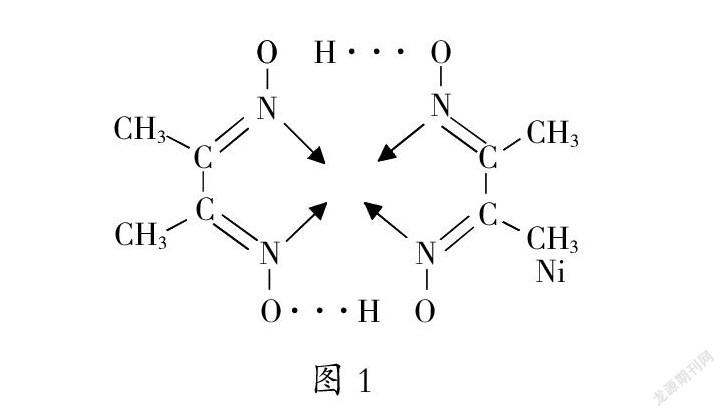
图1为某物质的结构示意图,则以下有关该物质的判断正确的是( )
A.该物质为离子化合物 B.该物质分子中只含有共价键、配位键两种作用力 C.该物质是一种配合物,其中Ni为中心原子 D.该物质中C、N、O原子均有弧对电子
该习题考查学生对物质结构中化学键的认识与理解深度,具有一定代表性。学生要想正确作答,就要熟练掌握离子化合物、共价键、配位键、弧对电子等概念,并结合该物质的结构示意图进行分析。
观察该物质结构示意图可知,其有分子构成,为共价化合物;该物质分子中含有氢键、配位键、共价键三种作用力;该物质中Ni原子提供空轨道,配位数是4,配位原子是N原子,N原子提供弧对电子;物质分子中C原子4个价电子均形成共价键,无弧对电子,而N、O上均有弧对电子。综上,只有C项说法正确。
二、注重习题剖析,深化学生理解
高中化学键与分子间作用力涵盖的知识点较多,习题情境灵活多变,难度存在一定差别。为避免学生在解题中走弯路,迅速找到正确的解题切入点,提高学生自信,使其深刻理解所学,并掌握分析问题的相关思路、技巧,教师应注重与学生一起剖析习题。在作答习题之前,教师要先认真分析习题考查的知识点,引导学生积极回顾所学,与学生一起寻找解题思路,把握解题细节。同时,要鼓励学生做好听课的总结与反思,及时发现与弥补学习中的不足。教学中,教师可与学生一起分析如下习题。
三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O常用于制备铁触媒。该配合物在光照条件下发生如下反应:K3[Fe(C2O4)3]·3H2O3K2C2O4+2FeC2O4+2CO2↑+ 6H2O,则以下说法不正确的是( )
A.K3[Fe(C2O4)3]中铁离子的配位数为6 B.C2O42-中C原子的杂化方式为sp2 C.CO2分子中σ键和π键数目之比为1:1 D.Fe3+的最高能层电子排布为3d5
该习题考查原子核外电子能级分布、杂化类型、化学键等知识,解答的关键在于掌握配位数的计算方法、杂化方式的判断思路等。课堂上,教师可与学生一起回顾对应的知识点,激活学生思维。根据题意每个配体中C2O42-中两个单间O向Fe3+配位,因此,K3[Fe(C2O4)3]中共有6个O向Fe3+配位;根据C2O42-的结构式可知C原子有3对电子对,杂化方式为sp2;CO2分子中含有键和键的数目均为两个;Fe3+的电子排布式为1s22s22p63s23p63d5,M层为最高能层,电子排布为3s23p63d5。综上,只有D项错误。
三、创设习题情境,加强习题训练
在化学键与分子间作用力习题教学中,为使学生能够当堂掌握所学,教师应 “趁热打铁”,围绕课堂上讲解的知识,创设代表性的习题情境,给学生预留时间,要求学生独立思考,尝试解答,在加深学生印象的同时,锻炼学生学以致用的能力。教师通过习题训练,能暴露出学生学习中的问题,使其及时回归课本,翻阅课堂笔记,找到知识漏洞以及薄弱点,通过复习夯实知识基础。例如,在讲解氢键知识后,教师可创设如下习题情境,要求学生进行解答。
冬天结冰的河面非常光滑。事实上,“冰面滑”和冰层表面结构(如图2所示)有着密切联系,以下判断不正确的是( )
A.第一层固态冰中,水分子间通过氢键形成空间网状结构
B.因氢键的存在,水分子具有较好的稳定性,高温下难分解
C.第二层“准液体”中水分子间形成氢键的机会少于固态冰
D.达到一定温度,“准液体”的水分子和下层冰连接的氢键断裂,使冰面变滑
习题考查学生对氢键及其作用的认知。习题创设的情境较为新颖,要求学生具备较强的知识迁移能力。该习题的训练能使学生认识到在学习过程中既要夯实基础,又要把握相关知识本质,还要灵活迁移所学知识。
A项,由图可知第一层固态冰中1个水分子和周围4个水分子通过氢键形成空间网状结构,正确;B项,在水分子中氢键主要影响水的熔沸点、溶解度,共价键影响水分子的稳定性,错误。C项,“准液体”中水分子距离不完全相等,1个水分子与少于4个的水分子形成氢键,正确;D项,得到一定温度,“准液体”的水分子和下层冰连接的氢键断裂,使得一部分水分子能够自由流动,冰面变滑。
四、注重训练互动,激发思考热情
化学键与分子间作用力习题教学应避免满堂灌式的教学,关注学生的学习体验以及听课满意度,通过设计相关问题与学生积极互动,激发学生的思考热情,营造良好的课堂氛围。为此,教师要通过互动避免学生产生枯燥感,进一步澄清学生认知,纠正其理解上的误区,指引学生向着正确的方向思考,使其顺利得出正确答案,并掌握分析习题的思路与方法。例如,课堂上,教师可围绕以下习题与学生互动。
将C60上的化学键切断,打开一扇门,可引入一个小分子A,而后将C60闭合,可制备A@C60,A可为HF、H2O、H2等,如图3所示,@表示小分子A被封闭在C60内,与外界隔绝,则以下判断错误的是( )
A.HF@C60能被H2加成 B.H2O@C60为分子晶体C.HF@C60可与NaOH溶液发生中和反应 D.H2@C60中氢原子与碳原子间存在分子间作用力
习题以C60为背景考查学生对C60结构以及分子间作用力的理解深度。解答该题需要充分吃透题意,理解C60与其封闭分子之间的关系,尤其注重从题干中找到推理的依据。为活跃气氛,引发学生主动思考,教师可设计如下问题与学生互动。C60中是否存在不饱和键?教材是怎样定义分子晶体的?你是怎样理解题干中“与外界隔绝”的?分子作用力只存在分子之间吗?学生认真思考,积极讨论,正确回答出上述问题,就不难得出正确答案。结合C60的结构图可知其存在碳碳双键,因此可以与H2发生加成反应。H2O@C60由分子构成,其属于分子晶体。HF@C60中的HF被封闭且与外界隔绝,无法和NaOH接触,不能发生中和反应。H2@C60中C60分子、和H2分子以分子间作用力结合。
五、鼓励解题总结,提升解题能力
化学键与分子间作用力习题教学应注重鼓励学生养成良好的做题习惯,即不能得出正确答案后,便将习题抛之脑后,而应注重解题总结,指引其以后更加高效地解答类似习题。通过总结搞清楚化学键与分子间作用力相关知识点,通过将相关知识点加以整合,构建系统的知识网络。在总结过程中,学生间要交流解题心得、解题经验,共同提升解题能力。例如,教师可要求学生解答以下习题,并进行做题后的总结。
硒(Se)是一种非金属元素,在工业生产中有着广泛的应用。结合所学回答如下问题:(1)Se元素基态原子的电子排布式为 ;第四周期中,第一电离能比Se元素大的共有 种(氪元素除外)。(2)SeO3气态分子的价层电子对互斥的模型为 ;SeO42-离子中Se原子的杂化方式为 。(3)固态SeO2是以[SeO3]角锥体以角相连接的展平的聚合结构,每一锥体带有一个悬垂的终端氧原子,如图4所示,则图中Se-O键键长较短的是 (填“a”或“b”),原因是 ;SeO2熔点为350℃,固态SeO2属于 晶体,其熔点远高于SO2(-75.5℃)的原因为 。
该题考查的知识点较多,较为综合,对学生分析问题的能力要求较高。完成该习题的解答后,学生要结合自身实际,总结做错的问题,分析出错原因,及时查漏补缺,尤其做好解题思路、解题技巧的归纳。
问题(1)Se和O处在同一主族,位于第四周期,元素序号为34,基态原子的电子排布式为[Ar]3d104s24p4,在相同的周期中第一电离能从左向右逐渐增大,在第四周期中第一电离能比Se元素大的有As和Br。问题(2)SeO3气态分子中σ键的电子对数为3,弧电子对数为1/2×(6-2×3)=0,因此,分子构型为平面三角形。SeO42-離子中σ键的电子对数为4,弧电子对数为1/2×(6+2-2×4)=0,价层电子对数为4,杂化方式为sp3。问题(3)中由O原子成键特点可知,a为单键,b为双键,因此b键长较短,原因是b中存在π键,电子云重叠程度更大。因SeO3的熔点并不是特别高,可知其为分子晶体。SeO2相对分子量较SO2大,因此,熔化时破坏分子间作用力更大,熔点也就高于SO2。
总之,在高中化学键与分子间作用力习题教学中,为确保授课目标的顺利达成,教师应从整体上进行把握与设计,做好相关例题以及训练习题的筛选,保证习题质量。同时,注重给学生提供课堂训练的机会,使其尽快、牢固地掌握所学,尤其要鼓励其运用错题本,做好优秀习题、做错习题的摘抄,做好解题思路、方法的总结,把握不同习题类型考查的知识点以及解题切入点。同时,定期进行错题重做,避免在以后的解题中走弯路,真正实现解题能力的提升。
参考文献:
[1]王静.高中“化学键”核心概念的学习进阶研究[D].鲁东大学,2020.
[2]吴晗清,唐慧.基于化学发展史的概念教学研究——以化学键为例[J].中小学教师培训,2021(03).
[3]夏文智.高中化学离子键教学的策略分析[J].高中数理化,2020(16).
[4]肖路.基于化学学科核心素养的初高中贯通教学研究——以“化学键”为例[J].化学教育,2021(07).
[5]胡久华,高冲,张晓雷.高中化学必修阶段“化学键”核心课程内容问题的分析研究[J].教育科学研究,2015(06).
[6]杨梓生,吴菊华.“化学键”对培育化学核心素养的价值分析[J].中学化学教学参考,2018(09).
[7]何彩霞.在多重关联中探寻知识的意义——以高中《化学2》“化学键”单元教学为例[J].化学教学,2014(08).
Study on the Exercise Teaching of Chemical Bond and Intermolecular Force in Senior Middle School
Tong Tao
(Liancheng No.1 Middle School, Fujian Province, Longyan 366299, China)
Abstract: Chemical bond and intermolecular force are important knowledge points in senior middle school chemistry. In order to enable students to deeply understand, firmly grasp the knowledge of chemical bond and intermolecular force, and flexibly apply it to problem solving, teachers should summarize relevant exercises in combination with students' reality, organize students to carry out exercise teaching activities, and carefully analyze the problem-solving ideas of different exercise types for students, make it better grasp the laws of different chemical bonds and intermolecular forces, and guide it to solve problems better. Combined with relevant exercises, this paper analyzes the exercise teaching of chemical bond and intermolecular force in senior middle school.
Key words: senior middle school chemistry; chemical bond; exercise teaching; study; analyse; law; problem solving ideas
