基于DNaseⅠ辅助目标物循环信号放大的赭曲霉毒素A检测方法
2022-02-24李宣仪刘沙沙
李宣仪,刘沙沙,刘 梅
(陕西师范大学 食品工程与营养科学学院,陕西 西安 710119)
赭曲霉毒素A(ochratoxin A,OTA)是自然界最为丰富的真菌毒素之一[1-3],其毒性大、化学性质稳定、热稳定性高且对农产品的污染最为严重,因与人类健康密切相关而受到广泛关注。为了减少食品中真菌毒素对人体健康的危害,许多国家和国际机构已对食品中部分真菌毒素设定了最高限量。在我国,根据GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》规定,葡萄酒中赭曲霉毒素A的限量标准为2.0 μg/kg,咖啡豆和咖啡粉中赭曲霉毒素A的限量标准为5.0 μg/kg,速溶咖啡中赭曲霉毒素A的限量标准为10.0 μg/kg。
OTA的传统检测方法主要有常规色谱法(如薄层色谱法和紫外可见光法)、荧光或质谱联用法、高效液相色谱法(HPLC)和气相色谱法(GC)等[4-6]。然而,这些方法存在各自的缺陷,例如耗时长、所需仪器昂贵、对工作人员技术水平要求较高或样品制备复杂等,影响了其大范围应用。近年发展起来的酶联免疫吸附法(ELISA)[7-8]虽然从一定程度上克服了上述困难,但其检测过程涉及繁琐的洗涤步骤,且需要对抗体的储存和应用条件进行严格控制,限制了其在生产中的推广应用。
适配体作为目前应用前景较为广阔的一种分子受体,是1条长度小于25 kDa的短单链核苷酸,可以在随机单链文库中利用SELEX(systematic evolution of ligands by exponential enrichment)方法体外筛选得到[9]。与抗体不同,适配体可以与目标物进行高亲和力和高特异性的结合,转化为精确的三维构象[10]。虽然适配体的结合能力与抗体相似,但其合成更为简便,稳定性更高[11-13]。由于适配体的选择性强、成本低廉且在多种条件下都具有高热稳定性[14-15],已逐渐广泛应用于多种靶分子(肽、氨基酸、蛋白质、有机分子、无机分子等)的检测[16-18]。同时,适配体也被认为是生物传感器的理想识别元件[19],并越来越多地应用于医疗[20]、环境监测[21]和食品分析等领域。
氧化石墨烯(graphene oxide,GO)是石墨烯的氧化物,具有单个原子层,其表面的六元环可以通过与DNA基本环状结构的π—π堆积作用实现表面DNA吸附,进而猝灭标记有6-羧基荧光素(FAM)的DNA。据文献报道,氧化石墨烯可以有效地猝灭FAM荧光,且FAM可以在远离氧化石墨烯的情况下恢复荧光[22],而酶可以在上述目标物的循环利用过程中起到信号放大作用。因具有良好的亲水性、生物相容性、安全性和无毒性,氧化石墨烯非常适用于食品中真菌毒素的检测。聚乙烯基吡咯烷酮(poly-vinylpyrrolidone,PVP)是一种非离子型高分子化合物,可溶于水,毒性低且生理相容性好,在医药、食品和化妆品等领域具有良好的发展前景。
基于此,本研究选用氧化石墨烯作为检测赭曲霉毒素A的猝灭剂,使用PVP作为氧化石墨烯的包被材料[22-23],试图通过借助PVP修饰的氧化石墨烯减弱赭曲霉毒素A和氧化石墨烯之间的非特异性吸附,降低背景;同时利用脱氧核糖核酸酶Ⅰ(DNase Ⅰ)催化靶标再循环,放大相关荧光信号,提高检测的灵敏度,进而实现对赭曲霉毒素A快速、准确、灵敏的检测。
1 材料与方法
1.1 材料和试剂
FAM(6-羧基荧光素)修饰的适配体寡核苷酸序列(5′-FAM-GATCGGGTGTGGGTGGCGTAAAGGGAGCATCGGACA-3′)由上海生物工程股份有限公司合成。
氧化石墨烯(GO)、赭曲霉毒素A(ochratoxin A,OTA)、赭曲霉毒素B(ochratoxin B,OTB)、赭曲霉毒素C(ochratoxin C,OTC)、玉米赤霉烯酮(zearalenone,ZEN)和华法林(warfarin)购自美国Sigma-Aldrich公司。通过将OTA溶解在无水乙醇中,并在20 ℃条件下储存,获得OTA储备溶液(1 mmol/L)。脱氧核糖核酸酶Ⅰ(deoxyribonuclease Ⅰ,DNase Ⅰ)购自宝生物工程(大连)有限公司。聚乙烯基吡咯烷酮(PVP,分子重为8 000、24 000、58 000)购自阿拉丁试剂(上海)有限公司。氯化钠(NaCl)、氯化钾(KCl)和无水氯化钙(CaCl2)购自北京化学试剂公司。Tris(C4H11NO3)购自北京索莱宝科技有限公司。所有化学品均为分析纯,使用前未进一步纯化。实验中使用的水均为超纯水(Millipore-Q 18.2 MΩ·cm),由纯水装置处理所得。
1.2 仪器和设备
实验所用仪器和设备如下:F-4600荧光分光光度计(日本日立公司)、圆二色光谱仪(UK Applied Photonics)、U-3000高效液相色谱仪(American Thermal Power 公司)、Thermo Scientific Orion Star A111台式pH测量仪(Thermo Fisher Scientific 公司)、QB-600高速振荡混合器(海门市其林贝尔仪器制造有限公司)、金属浴(卡尤迪生物科技有限公司)、超纯水装置(Millipore Simplicity 185)、Allegra X-30R型多功能台式离心机(美国贝克曼库尔特有限公司)、恒温混合器(杭州典盛仪器有限公司)。实验中记录反应体系在492 nm波长激发下,发射波长为500~630 nm的发射光谱。
1.3 方法
1.3.1 适配体构象改变的圆二色光谱图分析
(c)I borrowed the book from the library, I can keep for a week.
使用前将圆二色光谱仪用干燥的纯化氮气脱氧,并在实验期间维持在氮气环境中。将DNA适配体溶液(1 μmol/L)放入圆二色光谱仪的光学室(路径长度为1 cm,体积为1 mL)进行扫描,扫描速度为200 nm/min;采用1 nm的带宽和1 s的时间常数,以0.1 nm的间隔收集240~340 nm的数据,每个溶液扫描3次。圆二色光谱图扣除缓冲溶液的背景信号。
1.3.2 赭曲霉毒素A的测定
按照订购说明,在上海生物工程股份有限公司合成的适配体DNA(aptamer)序列中加入相应体积的10 mmol/L Tris-HCl 缓冲溶液(120 mmol/L NaCl、5 mmol/L KCl、20 mmol/L CaCl2,pH=8.0),水浴加热到 90 ℃,维持10 min ,逐渐冷却至室温,储存于4 ℃冰箱中冷藏备用。
在赭曲霉毒素A的测定中,先使用10 mmol/L Tris-HCl缓冲液将FAM标记的适配体DNA储备溶液稀释至200 nmol/L,再将50 μL上述适配体DNA溶液与25 μL不同浓度的赭曲霉毒素A溶液在37 ℃水浴中混合30 min;加入20 μL的40 μg/mL氧化石墨烯/聚乙烯吡咯烷酮(GO/PVP)溶液并在室温下孵育30 min,加入40 U DNase Ⅰ后继续孵育40 min,加入10 mmol/L Tris-HCl缓冲液至反应体系总体积为200 μL。反应体系震荡均匀后通过F-4600荧光分光光度计测量荧光强度。OTA检测限的计算方法为3σ/S,其中,σ为11次空白样品的标准偏差,S为得到的线性关系斜率。
1.3.3 方法选择特异性验证
选择OTA的结构类似物OTB、OTC、华法林及其他真菌毒素ZEN作为干扰物质代表(1 μmol/L,体积分数为75%的甲醇溶液溶解),以对应波长520 nm处的荧光强度为指标,基于DNaseⅠ辅助的目标物循环信号放大方式检测对靶标毒素OTA的选择特异性。
1.3.4 样品加标检测
按照国标GB 5009.96—2016中高效液相-荧光方法检测红酒和咖啡粉中赫曲霉毒素A的操作对样品进行处理。
红酒空白处理如下:实验前将待测红酒置于4 ℃冰箱冷藏30 min,过滤或超声脱气后使用。称取10 g 预处理红酒,加入6 mL提取液(氢氧化钾溶液(0.1 mol/L)∶甲醇∶水=2∶60∶38,体积比)混匀,氢氧化钾溶液(0.1 mol/L)调pH至10.0,进行固相萃取净化。红酒加标处理如下:在10 g预处理后的红酒中加入赭曲霉毒素A标准溶液,其他操作同红酒空白。使用本方法进行检测,并与标准高效液相-荧光检测方法(GB 5009.96—2016)进行比较。
咖啡粉空白处理如下:称取2.5 g咖啡粉,加入25 mL提取液(甲醇∶碳酸氢钠溶液(30 g/L)=1∶1,体积比),于漩涡振荡器上振荡提取3~5 min,4 000 r/min离心10 min,滤纸过滤,取滤液10 mL进行固相萃取净化。咖啡粉加标处理如下:在样品中加入赭曲霉毒素A 标准溶液,其他操作同样品空白。使用本方法进行检测,并与标准高效液相-荧光检测方法(GB 5009.96—2016)进行比较。
2 结果与讨论
2.1 基于DNase Ⅰ辅助的目标物循环信号放大方式检测赭曲霉毒素A的原理
图1为基于DNase Ⅰ辅助的目标物循环信号放大方式检测赭曲霉毒素A的原理示意图,其基本过程如下:当OTA不存在时,FAM标记的OTA适配体通过氧化石墨烯和核苷酸碱基之间的π—π堆叠,吸附到氧化石墨烯表面;由于从能量供体FAM到受体氧化石墨烯的距离缩短,产生了从FAM到氧化石墨烯的荧光共振能量转移效应,FAM荧光可以有效地被氧化石墨烯猝灭。当OTA存在时,经SELEX技术筛选得到的OTA适配体可以与OTA发生特异性结合[24],并从氧化石墨烯表面脱离,同时适配体构象从单链的柔性结构转变为反平行的G-四链体结构[25],氧化石墨烯对OTA适配体上标记的FAM的猝灭作用减弱,FAM的荧光恢复。

图1 基于DNase Ⅰ辅助的目标物循环信号放大方式检测赭曲霉毒素A的原理示意图Fig.1 Schematic diagram of OTA detection based on DNase Ⅰ-assisted target recycling signal amplification method
基于此,本方法通过监测FAM的荧光恢复程度量化OTA浓度。有文献报道,OTA在氧化石墨烯表面具有一定的吸附作用[22],会限制目标物循环,降低检测灵敏度。针对该问题,本研究中引入了氧化石墨烯的包被材料聚乙烯基吡咯烷酮,以减弱目标物OTA和氧化石墨烯之间的非特异性吸附。同时,传统方法中每个靶标仅与1个适配体结合,极大地限制了测定OTA的灵敏度。因此,本研究中引入脱氧核糖核酸酶Ⅰ,使反应体系发生靶标循环,最终达到信号放大的目的。脱氧核糖核酸酶Ⅰ可以水解游离的FAM适配体,得到游离的FAM荧光素和目标物OTA,而释放的OTA可以与另一个适配体结合,之后再被水解,最终形成OTA的循环使用,释放出越来越多的FAM荧光素,引起信号放大,从而实现有选择性地灵敏检测OTA。
2.2 适配体G-四链体结构的表征
通过记录圆二色光谱对FAM标记的适配体DNA在不同条件下的构象变化进行表征(图2)。结果显示,加入OTA后(曲线b),FAM标记适配体的圆二色光谱在290 nm处呈现出较强的正峰,在265 nm附近呈现出较强的负峰。这一现象由适配体中反向平行G-四链体结构的形成引起[26],而适配体与OTA的结合导致椭圆率增加。当体系中脱氧核糖核酸酶Ⅰ存在时,由于脱氧核糖核酸酶Ⅰ对DNA链具有水解作用, G-四链体结构被破坏,圆二色光谱图随之发生变化(曲线c)。
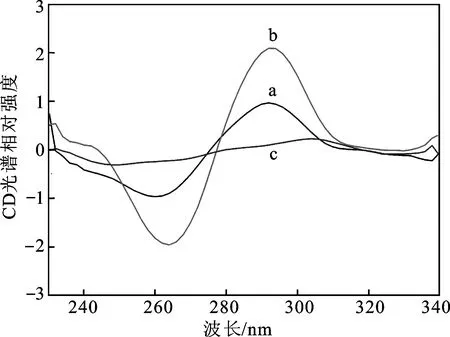
a.适配体;b.适配体+OTA;c.适配体+OTA+DNase Ⅰ。
2.3 方法的可行性验证
基于DNase Ⅰ辅助的目标物循环信号放大方式检测赭曲霉毒素A方法的可行性验证结果如图3所示。可以看出,当FAM标记的适配体受到一定波长的激发时,会在518 nm处检测出荧光(曲线a)。而在氧化石墨烯存在的情况下,吸附在氧化石墨烯表面的适配体使得FAM到氧化石墨烯之间的距离缩短,产生FAM与氧化石墨烯之间的荧光共振能量转移效应,FAM的荧光被猝灭(曲线b)。作为本研究的猝灭剂,氧化石墨烯可以有效地猝灭FAM约89%的荧光。加入OTA后FAM的荧光得到恢复,荧光强度与没有OTA的情况相比有所增强(曲线c)。上述过程中,OTA和适配体之间的强亲和力具有关键作用,由于OTA适配体反平行G-四链体结构的稳定性高,导致G-四链体结构的形成阻止了FAM标记的适配体吸附到氧化石墨烯表面。此外,在体系中DNase Ⅰ存在的情况下荧光强度显著增强(曲线d),信号强度约为无酶放大传统策略的4倍。产成该现象的原因是:DNase Ⅰ催化的OTA适配体反平行G-四链体结构复合物被破坏,目标物OTA释放,释放的OTA与另一个吸附在氧化石墨烯表面的FAM标记适配体结合,导致OTA分析物的循环利用和信号放大。上述结果表明,通过监测适配体传感平台荧光强度的变化来测量OTA浓度的方法可行。
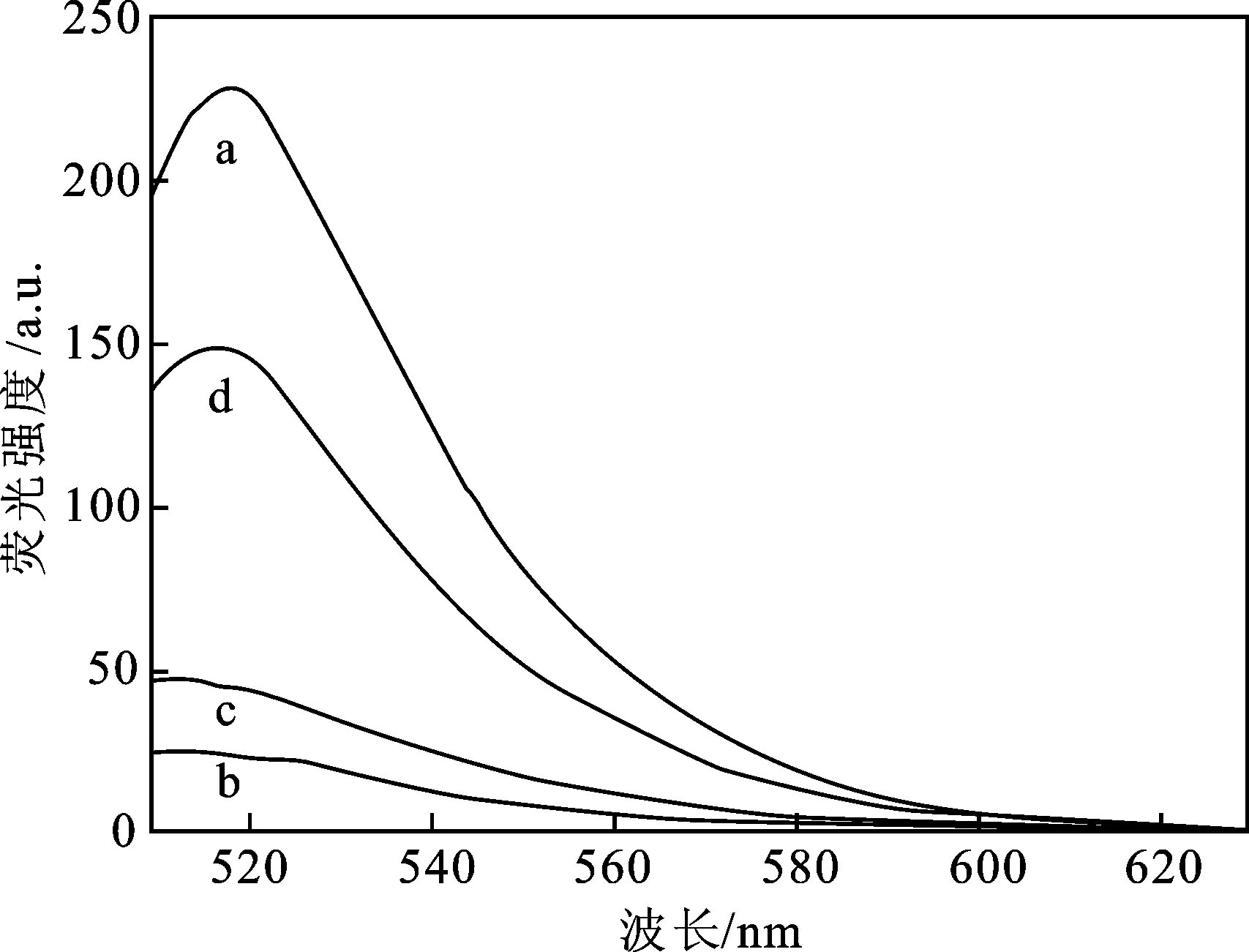
a.适配体(50 nmol/L),b.适配体(50 nmol/L)+GO(3 μg/mL)/PVP(10 nmol/L),c.适配体(50 nmol/L)+GO(3 μg/mL)/PVP(10 nmol/L)+OTA(50 nmol/L),d.适配体(50 nmol/L)+GO(3 μg/mL)/PVP(10 nmol/L)+OTA(50 nmol/L)+DNase Ⅰ(50 U)。
2.4 反应条件的优化
2.4.1 氧化石墨烯浓度的优化
氧化石墨烯作为本方法的猝灭剂,其浓度非常重要。本研究比较了氧化石墨烯在质量浓度为0、2、4、6、8和10 μg/mL的情况下,不存在和存在OTA时反应体系的荧光强度比(图4)。荧光强度比通过F/F0-1进行计算,其中F0和F分别为不存在和存在250 nmol/L OTA时体系中加入各浓度氧化石墨烯后的荧光强度。一般来说,使用的氧化石墨烯越多,越能有效地吸附单链DNA,猝灭效率越高;但过量的氧化石墨烯可能会包裹G-四链体DNA,也会猝灭荧光。因此,随着氧化石墨烯质量浓度的增加,体系的荧光强度比呈现出先增大后减小的趋势,氧化石墨烯质量浓度为4 μg/mL时体系具有最优荧光强度比。

图4 不同氧化石墨烯质量浓度下反应体系的荧光强度和荧光强度比Fig.4 Fluorescence intensities and fluorescence intensity ratios ofthe reaction systems with different concentrations of graphene oxide
2.4.2 PVP浓度和分子量的优化
PVP用量是影响OTA和氧化石墨烯之间非特异性吸附的重要因素。本实验研究了在氧化石墨烯质量浓度为4 μg/mL的条件下,PVP溶液物质的量浓度分别为0、5、10、25、50和100 nmol/L时,样品的荧光强度,结果如图5所示。当PVP浓度过高时,其在氧化石墨烯上吸附占据了过多的结合位点,阻止了FAM标记的适配体与氧化石墨烯作用,降低了氧化石墨烯的猝灭效率(图5a)。此外,PVP包被的氧化石墨烯还可以有效阻止目标分子与氧化石墨烯之间的非特异性吸附。由荧光强度比的结果可以看出,PVP的最佳物质的量浓度为10 nmol/L(图5b)。

图5 不同PVP物质的量浓度下反应体系的荧光强度和荧光强度比Fig.5 Fluorescence intensities and fluorescence intensity ratios of the reaction systems with different concentrations of PVP
实验还研究了使用不同分子量的PVP(8 000、24 000、58 000)对体系荧光强度的影响,结果如图6所示。可以看出,当PVP的分子量为24 000时,荧光强度比值最高(图6b)。因此,后续实验中选择分子量为24 000的PVP作为实验材料。

图6 不同分子量PVP条件下反应体系的荧光强度和荧光强度比Fig.6 Fluorescence intensities and fluorescence intensity ratios of the reaction systems with different PVP molecular weights
2.4.3 DNase Ⅰ用量的优化
为了使检测体系的性能达到最佳,对DNase Ⅰ的活性进行优化,结果如图7所示。可以看出,当DNase Ⅰ活性较小时,无法将从氧化石墨烯表面脱落下来的游离G-四链体DNA完全水解,产生的荧光信号较低。随着DNase Ⅰ活性的增加,越来越多的G-四链体DNA被水解,荧光强度急剧增加。当DNase Ⅰ活性增加至40 U时,荧光强度基本达到平台期。因此,在后续实验中DNase Ⅰ的活性选择40 U。

图7 DNase Ⅰ活性对反应体系荧光强度的影响Fig.7 Effect of DNase Ⅰ activities on the fluorescence intensities of the reaction system
2.4.4 孵育时间的优化
为了获得最适宜的孵育时间,对体系中加入DNase Ⅰ后的反应时间进行优化,结果如图8所示。加入DNase Ⅰ后分别令体系反应5、10、20、30、40、50、60、70和80 min,记录测量得到的荧光强度。可以看出,荧光强度在反应初始阶段急剧增加,当反应时间延长至40 min时,荧光强度达到最大值。此后孵育时间继续延长,荧光强度不再继续增加,推测40 min时FAM修饰的适配体与靶分子之间的特异性结合达到饱和。因此,选择DNase Ⅰ的作用时间为40 min。

图8 DNase Ⅰ作用时间对反应体系荧光强度的影响Fig.8 Effect of incubation times of DNase Ⅰ on thefluorescence intensities of the reaction system
2.5 方法的可行性
将FAM修饰的适配体与OTA提前混合,保证二者之间作用充分。图9a为荧光强度对OTA物质的量浓度的响应情况,可以看出荧光强度随着OTA物质的量浓度(0~5 μmol/L)的增加而增强。将图9a中荧光光谱的最大发射峰强度绘制为OTA物质的量浓度的函数(图9b),得到OTA的线性检测范围为25~250 nmol/L,回归方程为y=1.667 9x+39.133 9(R2=0.994),计算出的OTA检测限(LOD)为9.38 nmol/L(信噪比为3)。

图9 荧光强度对OTA浓度的响应情况Fig.9 Response of fluorescence intensities to OTA concentrations
据文献报道,利用EWA生物传感平台,或者使用纳米石墨材料或单壁碳纳米管(SWCNHs)作为体系的荧光猝灭剂,其OTA检测体系的LOD值结果如表1所示。比较发现,本方法的检测限低于先前没有使用DNase Ⅰ检测方法的检测限。例如,在利用EWA生物传感平台检测OTA的方法中,其LOD值为975 nmol/L[27]。这主要是由于本方法中DNase Ⅰ的有效催化活性实现了目标物的循环利用,产生了信号放大的效果。

表1 本方法与其他OTA检测方法检测限的比较Tab.1 LOD comparison with other OTA detection methods
2.6 方法的特异性
为了评估构建的酶辅助信号放大荧光法对靶标毒素OTA的选择特异性,选择OTA结构类似物OTB、OTC、华法林和真菌毒素ZEN作为干扰物质分别加入检测体系,使体系中毒素的物质的量浓度为250 nmol/L,监测系统荧光强度的变化情况,结果如图10所示。可以看出,只有当靶标毒素OTA存在时体系才会产生非常显著的荧光特异性响应,OTA的结构类似物OTB、OTC、华法林和真菌毒素ZEN不会引起体系荧光强度的明显增加,表明该荧光分析法对靶标毒素 OTA具有良好的选择特异性。

图10 OTA检测体系的选择特异性Fig.10 Selectivity of the sensor toward OTA
2.7 方法的有效性
为了验证该方法的可靠性,在红葡萄酒和2种咖啡样品中添加4 种不同浓度的OTA标准溶液,采用构建好的酶辅助信号放大荧光法测定样品的荧光强度, 按照标准曲线计算得到样品的OTA浓度(图11),进而确定该方法对红葡萄酒和咖啡样品中不同浓度OTA的加标回收率和精密度。将本方法的测定结果与标准HPLC方法的测定结果进行比较(表2),可以看出本方法具有良好的有效性,回收率为96.78%~110.97%,标准偏差为1.23%~5.00%,适用于实际样品中OTA的检测。
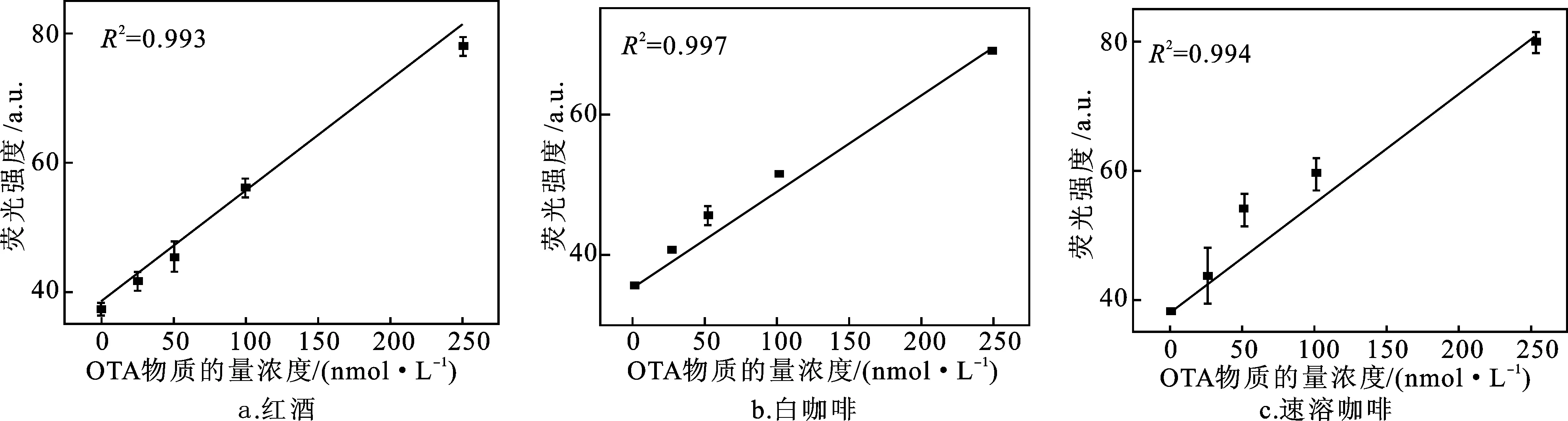
图11 使用本方法得到的OTA样品检测标准曲线Fig.11 Linear relationships between fluorescence intensities and the concentrations of OTA using the constructed method

表2 方法的回收率和精密度测定结果Tab.2 The recovery rate and precision of the method
3 结论
研究提出一种基于DNase Ⅰ酶辅助的目标物循环信号放大策略用于样品中OTA的检测。该方法利用了氧化石墨烯和靶标适配体的优点,同时结合DNase Ⅰ的水解作用实现了目标物的循环利用,达到了信号放大的目的。通过考察氧化石墨烯浓度、PVP浓度及分子量、DNase Ⅰ活性和孵育时间对检测OTA的影响,获得了最佳检测条件。该方法在OTA物质的量浓度为25~250 nmol/L的范围内,荧光强度与样品中OTA浓度之间具有良好的线性关系,其检测限为9.38 nmol/L,回收率为96.78%~110.97%,标准偏差为1.23%~5.00%,对红酒、白咖啡和速溶咖啡等实际样品中的OTA检测均具有较好效果。本研究构建的方法操作简便,选择性和可靠性好,可用于样品中OTA的检测,并为食品中其他真菌毒素的检测提供了新思路。
