磷脂聚合物涂层对聚丙烯膜氧合器血液相容性的影响
2022-02-24史珂慧王彦兵刘雯雁高菊林宫永宽蒋红利
史珂慧,王彦兵,刘雯雁,张 欢,高菊林,宫永宽,蒋红利*
(1 西安交通大学第一附属医院 肾脏病医院血液净化科,陕西 西安 710061;2 西安工程大学 纺织科学与工程学院,功能性纺织材料及制品教育部重点实验室,陕西 西安 710048;3 西北大学 化学与材料科学学院,合成与天然功能分子教育部重点实验室,陕西 西安 710127)
氧合器是体外循环(extracorporeal circulation, ECC)设备中的核心元件,其主要组成部分是膜材料,而膜材料的血液相容性是氧合器应用中最值得关注的问题。在ECC过程中,膜材料接触血液后表面会瞬间吸附血浆蛋白,激活凝血系统引起凝血,并进一步激活补体和白细胞诱发免疫反应和炎症反应,这既导致频繁更换耗材的医疗费用增加,又加大了患者的死亡风险[1]。在体外循环中使用抗凝剂是提高血液相容性的一个常规措施,这虽然可以减少凝血事件的发生,但增加了出血的风险,而且长期使用肝素类抗凝剂还会引起脂质代谢紊乱、骨质疏松及肝素诱导的血小板减少症等不良反应,对患者的长期生存具有严重影响[2]。
对膜材料表面进行改性是提高氧合器血液相容性的另一个重要策略。比较简单的改性方法是在膜表面构建一层生物相容性涂层以减少血浆蛋白的吸附,进而减少凝血反应和免疫反应。2-甲基丙烯酰氧乙基磷酰胆碱(2-methacryloyloxyethyl phosphorylcholine, MPC)聚合物是一类含有磷酰胆碱基团的仿细胞膜结构聚合物。研究表明,将MPC聚合物涂敷在材料表面不仅可以明显减少血浆蛋白的吸附,而且其只在材料表面局部作用,不会对机体造成严重影响,因此MPC聚合物近些年来备受关注[3-5]。尽管MPC聚合物已被用于导丝、血管支架等医疗器械的表面改性,但其长期使用效果还需要进一步持续观察[6-8]。有研究发现,对体外循环设备进行MPC聚合物涂层改性并不能改善体外循环设备引起的炎症反应[9]。导致这种现象的原因可能是MPC聚合物涂层以简单的物理吸附结合在膜表面,在体内会溶解或脱落而无法发挥作用。一些体外实验显示,在MPC聚合物中加入交联基团或多巴胺可以增加聚合物涂层的黏附性[10-13],但是这些MPC聚合物涂层很少被用于体外循环膜材料的改性,其在体内复杂环境中是否依然具有优异的稳定性并不清楚。
本研究基于上述思路进行体外循环膜材料的改性研究,通过合成含有交联基团的PMBT(MPC/甲基丙烯酸正丁酯(BMA)/γ-甲基丙烯酰氧丙基三甲氧基(TSMA))聚合物、PMLT(MPC/甲基丙烯酸十二烷基酯(LMA)/TSMA/丙烯酸聚乙二醇酯(PEG))聚合物和含有多巴胺的PMNC(MPC/对硝基苯氧羰基聚乙二醇甲基丙烯酸酯(NPEM)/多巴胺)聚合物,并将这3种MPC聚合物分别涂敷在聚丙烯(polypropylene,PP)膜材料表面,研究聚合物涂层的稳定性及其对PP膜氧合器的血液相容性,以期找到生物稳定性优异且可以提高ECC膜材料血液相容性的涂层材料,并为其进一步临床转化应用提供客观的实验依据。
1 材料与方法
1.1 MPC聚合物的合成
使用自由基聚合方式合成PMBT聚合物。该聚合物中含有可交联基团三甲氧基硅烷,合成方法参照文献[14]。简述如下:在反应器中加入1/3体积的乙醇,通入氮气30 min,将反应器加热至75 ℃。把单体MPC、BMA和TSMA溶解在剩下的2/3体积的乙醇中,将偶氮二异丁腈(AIBN)引发剂溶于少量四氢呋喃(THF)溶剂中。取1/3体积的AIBN+THF混合溶液至反应器;取2/3体积的AIBN+THF混合溶液与单体溶液混合,并将其用恒压滴液漏斗等速加入反应器中,滴加时间为1~2 h,75 ℃搅拌24 h。反应结束后将反应液浓缩,然后使用无水乙醚沉淀,沉淀物溶解在无水甲醇中保存或真空干燥保存。
用同样方法合成含PEG和可交联基团的PMLT聚合物。参照Gong等[13]的方法合成含多巴胺的PMNC聚合物。
1.2 MPC聚合物涂层的构建
1.2.1 PMBT聚合物涂层的构建
采用溶液浸渍法对PP膜材料样品进行改性。具体步骤如下:将PMBT聚合物溶于体积分数为90%的甲醇溶液,配置成质量浓度为1 mg/mL的PMBT聚合物甲醇溶液;将PP膜浸泡在上述溶液中5 min,50 ℃三乙胺密闭环境氛围交联8 h,蒸馏水洗涤,真空干燥备用。
PP膜氧合器改性方法如下:将1 mg/mL PMBT甲醇溶液注入氧合器浸涂10 min,除去聚合物溶液并干燥;室温下三乙胺气氛密闭贮存5 d,然后用大量蒸馏水洗涤,真空干燥,环氧乙烷消毒后备用。
1.2.2 PMLT聚合物涂层的构建
PP膜材料改性方法如下:将PMLT聚合物溶于蒸馏水配置成质量浓度为1 mg/mL的PMLT聚合物水溶液;将PP膜在上述溶液中浸泡2 h,80 ℃加热交联24 h,蒸馏水洗涤,真空干燥备用。
PP膜氧合器改性方法如下:将1 mg/mL PMLT聚合物水溶液注入氧合器,浸涂2 h,抽出溶液后80 ℃加热干燥24 h,蒸馏水洗涤后真空干燥,环氧乙烷消毒后备用。
1.2.3 PMNC聚合物涂层的构建
配置1 mg/mL的PMNC聚合物水溶液,用饱和碳酸钠溶液将其pH值调至8.5;将PP膜在上述溶液中浸泡2 h,80 ℃加热交联8 h,蒸馏水洗涤,真空干燥备用。PP膜氧合器改性方法同PMLT聚合物涂层。
1.3 MPC聚合物涂层的结构表征
采用INOVA-400液体超导核磁共振谱仪测试MPC聚合物的1H-NMR谱图;采用K-Alpha型光电子能谱仪分析改性前后PP膜表面的X射线光电子能谱(XPS);采用Tensor 27傅里叶红外光谱仪对改性前后的PP膜进行衰减全反射红外光谱(ATR-FTIR)测定。
1.4 MPC聚合物涂层的生物稳定性评估
在20 ℃或60 ℃条件下,将改性后的PP膜样品分别置于体积分数为0、50%和90%的乙醇溶液中浸泡12 h,或放入质量分数为1%的十二烷基硫酸钠(SDS)溶液中超声波洗涤30 min。将样品用蒸馏水完全洗脱并干燥,测试样品的动态接触角,观察处理前后改性PP膜的动态接触角变化。
1.5 改性PP膜的体外血液相容性评价
1.5.1 体外蛋白质吸附实验
将PP膜样品分别浸入4.5 mg/mL牛血清白蛋白(bovine serum albumin,BSA)溶液和0.3 mg/mL纤维蛋白原(fibrinogen,FIB)溶液,在二氧化碳培养箱中培养后,置于SDS水溶液中进行超声波洗涤。取少量解吸液加入二辛可宁酸(bicinchoninic acid,BCA)工作试剂,紫外分光光度计测定溶液在562 nm处的吸光度值,代入事先绘制的蛋白质工作曲线,计算得出解析液中的蛋白质浓度,并计算蛋白质在样品上的吸附量。
1.5.2 血小板黏附实验
PP膜样品在磷酸盐缓冲液(PBS)中浸泡120 min,滤纸吸除残余的PBS溶液;将20 μL富含血小板血浆(platelet rich plasma, PRP)加入待测样品,置于培养皿中;培养皿在37 ℃、饱和湿度的二氧化碳培养箱中孵育120 min,用PBS溶液冲洗样品表面,将黏附力弱的血小板淋洗干净;样品在2.5%戊二醛溶液中浸泡60 min,依次用PBS溶液和蒸馏水洗涤,-50 ℃冻干120 min;喷金后用扫描电镜(SEM)观察血小板的形态及黏附情况。
1.6 动物体内实验评价氧合器的血液相容性
本研究经西安交通大学实验动物伦理委员会批准进行,采用交叉实验的方法,洗脱期为14 d。
1.6.1 ECC动物模型的建立
动物模型采用6只实验用比格犬,体重为9~12 kg。3%戊巴比妥钠腹腔注射麻醉(30 mg/kg)后仰卧位固定,然后经股静脉留置双腔中心静脉导管(8.5 Fr)。160 mL羟乙基淀粉注射液预充管路及透析器后,在压力泵的作用下血液从导管动脉端引出并流经氧合器,再经导管静脉端回输入犬体内。ECC时间为120 min,血流速度为90 mL/min,抗凝方式为枸橼酸钠体外抗凝。具体抗凝操作为4%枸橼酸钠在氧合器前以180 mL/h的速度持续泵入,同时经外周静脉补充葡萄糖酸钙溶液。ECC结束后拔除股静脉插管并按压伤口直至不再渗血。如果在ECC过程中有部分凝血则提前结束。
1.6.2 血液检测
分别于体外循环0 min、5 min、15 min、30 min、60 min及120 min时采集血样,检测血液中血小板(PLT)、白细胞(WBC)和红细胞(RBC)的计数以及FIB、β血小板球蛋白(β-TG)、白介素8(IL-8)、凝血酶-抗凝血酶复合物(TAT)、补体片段5a(C5a)和凝血酶原片段F1+2(F1+2)的浓度。使用全自动细胞计数仪和凝血分析仪进行血细胞计数和纤维蛋白原检测,采用酶联免疫分析实验(ELISA)检测血浆中β-TG、IL-8、C5a、TAT和F1+2的浓度。
1.6.3 PP膜表面凝血情况观察
ECC结束后,用2 000 mL生理盐水冲洗整个管路及氧合器,解剖氧合器并将PP膜浸泡在2.5%戊二醛溶液中,然后用去离子水冲洗3次,-50 ℃将PP膜冷冻干燥,采用光学显微镜和扫描电子显微镜观察膜表面并拍照。
1.7 统计学分析
2 结果
2.1 MPC聚合物合成结构
2.1.1 PMBT聚合物合成结构
PMBT聚合物的1H-NMR谱图如图1所示,可以看到PMBT各组分的特征峰,即MPC特征峰(3.25)、BMA特征峰(1.45)和TSMA特征峰(0.65)。

图1 PMBT聚合物的1H-NMR谱图 Fig.1 1H-NMR spectrum of PMBT polymer
2.1.2 PMLT聚合物合成结构
PMLT聚合物的1H-NMR谱图如图2所示,可以看到PMLT各组分的特征峰,即MPC特征峰(3.25)、LMA特征峰(1.4)、PEG特征峰(3.7)和TSMA特征峰(0.65)。

图2 PMLT聚合物的1H-NMR谱图Fig.2 1H-NMR spectrum of PMLT polymer
2.1.3 PMNC聚合物合成结构
PMNC聚合物的1H-NMR谱图及聚合物中各组分的组成比例同Gong等[13]。
2.2 MPC聚合物薄膜的形貌与组成
用SEM、XPS和ATR-FTIR对PP膜材料进行结构表征,以PMBT聚合物改性PP膜为例对表征结果进行说明。SEM结果显示无涂层PP膜具有直径约为1 μm的微孔,而改性PP膜表面覆盖了一层薄薄的PMBT聚合物膜(图3)。用ATR-FTIR

图3 PP膜改性前后的扫描电镜照片Fig.3 SEM photos of PP membranes before and after modification
分析改性PP膜表面的官能团,可以发现PMBT聚合物所特有的信号峰,即在1 750 cm-1处呈现C=O拉伸振动,1 240 cm-1和1 080cm-1处呈现O~P=O不对称及对称拉伸振动;而无涂层PP膜中没有检测到上述信号峰(图4a)。XPS结果显示PMBT改性PP膜后,谱中出现了P、N和Si等 PMBT聚合物所特有的信号峰,而无涂层PP膜上没有出现类似信号峰(图4b)。以上结果均表明PMBT聚合物被成功地涂敷在PP膜表面。

图4 PMBT改性PP膜的ATR-FTIR和XPS结果Fig.4 ATR-FTIR and XPS results of PMBT modified PP membranes
PMLT和PMNC聚合物改性PP膜的上述分析结果与PMBT聚合物改性PP膜类似,也表明PMLT和PMNC聚合物分别被成功地涂敷在PP膜表面。
2.3 MPC聚合物涂层的生物稳定性
动态接触角的变化可以反映MPC聚合物涂层的稳定性。本研究结果显示,在20 ℃或60 ℃条件下,将膜材料分别在体积分数0、50%和90%的乙醇溶液中浸泡12 h,或者在质量分数1%的SDS溶液中超声波洗涤30 min,PMBT、PMLT、PMNC聚合物改性PP膜的动态接触角均没有发生明显变化(P>0.05)(图5)。以上结果说明,在乙醇溶液及SDS溶液中,3种MPC聚合物涂层非常稳定,没有被溶解或洗脱。

图5 MPC改性PP膜在乙醇/SDS溶液中浸泡前后的动态接触角变化Fig.5 Dynamic contact angle changes of MPC modified PP membranes before and after immersion in ethanol/SDS solution
2.4 抗蛋白质吸附性能
如图6所示,分别在4.5 mg/mL BSA溶液和0.3 mg/mL FIB溶液中浸泡120 min后,无涂层PP膜吸附的BSA和FIB分别为(0.51±0.14) μg/mg和(0.80±0.20) μg/mg。PMBT聚合物涂层PP膜的BSA和FIB吸附量较无涂层PP膜分别下降了78%和79%,仅为(0.11±0.04) μg/mg和(0.17±0.08) μg/mg。PMNC聚合物涂层PP膜吸附的BSA和FIB分别为(0.22±0.04) μg/mg和(0.18±0.06) μg/mg,与无涂层PP膜相比分别减少了57%和78%。PMLT聚合物涂层改性使PP膜对BSA和FIB的吸附量分别降至(0.13±0.06) μg/mg和(0.22±0.05) μg/mg,与无涂层PP膜相比分别减少了75%和73%。PMBT、PMLT、PMNC聚合物涂层组分别与无涂层组两两比较,均有统计学差异(P<0.01),但3种MPC聚合物涂层组之间无统计学差异(P>0.05)。

**表示PMBT组、PMNC组、PMLT组与无涂层组比较差异显著(P<0.01)。图6 MPC改性PP膜对BSA和FIB的吸附Fig.6 Adsorption of BSA and FIB by MPC modified PP membranes
2.5 抗血小板黏附性能
电镜下观察正常未活化的血小板呈圆盘状,而活化的血小板肿胀变形,失去原有结构。如图7所示,无涂层PP膜表面黏附的血小板较多且呈活化状态,有些表现为局部肿胀,有些表现为星形不规则状,周边可见伪足。相比之下,3种MPC聚合物涂层PP膜表面黏附的血小板数量均很少, 尤其是PMBT涂层PP膜表面,几乎看不到血小板黏附;虽然PMNC涂层PP膜表面可以观察到少量黏附的血小板,但是均为球形或圆盘形等非活化状态。

图7 MPC改性PP膜黏附血小板的扫描电镜照片Fig.7 SEM photos of adhesion to platelets for MPC modified PP membranes
2.6 体外循环下氧合器改性涂层的抗血栓效果
体外循环120 min后,无涂层氧合器中可见较多红色血栓形成,而MPC聚合物涂层氧合器中几乎没有血栓形成(图8)。将氧合器解剖后,可以看到无涂层PP膜表面有红色血栓形成,而3种MPC聚合物涂层PP膜表面几乎看不到血栓(图8)。以上结果表明,MPC聚合物涂层可以显著改善PP膜表面的凝血现象。
2.7 体外循环后改性PP膜的微观形貌
如图9a所示,在光学显微镜下观察无涂层PP膜表面,可见明显血栓形成;在低倍SEM下可见无涂层PP膜表面覆盖了一层血栓;在高倍SEM下可以看到无涂层PP膜表面有一层含血细胞、纤维蛋白原等成分的复合涂层,形成了厚而不规则的网状污染层结构,使大部分微孔被堵塞。但是PMBT、PMLT、PMNC聚合物涂层PP膜均保持了原有的聚合物涂层状态,对血液成分的吸附较少,亦没有明显的血栓形成(图9b、9c、9d)。

a. 无涂层氧合器可见明显红色血栓形成;b.MPC聚合物涂层氧合器;c. 无涂层PP膜;d. PMBT涂层PP膜; e. PMNC涂层PP膜; f. PMLT涂层PP膜。

图9 体外循环120 min后氧合器表面改性膜的显微镜照片Fig.9 Micrographs of modified membranes atoxygenator surface after 120 min of ECC
2.8 体外循环后的血液组成变化
2.8.1 纤维蛋白原吸附与凝血激活
在ECC过程中,预充液进入动物体内会对血液起到稀释作用,根据实验犬体质量(12 kg)和理论血容量(7%)计算血液稀释率约为16%。
如图10a所示,ECC 5 min时各组的FIB质量浓度均较ECC前有所下降。除去血液稀释效应,无涂层组和PMNC组的FIB质量浓度分别下降约15%和18%,而PMBT组和PMLT组几乎没有下降。ECC 15 min时,PMBT组、PMNC组和PMLT组的FIB质量浓度下降逐渐减缓并达到平台期,但是无涂层组的FIB质量浓度继续下降。ECC 120 min时,无涂层组的FIB质量浓度仅为(0.63±0.05) g/L,较ECC前下降70%;而PMBT组、PMNC组和PMLT组的FIB质量浓度分别为(1.90±0.42) g/L、(1.48±0.35) g/L和(1.80±0.04) g/L,较ECC前分别下降15%、22%和12%,下降幅度比无涂层组分别低55%、48%和58%。
如图10b、10c所示,体外循环时各组的TAT和F1+2浓度均有所上升,其中无涂层组的上升趋势最为明显。ECC 120 min时,无涂层组的TAT质量浓度和F1+2物质的量浓度均达到峰值,分别为(7.05±0.10) μg/L和(99.56±8.49) nmol/L,分别是ECC前的2.59倍和2.78倍。无涂层组TAT质量浓度与PMBT组、PMNC组、PMLT组两两比较,均有统计学差异(P<0.01,P<0.05,P<0.05);而各组的F1+2物质的量浓度比较无差异(P>0.05)。MPC聚合物各组的TAT和F1+2浓度在各ECC时间点比较均无统计学差异(P>0.05)。

*和**表示MPC聚合物涂层组和无涂层组比较有差异(P<0.05,P<0.01),***表示MPC聚合物涂层组和无涂层组比较有显著性差异(P<0.001)。
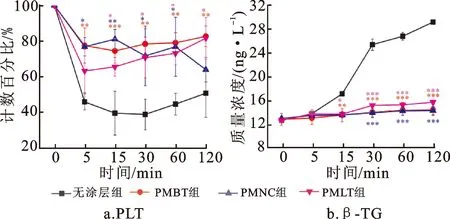
2.8.2 血小板吸附与激活
如图11a所示,ECC 5 min时,各组的PLT计数均较ECC前有所下降,其中无涂层组的PLT计数百分比下降最为明显(38.3%),PMBT组、PMNC组和PMLT组的PLT计数百分比分别下降6.6%、7.3%和20.9%。值得注意的是,EEC 120 min时,PMBT组和PMLT组的PLT计数已基本恢复到ECC前水平,而PMNC组和无涂层组的PLT计数较ECC前分别下降20%和33%。PMBT组、PMLT组与无涂层组比较均有统计学差异(P<0.05,P<0.01),但PMNC组与无涂层组比较无统计学差异(P>0.05),各MPC聚合物涂层组之间亦没有差异(P>0.05)。
如图11b所示,无涂层组在ECC 5 min时的β-TG质量浓度开始增加,15~30 min期间上升明显,60 min后上升趋势逐渐减缓;而PMBT组、PMNC组和PMLT组的β-TG质量浓度ECC前后无明显变化。各MPC聚合物涂层组与无涂层组比较均有显著性差异(P<0.001)。
2.8.3 白细胞吸附与激活
如图12a所示,ECC 5 min时,各组的WBC计数均较ECC前有所下降,无涂层组、PMBT组、PMNC组和PMLT组的WBC下降率分别为36.3%、14.1%、20.9%和2.4%(除去血液稀释16%),虽然各组间比较无明显差异,但无涂层组的下降趋势最为明显。值得注意的是,ECC 120 min时,PMBT组、PMLT组和无涂层组的WBC计数均有所恢复,而PMNC组的WBC计数继续下降,但是与其他组比较没有统计学差异(P>0.05)。
*和**表示MPC聚合物涂层组和无涂层组比较有差异(P<0.05,P<0.01),***表示MPC聚合物涂层组和无涂层组比较有显著性差异(P<0.001)。
如图12b、12c所示,ECC过程中无涂层组的C5a和IL-8质量浓度上升明显,15 min时达到峰值,分别是ECC前的4.24倍和5.65倍;120 min时,无涂层组的C5a和IL-8质量浓度基本恢复到ECC前水平。各MPC聚合物涂层组的C5a和IL-8质量浓度在ECC过程中始终维持在比较稳定的水平,与无涂层组比较均有显著性差异(P<0.05),各MPC聚合物涂层组之间比较无统计学差异(P>0.05)。

**表示MPC聚合物涂层组和无涂层组比较有差异(P<0.01),***表示MPC聚合物涂层组和无涂层组比较有显著性差异(P<0.001)。
2.8.4 红细胞及血红蛋白指标变化情况
在整个ECC过程中,各组的红细胞百分比、红细胞压积、血红蛋白百分比、平均红细胞体积等相关指标均无明显变化,组间比较亦无差异(图13),说明MPC聚合物涂层不会增加红细胞消耗,不会引起溶血,安全性好。
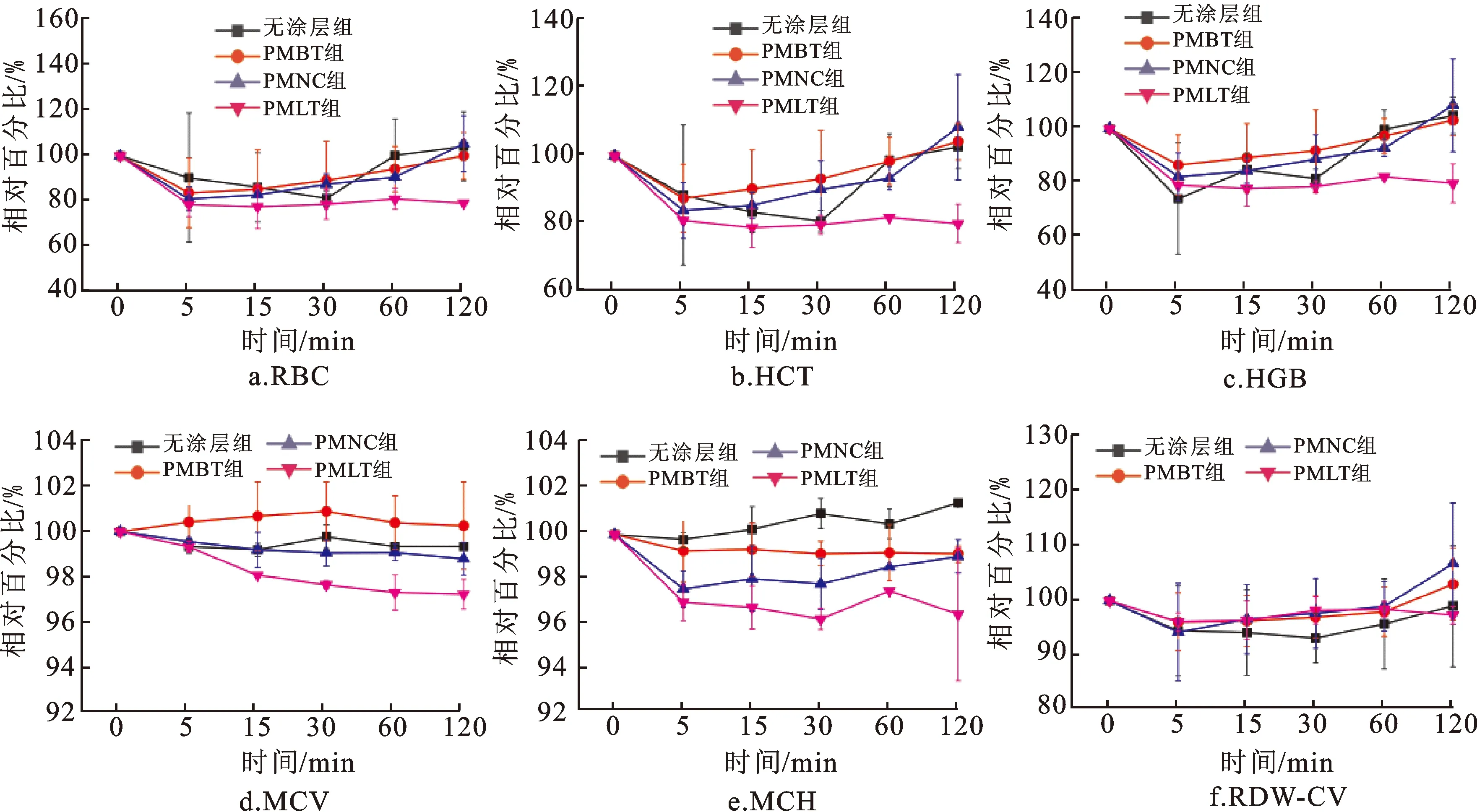
RBC表示红细胞,HCT表示红细胞压积,HGB表示血红蛋白,MCV表示平均红细胞体积,MCH表示平均血红蛋白含量,RDW-CV表示红细胞宽度CV值。
3 讨论
目前的膜材料均具有血液不相容性,膜材料表面改性是提高其血液相容性的重要策略。MPC聚合物是一类仿细胞膜结构的磷脂聚合物,研究表明MPC聚合物涂层可以显著提高膜材料的血液相容性。然而,既往MPC聚合物涂层在体内的不稳定性限制了其临床应用[3-5, 15]。为了提高MPC聚合物的稳定性,本研究合成了含交联基团的PMBT聚合物、PMLT聚合物和含多巴胺的PMNC聚合物,并将这3种MPC聚合物分别涂敷在PP膜表面。通过体外、体内序贯性实验,发现3种MPC聚合物不仅具有优异的稳定性,而且能够显著提高PP膜氧合器的血液相容性,明显减少体外循环凝血和机体炎症反应。该研究结果为MPC聚合物涂层医疗耗材的进一步转化应用提供了客观的实验依据。
MPC聚合物涂层的稳定性是将其应用于血液接触设备的决定因素。该类涂层所使用的共聚物属于类表面活性剂,容易在长期使用过程中发生脱落,相关研究表明表面活性剂涂层在4 h心胸旁路循环后只能保存90%[15]。导致这种现象的原因可能是MPC聚合物涂层以简单的物理吸附结合在膜表面,在体内会被溶解或脱落致其无法发挥作用。另外,在一定条件下,涂层表面附近的亲水基团可能发生迁移而深入薄膜内部,引起表面不可逆的结构变化[16]。因此,如何增加MPC聚合物的稳定性成为研究热点。Lewis等[10]将交联基团引入MPC聚合物,结果表明MPC聚合物通过三甲氧基硅烷交联固定在基材表面,可以明显提高MPC聚合物涂层的稳定性。Gong等[11]利用自由基共聚合合成了一种含交联基团的MPC聚合物(PMST聚合物),发现这种方法可以在很大程度上调整聚合物的表面结构,获得一个稳定的细胞外膜模拟表面/界面。此外,把多巴胺加入MPC聚合物中可以合成具有仿细胞膜和仿贻贝结构的“双仿生”聚合物,该类聚合物不仅具有良好的抗蛋白吸附性能,而且黏附性极强,在生物医学、材料工程、生物工程和环境应用等方面拥有广泛的应用前景[13, 17-20]。本研究合成的3种MPC聚合物包括含交联基团的PMBT聚合物、PMLT聚合物以及含多巴胺的PMNC聚合物,体外实验和体外循环动物模型发现3种MPC聚合物在体内外均具有优异的稳定性,与上述研究结果吻合。
膜材料在接触血液后纤维蛋白原是最早沉积的蛋白质之一,吸附的纤维蛋白原发生构象变化后可以介导血小板、白细胞和补体的黏附与活化,激活凝血反应、免疫反应和炎症反应,因此纤维蛋白吸附率是评价膜材料血液相容性的关键指标[1, 21-23]。本研究表明,在体外实验中PMBT、PMLT和PMNC聚合物涂层均能降低PP膜表面对BSA和FIB的吸附,该结果与另一个MPC聚合物PMB30的研究结果类似,而PMB30是第一个被评价为血液相容性良好的MPC聚合物,并已在美国食品和药物管理局(FDA)注册[24-26]。此外,本研究发现ECC 120 min时,无涂层组的FIB浓度较ECC前下降约70%,而PMBT组、PMNC组和PMLT组的FIB浓度较ECC前仅下降了15%、22%和12%。在另一项研究中,含磷脂聚合物涂层的氧合器体外循环100 min后,FIB下降率约为38%[27]。与上述改性氧合器相比,PMBT、PMNC和PMLT聚合物涂层改性氧合器对FIB的吸附率更低。然而,蛋白吸附率只是评价血液相容性的指标之一,还需要检测更多指标以对血液相容性进行更全面的评价。
不同聚合物的物理结构和化学特性存在差异,导致不同聚合物涂层与同一膜材料之间的相互作用也不同。在本研究中,PMBT、PMLT和PMNC聚合物涂层的体外稳定性和蛋白质吸附无明显差异。但在ECC过程中,PMNC组的WBC和PLT计数始终呈下降趋势,而PMBT组和PMLT组的WBC和PLT计数呈现先降后升的趋势;ECC 120 min时,PMBT组和PMLT组的WBC和PLT计数已基本恢复到ECC前水平,PMNC组却明显低于ECC前水平。虽然以上结果无统计学差异,但是推测造成这种现象的原因是PMNC涂层具有吸附力极强的双仿生结构,在膜材料接触血液后,PMNC涂层膜表面吸附的WBC和PLT比其他聚合物涂层膜更多,从而造成血液循环中WBC和PLT计数下降,该推测还需要大量的体内外实验进一步验证。
4 结论
本研究通过体内外实验初步揭示了合成的3种仿细胞膜结构聚合物涂层PMBT、PMLT和PMNC可以抑制PP膜表面对纤维蛋白原的吸附,减少膜表面对血小板、补体和白细胞的黏附与活化,显著提高PP膜氧合器的血液相容性,而且3种涂层均表现出优异的稳定性。上述研究结果为PMBT、PMLT和PMNC聚合物涂层体外循环医疗耗材的进一步转化应用提供了客观的实验依据。
