痛风性关节炎急性发作期血尿下降的机制研究
2022-02-24高大玉张均雩顾冰洁王小琴沈敏宁陈兴国
高大玉,张均雩,李 倩,顾冰洁,王小琴,袁 海,沈敏宁,陈兴国
0 引 言
痛风是单钠尿酸盐(monosodium urate, MSU)晶体在关节内及其周围形成和沉积,引起关节急性红肿、疼痛,常反复发作,并引起严重的炎症反应和不可逆的骨侵蚀[1]。研究发现,高尿酸血症与痛风密切相关,其不仅是痛风发作的病因,也是痛风发作的重要标志[2]。临床工作中发现,有部分痛风性关节炎患者急性发作期血尿酸(serum uric acid, SUA)水平较慢性缓解期降低,甚至降低到正常范围内(≤420 μmol/L)[3-7]。研究发现,急性痛风性关节炎时SUA的降低与尿酸排泄增加有关[5, 8]。有学者认为,肾上腺糖皮质激素及炎症因子C反应蛋白(CRP)、白细胞介素6(IL-6)的增加可能参与降尿酸过程[5]。上述研究结论提示在痛风急性发作时,机体自身可能通过启动生理机制增加肾排泄,从而达到自我调节尿酸浓度的目的,但具体机制尚未阐明。
痛风急性发作期患者血清中外泌体表达明显增加。由此推测,外泌体可能参与了尿酸代谢的调控。URAT1是一种重要的尿酸重吸收转运蛋白。本研究通过提取痛风发作期、缓解期以及正常人的血清外泌体,并分别作用于转染URAT1基因的人胚胎肾细胞株(Human Embryonic Kidney 293,HEK 293),通过检测URAT1的表达变化,探讨外泌体对尿酸重吸收的调控机制,及导致痛风患者急性发作期血尿酸下降的可能原因。
1 资料与方法
1.1 研究对象选取并收集2021年1月至2021年6月南京市第一医院风湿免疫科就诊的17例痛风患者和17例健康体检者临床资料和血清标本。痛风患者均为男性,年龄22~86岁,中位年龄58.5岁。所有患者均符合2015年EULAR/ACR提出的痛风分类标准诊断[9]。分别在痛风患者的急性发作期(急性发作组)和慢性缓解期(慢性缓解组)收集临床资料及血清。同时选取17名健康体检人员作为对照组。各组患者人口及临床特征差异无统计学意义(P>0.05),见表1。痛风性关节炎急性发作患者纳入标准:有典型的关节红、肿、热、痛的临床表现,未接受非甾体消炎药、激素、秋水仙碱及降尿酸药物治疗,患者发作时炎症指标血沉(ESR)明显升高,且SUA明显低于其慢性缓解期(≥60 μmol/L)的患者。排除标准:合并心脑血管、内分泌疾病、恶性肿瘤、血液系统疾病及其他风湿疾病;严重肾功能不全(肾小球滤过率GFR<30 mL/min,血清肌酐水平> 2.0 mg/dL);肝炎或肝功能不全(丙氨酸氨基转移酶或天冬氨酸氨基转移酶水平>2.0×正常上限);传染病病史等。研究经南京市第一医院伦理审查委员会批准(批件号:KY20210628-03),所有受试均知情同意。

表1 不同分期痛风患者临床特点比较
1.2外泌体提取收集所有患者空腹外周血,室温下以2000×g转速离心10 min,分离血清,并在-80 ℃下保存。将外周血清以2000×g和4 ℃离心20 min去除死细胞,再以10 000×g和4 ℃离心30 min去除细胞碎片。将上清液转移到另一个干净的离心管中,在120 000×g和4℃条件下进行60 min的超离心。丢弃上清液后用PBS重悬沉积的外泌体,然后在120 000×g和4℃条件下超离60 min。纯化后的外泌体用PBS重悬以供进一步研究或在-80 ℃保存。
1.3外泌体的鉴定采用免疫印迹法鉴定外泌体的特异性蛋白标记物CD63(美国Cell Signaling Technology)。利用纳米颗粒跟踪分析仪(ZetaView PMX 110)对外泌体的大小和数量进行纳米颗粒跟踪分析(上海生博生物医药科技有限公司)。并使用JEM-1010电子显微镜(JEOL)对外泌体的形态进行拍照,由南京医科大学分析测试中心操作鉴定,实验仪器为透射电子显微镜JEOL JEM-1010。
1.4URAT1过表达肾细胞株的制备
1.4.1 质粒的构建URAT1慢病毒在上海吉凯基因化学技术有限公司处购买,具体信息见图1。

基因名称:SLC22A12(NM_144585),物种:Human,载体名称:GV492,荧光标记:EGFP,克隆位点:Age I,元件顺序:Ubi-MCS-3FLAG-CBh-gcGFP-IRES-puromycin
1.4.2URAT1目的基因转染HEK293细胞将HEK293细胞接种到6孔板(板1)中培养;另用一块6孔板(板2)以相同细胞密度接种一孔用于第2天计数。各孔加入2 mL培养基培养24 h后,胰酶消化用于计数孔内细胞,得到板1每孔细胞数。将板1中的细胞分为2组,每3孔为一组,各对应一种慢病毒,按感染复数=5将目的基因慢病毒和对照慢病毒分别加入到2组HEK293细胞中,混匀后培养48 h。感染48 h后,EDTA消化病毒感染过的细胞,将各组中的3孔细胞合并收集, 转移至新的6孔板中培养,其中每块新的6孔板留出一孔用于阴性对照(即不加嘌呤霉素培养)。根据HEK293细胞嘌呤霉素最低致死浓度测定的结果,用含0.6 g/L嘌呤霉素的培养基。连续加药培养12 d,待细胞长满后,使用光学显微镜观察转染稳定后2种细胞的形态。
1.4.3转染URAT1后的合格细胞株荧光鉴定在URAT1稳转株及空载体稳转株细胞生长至融合率约为80%后,取出细胞,用PBS洗3次,每次5 min。4%多聚甲醇覆盖细胞,室温静置15 min后,用PBS洗3次,每次5 min。5 mg/L DAPI室温避光染色5 min,用PBS洗3次,每次5 min。加入PBS覆盖细胞,使用荧光显微镜观察并在相同曝光条件下拍摄细胞照片。
1.4.4Westernblot检测URAT1的蛋白表达水平利用RIPA裂解液提取全细胞蛋白,超声破碎后以13 000×g、4 ℃条件下离心10 min, 取上清, 使用BCA 蛋白浓度测定试剂盒测定样品总蛋白浓度。蛋白质(30 μg)通过10% SDS-PAGE进行分离,并转移到硝化纤维膜。5%的脱脂牛奶室温下2 h封闭后,加入事先按说明书比例配制的对应一抗,4 ℃ 摇床过夜,室温用TBST洗膜3次,每次10 min。加入辣根过氧化物酶(HRP)标记的二抗兔抗(1∶20 000稀释)或鼠抗(1∶5000稀释),室温下孵育2 h。TBST洗膜3次,每次10 min。将A、B发光液按比例稀释混合,滴上发光液,在成像系统中显像,用图象处理系统Image J分析目标条带光密度值。主要用于免疫印迹分析的抗体包括:GAPDH兔一抗:南京翼飞雪生物科技有限公司,URAT1兔一抗:赛默飞世尔科技(中国)有限公司,HRP-标记二抗兔IgG:碧云天生物科技。
1.4.5实时荧光定量(qRT-PCR)检测URAT1的mRNA表达水平使用TRIzol提取HEK293细胞的总RNA。RNA反转录获得 cDNA(HiScript© Q Select RT SuperMix for qPCR),使用qRT-PCR仪(Applied Biosystems life technologies)和AceQ qPCR SYBR Green Master Mix(南京诺唯赞生物科技有限公司)在如下热循环条件下进行qPCR:10 s 95 ℃,紧随其后10 s 95 ℃,30 s 60 ℃,然后95 ℃ 15 s,60 ℃持续60 s,95 ℃ 15 s获得熔化曲线。用2-ΔΔCt方法定量相对基因表达。数据以GAPDH mRNA水平为标准。引物为:URAT1,正向5′ TCTCCACGTTGTGCTGGTTC-3′,反向5′-GGATGTCCACGACACCAATGA-3′;和GAPDH,正向5′GGAGCGAGATCCCTCCAAAAT-3′和反向5′-GGCTGTTGTCATACTTCTCATGG-3′。
1.5尿酸摄取实验
1.5.1 外泌体刺激细胞将5×104个的HEK293 URAT1+细胞接种到12孔板中。待细胞增长至70%~80%时,分别加入急性发作期、慢性缓解期的外泌体10 μg/mL共培养6 h,并作一组未加入外泌体的空白对照。更换培养基,分别于第30、60、90、120、180分钟时收取细胞,通过qRT-PCR检测其URAT1 mRNA的表达情况。
1.5.2细胞摄取尿酸实验在预实验中,经过尿酸浓度梯度(400-500-600-700-800 μmol/L)后,发现加入800 μmol/LUA刺激细胞后,细胞反应结果较好;同时,800 μmol/L是常规患者血液浓度的可达到浓度高值。因此,选择800 μmol/L作为最终实验浓度。在与未经外泌体或经慢性缓解期、急性发作期外泌体共培养6 h后,加入高浓度800 μmol/L无菌尿酸溶液刺激细胞,于60 min收集细胞上清液,检测尿酸浓度,测得尿酸的浓度差,计算不同状态下HEK293 URAT1+细胞的尿酸摄取率。

2 结 果
2.1 外泌体鉴定结果
2.1.1 透射电子显微镜通过透射电子显微镜可观察到杯状或圆形囊泡状结构,直径为130~150 nm,符合典型外泌体的形态和大小,确认已成功提取外泌体。同时可以发现,慢性缓解期患者外泌体直径略大于正常人和急性发作期患者见图2。

a:正常人;b:慢性缓解期;c:急性发作期;标尺:200 nm图 2 外泌体透射电镜显微镜鉴定结果Figure 2 Identification of exosomes by TEM
2.1.2免疫印迹检测通过在蛋白水平对外泌体表面特异性标记物CD63检测,发现正常人、慢性缓解期患者、急性发作期患者的外泌体浓度逐渐升高,这与痛风疾病活动的变化相符。
2.1.3纳米颗粒跟踪分析通过纳米颗粒跟踪分析(Nanoparticle Tracking Analysis, NTA)检测,见表2,发现正常人的外泌体粒径最小(P<0.05),慢性缓解期与急性发作期外泌体的粒径差异无统计学意义(P>0.05);而就颗粒浓度而言,急性发作期的外泌体浓度最高,慢性缓解期的浓度次之,正常人的最低(P<0.01),见图3,表2。

表2 外泌体NTA计数及粒径分析表

1:急性发作期;2:慢性缓解期;3:正常人a:血清外泌体蛋白Western Blot检测膜蛋白CD63表达;b:粒径大小分析;c:颗粒浓度分析*P<0.05、**P<0.01图 3 外泌体鉴定结果Figure 3 Identification of exosomes
2.2HEK293细胞稳定表达URAT1满布绿色荧光证实URAT1基因成功转染至细胞中(图4a,b),且显示视野范围内无明显未转染细胞,提示转染效率较高,HEK293 URAT1+细胞模型构建成功。见图4。并从mRNA水平和蛋白水平分别验证URAT1表达情况。结果显示,转染了URAT1基因的HEK293细胞在mRNA水平和蛋白水平均高表达了URAT1,明显高于未转染细胞及转染阴性对照细胞。见图5。
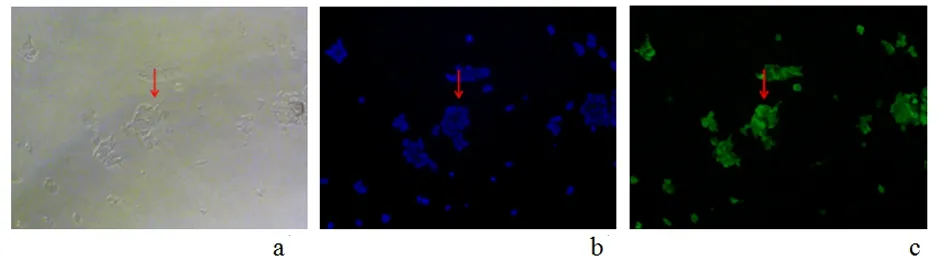
a:荧光显微镜白光;b:荧光显微镜DAPI;c:荧光显微镜GFP图 4 荧光显微镜观察HEK293细胞中URAT1质粒Figure 4 Observation of URAT1+ plasmid in HEK293 cells

1:HEK293细胞;2:HEK293转染阴性对照;3:HEK293转染URAT1
2.3尿酸摄取结果
2.3.1 经外泌体刺激后的细胞URAT1表达情况过表达URAT1的HEK293细胞在与外泌体共培养后,与未加入外泌体的细胞相比,急性发作期组URAT1 mRNA表达水平明显降低(P<0.01),慢性缓解期组略有下降(P<0.05)。
2.3.2与尿酸共培养后HEK293URAT1+细胞对尿酸的摄取率在过表达URAT1的HEK293细胞中,尿酸摄取率在不同外泌体共培养状态下具有明显差异。未加外泌体组尿酸摄取率为(6.03±0.62)×10-4,加入急性发作组为(2.15±0.43)×10-4,与未加外泌体相比明显降低(P<0.01);加入慢性缓解组也有所降低,但不如急性发作期明显(P<0.05),且急性发作期与慢性缓解期间差异也有统计学意义(P<0.01)。
3 讨 论
本研究旨在探索痛风性关节炎急性发作期部分患者血尿酸下降的可能的原因。在这项研究中,构建了过表达尿酸重吸收蛋白URAT1的细胞模型,即HEK293 URAT1+细胞,并给予痛风性关节炎不同时期外泌体刺激,发现细胞摄取尿酸的能力下降。
尿酸的排泄减少是发生高尿酸血症的原因[10]。人体中,2/3的尿酸经肾排泄,另1/3的尿酸经肠道排泄[11]。人体尿酸排泄的中心是尿酸重吸收和分泌之间的动态平衡。而这一过程主要通过各种尿酸转运蛋白的参与完成,包括尿酸重吸收蛋白以及尿酸分泌蛋白、多药耐药蛋白4(MRP4)、Na+-磷酸盐转运蛋白(NPT1/NPT4)、ATP结合盒转运蛋白2(ABCG2)等[11]。其中URAT1是一种主要的尿酸重吸收转运蛋白,位于肾近端小管上皮细胞的顶端膜上,在维持尿酸稳态中起着关键作用[12]。
诊断为高尿酸血症的患者在急性痛风发作时,SUA水平有时会下降甚至在正常范围内[5-8]。这一现象已被广泛认识,同时也对于痛风的诊断造成一定影响。虽然研究发现痛风急性发作期SUA下降可能与肾尿酸排泄增加有关[8];但造成这种现象的机制并不明确。本研究讨论痛风性关节炎急性发作时SUA水平的降低是否与尿酸转运蛋白的表达量有关,以及外泌体是否在尿酸转运蛋白的表达中起作用。
本研究通过超速离心后得到的沉淀,经TEM鉴定后确认了为外泌体。通过对重悬后的外泌体进行纳米颗粒跟踪分析(Nanoparticle Tracking Analysis, NTA),结合Stockes-Einstein方程式计算并得出的外泌体颗粒流体力学直径和浓度。经NTA检测回报,正常人的外泌体直径最小,慢性缓解期痛风患者外泌体的直径与急性发作期的相差较小;而急性发作期外泌体浓度最高,慢性缓解期次之,正常人的最低。由此我们初步得出结论,外泌体的浓度与痛风性关节炎疾病活动相关。
为解不同时期外泌体对尿酸转运蛋白URAT1的影响,本研究将URAT1转染进入HEK293细胞,得到稳定表达URAT1的细胞,再经不同时期外泌体共培养后,发现在与急性发作期外泌体共培养后,与未加入外泌体的细胞相比,URAT1 mRNA表达水平明显降低。这提示我们,外泌体可能通过某种机制靶向URAT1影响其表达。
过表达URAT1 的HEK293细胞在未经外泌体或经与慢性缓解期、急性发作期外泌体共培养6 h后,加入800 μmol/L高浓度UA刺激细胞,第60分钟后尿酸浓度具有明显差异,即尿酸摄取有差异。与未加外泌体相比,加入急性发作期外泌体组尿酸摄取明显降低,慢性缓解期外泌体组亦有所下降,但无前者明显。尿酸摄取降低的原因可能是外泌体内携带的某些具有调控能力的物质,作用于URAT1,从而使得结果呈现出摄取尿酸降低的趋势。而对于慢性缓解期外泌体降低尿酸摄取的能力比急性发作期外泌体稍低,其原因可能是由于慢性缓解期的患者处于一种长期的高尿酸刺激的情况下,机体在减少尿酸摄取的同时也有了一定的耐受能力。
外泌体是细胞通过内体途径分泌到细胞外的具有生物活性的脂质双层纳米囊泡,直径为40~160 nm,可携带多种蛋白质、mRNA、miRNA等,在肿瘤、免疫、代谢性疾病中发挥着重要的调控作用[13]。
目前国内外尚未关于外泌体是否对痛风/尿酸有影响及两者相关性的研究,亦未查阅到外泌体与尿酸转运蛋白两者相关性的研究,本研究在一定程度上提供了新的痛风研究思路及方向。而且,随着药物载体系统的研究发展,外泌体作为载体已成为药物输送领域的新型治疗工具[14],这为临床上寻找新的安全有效的降尿酸药物提供了可能。
本研究尚有一些不足之处。首先,因为研究需要,所挑选血清样本的要求较为严格,故本研究收集样本较少,有待进一步增加样本量研究;其次,因为小鼠痛风模型的缺乏,我们并未进行体内动物实验,有待进行在体实验以证明我们的研究结果。
在本研究中,我们发现了外泌体可能调控了尿酸转运蛋白URAT1的功能,在之后的实验中,我们将进一步明确其分子机制,确定外泌体中具体发挥调控作用的物质,比如通过基因芯片筛选出差异表达的miRNA、预测其下游可能的靶基因等,深入探索痛风急性发作期血尿酸下降的原因。
