非诺贝特对干燥综合征小鼠Treg细胞的免疫调节作用△
2022-02-24郭星艺党维钰魏瑞华
郭星艺 粘 红 王 颖 李 娜 党维钰 魏瑞华
干燥综合征(SS)相关干眼是一种慢性炎症性自身免疫性疾病,其病理特征为大量淋巴细胞浸润泪腺,导致腺体分泌功能障碍,是较为严重和难治的干眼类型[1]。传统理论认为,Th1/Th2免疫平衡失调及其导致的细胞因子复杂网络变化对SS相关干眼的发生发展具有重要作用[2-4]。近年来研究指出,调节性T细胞(Treg)在维持机体免疫稳态及抑制炎症方面起着重要作用,与泪腺炎症密切相关[5]。研究发现,其在SS患者外周血中比例降低,并且与炎症指标如红细胞沉降率等呈负相关[6]。非诺贝特是过氧化物酶体增殖物激活受体α(PPAR-α)激动剂,早期主要用于血脂异常患者的降脂治疗[7],现发现其能够在多种自身免疫性疾病中发挥免疫调控作用。研究表明,非诺贝特可通过降低结肠中干扰素-γ(IFN-γ)和白细胞介素(IL)-17的表达,抑制结肠炎动物模型炎症反应[8],或通过上调小鼠脾脏中Foxp3和IL-10表达水平,减缓自身免疫性心肌炎进程[9]。但是其在SS相关干眼中的作用机制尚未完全明确。因此,本研究以SS相关干眼动物模型NOD小鼠为研究对象,通过喂养SS小鼠含非诺贝特的饲料,探究非诺贝特对SS相关干眼的疗效和对Treg细胞的免疫调控作用。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF级15周龄NOD/ShiLtJ雄性小鼠,体重约30 g,购自江苏集萃药康生物科技股份有限公司。实验动物的饲养及操作符合国家科学技术委员会《实验动物管理条例》的规定,并获得天津医科大学动物管理及使用委员会的批准 (批文号:TJYY20201221032)。
1.1.2 主要试剂及仪器RPMI-1640培养基(美国Gibco公司);荧光素钠注射液(美国Alcon Laboratories公司);抗小鼠CD4异硫氰酸荧光素(FITC)流式抗体、抗小鼠叉头状蛋白P3(Foxp3)巯基化藻红蛋白(PE)流式抗体、抗小鼠CD16/32抗体(美国Biolegend公司);复方托吡卡胺滴眼液(沈阳兴齐眼药股份有限公司);RNA提取试剂盒(美国EZBiocience公司);逆转录试剂盒、破膜固定试剂盒(美国Thermo公司);FastStart Universal SYBR Green Master(Rox)、LightCycler 480 PCR仪(瑞士Roche公司);FACSCalibur流式细胞仪(美国BD公司);光学显微镜(日本OLYMPUS公司);裂隙灯照相系统(重庆康华公司);酚红棉线(天津晶明新技术有限公司)。
1.2 方法
1.2.1 实验动物的分组处理雄性NOD小鼠14只,采用完全随机方法将小鼠随机分为非诺贝特组和模型组,每组7只。非诺贝特组小鼠每天给予含0.3 g·kg-1非诺贝特(Abcam公司)的标准饲料(LAD3001M,南通特洛菲饲料科技有限公司)喂养,模型组小鼠给予标准饲料喂养,共喂养8周。
1.2.2 泪液分泌试验于治疗前及治疗后4周、8周行泪液分泌试验。用眼科显微镊夹酚红棉线,置于小鼠下结膜囊中外1/3睑结膜面,计时30 s,记录变红的酚红棉线长度,实验中避免镊子造成角膜上皮损伤。计算双眼读数的平均值,重复3次。
1.2.3 角膜荧光素钠染色评分于治疗前及治疗后4周、8周行角膜荧光素钠染色评分。复方托吡卡胺滴眼液散瞳,使用移液器吸取1 μL 20 g·L-1荧光素钠溶液滴入小鼠下方结膜囊内。90 s后,在裂隙灯显微镜钴蓝滤光片下对角膜上皮损伤进行分级评分。将角膜划分为4个象限,轻微点状着染少于30个为1分;点状着染多于30个为2分;弥散着染但未形成片状为3分;片状着染为4分。4个象限之和为角膜染色评分,总分上限为16分[10]。
1.2.4 泪腺组织病理学观察治疗后8周,麻醉处死,剪开小鼠眼外眦部与耳根下方的皮肤及皮下组织,钝性分离泪腺。取出泪腺后,固定在体积分数10%福尔马林液中,进行石蜡包埋,连续切片,苏木精-伊红(HE)染色。光学显微镜观察HE切片,使用ImageJ软件测量淋巴细胞浸润面积和泪腺总面积,计算浸润面积百分比[11]。对同一泪腺标本3张非连续切片进行数据采集,取平均值进行统计分析。
1.2.5 实时荧光定量PCR检测泪腺中Foxp3、IL-10 mRNA相对表达量治疗后8周,按照RNA提取试剂盒说明书提取小鼠泪腺总RNA,利用逆转录试剂盒合成cDNA,以cDNA为模板,按照说明书进行实时荧光定量PCR检测,反应条件为:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火及延伸1 min,共40个循环。以GAPDH为内参,用2-ΔΔCt法分析泪腺中Foxp3、IL-10 mRNA相对表达量。其中,GAPDH引物序列:正向为5’-CATGGCCTTCCGTGTTCCTA-3’,反向为5’-GCGGCACGTCAGATCCA-3’; Foxp3引物序列:正向为5’-CCCTGCCCTTGACCTCAA-3’,反向为5’-GCCTCAGTCTCATGGTTTTGG-3’;IL-10引物序列:正向为5’-GATGCCCCAGGCAGAGAA-3’,反向为5’-CACCCAGGGAATTCAAATGC-3’。
1.2.6 流式细胞仪检测小鼠脾脏中Treg细胞比例治疗后8周,分离小鼠脾脏并研磨得到单个核细胞悬液,抗小鼠CD16/32抗体冰上孵育10 min,封闭细胞表面Fc受体,加入抗小鼠FITC-CD4抗体4 ℃避光孵育20 min,洗涤细胞,在破膜固定液中4 ℃避光过夜。第2天,加入抗小鼠PE-Foxp3抗体室温避光孵育60 min。洗涤细胞,流式细胞仪检测小鼠脾脏中Treg细胞比例。
1.3 统计学方法采用GraphPad Prism 8.0.1统计软件进行统计学处理与分析。计量资料数据以均数±标准差表示,用Shapiro-Wilk检验数据正态性,Levene检验方差齐性。两组之间比较采用独立样本t检验。检验水准:α=0.05。
2 结果
2.1 两组小鼠角膜荧光素钠染色评分比较治疗前模型组和非诺贝特组小鼠角膜均有荧光素钠着染,角膜染色评分分别为(4.71±0.95)分和(4.86±0.69)分,两组间差异无统计学意义(P=0.753)。治疗后4周、8周,模型组小鼠角膜荧光素钠着染较明显,可见片状着色区,非诺贝特组小鼠角膜着染范围明显小于模型组(图1)。治疗后4周、8周,非诺贝特组小鼠角膜染色评分分别为(4.00±1.63)分和(4.43±1.51)分,明显低于模型组的(7.43±1.90)分和(8.43±1.90)分,差异均有统计学意义(P=0.003、0.001)。
2.2 两组小鼠泪液分泌量比较治疗前模型组和非诺贝特组小鼠泪液分泌量分别为(2.35±0.55)mm和(2.29±0.46)mm,两组间差异无统计学意义(P=0.831)。治疗后4周、8周,非诺贝特组小鼠泪液分泌量分别为(4.40±1.47)mm和(5.47±0.87)mm,较模型组(2.66±0.72)mm和(2.71±0.76)mm均明显增加,差异均有统计学意义(P=0.016、0.000)。
2.3 两组小鼠泪腺炎症浸润面积比较泪腺HE染色结果显示,模型组小鼠大面积淋巴细胞浸润灶围绕在腺管周围,破坏了腺管、腺泡等结构(图2)。治疗后8周,非诺贝特组小鼠泪腺淋巴细胞浸润减少,部分泪腺腺管、腺泡结构保留完整,浸润面积百分比为(13.44±2.49)%,较模型组[(18.49±2.33)%]明显减少,差异有统计学意义(P=0.002)。
2.4 两组小鼠泪腺中Foxp3及IL-10 mRNA相对表达量比较实时荧光定量PCR检测结果显示,治疗后8周,非诺贝特组小鼠泪腺中Foxp3及IL-10 mRNA相对表达量分别为1.53±0.35、1.61±0.51,明显高于模型组的1.03±0.05、1.00±0.01,差异均有统计学意义(P=0.002、0.008)。
2.5 两组小鼠脾脏中Treg细胞比例的比较治疗后8周,分离各组小鼠脾脏细胞,流式细胞仪检测Treg细胞比例,结果显示,非诺贝特组小鼠脾脏中Treg细胞比例为(8.25±1.13)%,明显高于模型组的(5.89±1.31)%,差异有统计学意义(P=0.003)(图3)。
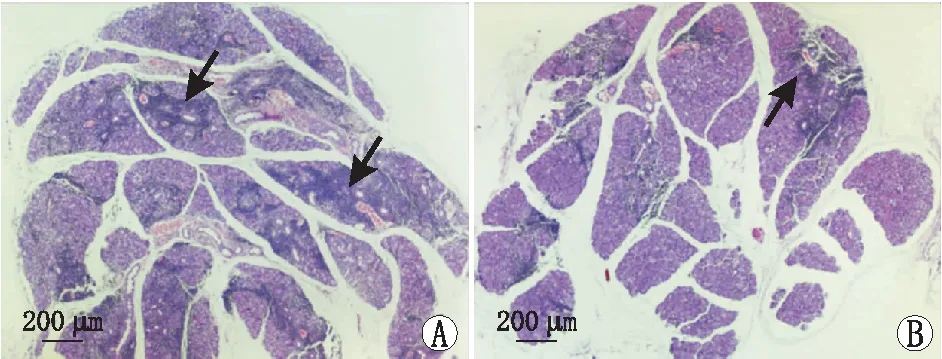
图2 模型组(A)和非诺贝特组(B)小鼠泪腺切片HE染色 注:黑色箭头示泪腺内炎症细胞浸润。
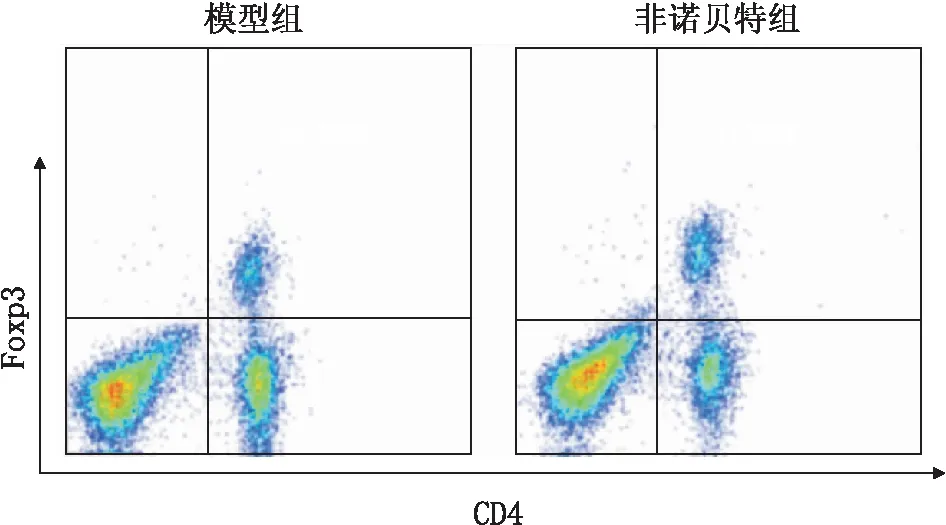
图3 模型组和非诺贝特组小鼠脾脏中Treg细胞比例
3 讨论
目前,SS相关干眼的药物治疗效果有限,人工泪液仅能缓解症状不能根治干眼,具有抗炎作用的免疫抑制剂长期应用有较大的副作用,如肝或肾功能损害、胃肠道不适及中枢神经系统症状等,因此,寻找安全有效的治疗方法是眼科临床亟待解决的问题[12-13]。非诺贝特属于氯贝特类调脂药,应用于临床已有半个多世纪,除了降血脂的作用外,还具有显著的抗炎作用。近年来研究显示[9,14-16],在实验性自身免疫性心肌炎、脑脊髓炎、1型糖尿病中,非诺贝特能够有效抑制体内的自身免疫反应。Osada等[17]研究发现,非诺贝特可改善自身免疫性葡萄膜炎的临床评分,缓解小鼠视网膜炎症反应。但非诺贝特对SS相关干眼所致泪腺炎症的作用尚未见报道。
NOD小鼠是理想的SS相关干眼模型小鼠,能够较好地模拟人SS相关干眼的特点[18]。雄性小鼠可自发地产生干眼,在12~16周出现泪腺功能障碍,且随着周龄增加症状加重[19]。雌性小鼠未表现出泪腺炎症和分泌功能丧失,却在16~20周出现严重的唾液腺浸润,并伴有糖尿病表现[20]。雄性小鼠比雌性小鼠更容易发生泪腺炎症、泪液减少和角膜炎症,因此,本研究采用雄性NOD小鼠作为SS相关干眼模型鼠。
本研究中,我们通过给NOD小鼠喂养含或不含非诺贝特的饲料,首次探讨了非诺贝特对SS相关干眼的作用。我们发现非诺贝特组小鼠泪液分泌量显著增加,角膜荧光素钠染色着色明显减轻。与此临床结果相一致的是,组织病理学切片也显示泪腺组织中非诺贝特组小鼠淋巴细胞浸润显著减轻。有研究证实,用苯扎氯铵诱导的干眼小鼠模型局部使用非诺贝特滴眼后角膜上皮缺损面积明显缩小,泪膜破裂时间增加[21],这和本研究结果相似。
SS相关干眼是由多种因素导致的泪腺相对特异性自身免疫病,确切发病机制至今尚未完全明确。Treg细胞是一类特异表达转录因子Foxp3且具有免疫负性调节功能的CD4+T细胞,可通过细胞直接接触及分泌抑制性细胞因子(主要为IL-10)等途径发挥抗炎和维持自身免疫耐受的作用[22]。大量研究表明,NOD小鼠Treg细胞的数量和功能存在缺陷[23-26]。Lieberman等[27]通过过继转移实验进一步证实,雄性NOD小鼠泪腺Treg细胞功能缺陷是导致其自身免疫性泪腺炎发生的主要原因。另外,研究发现泪腺中Treg细胞数量增多可有效改善干眼症状,增加杯状细胞密度和角膜上皮完整性[28],延缓自身免疫性泪腺炎的发展[29]。Zhou等[30]体外实验证明,非诺贝特促进小鼠CD4+T细胞向Treg细胞的分化,本研究中非诺贝特治疗显著增加脾脏中Treg细胞比例,与报道结果相符。研究表明,与健康对照者相比,SS患者血清中IL-10显著下降[31]。IL-10是发挥免疫抑制作用的主要细胞因子,主要由Treg细胞分泌。本研究结果发现,非诺贝特组小鼠泪腺IL-10表达水平上升,提示局部泪腺组织中Treg细胞的免疫抑制能力增强。Treg细胞分化成熟过程和功能与转录因子Foxp3密切相关,Foxp3基因缺陷可导致Treg细胞功能下降,提示Foxp3对于维持Treg细胞功能至关重要[32]。本研究结果发现,非诺贝特显著上调小鼠泪腺中Foxp3表达水平,既往报道也支持了本研究结果:Chang等[33]发现在体外培养的自身免疫性心肌炎大鼠的CD4+T细胞中,非诺贝特增强其Foxp3基因表达。综上所述,非诺贝特可能通过促进Treg细胞的分化和功能,促进抑炎因子分泌,从而减轻组织的损害和疾病的进展。
本研究结果表明,非诺贝特可明显减轻NOD小鼠的干眼症状,为SS相关干眼的治疗提供实验基础和理论依据。本研究的局限性在于,我们仅检测不同时期小鼠角膜荧光素钠染色和泪液分泌量,但缺乏对各组小鼠泪腺组织病理学的动态观察,需进一步探索以完善研究。
