电针大脑中动脉闭塞模型大鼠血清减轻体外新生乳鼠神经细胞的缺糖低氧损伤的作用研究
2022-02-24李笑笑李姝洁董健健韩永升
李笑笑,李姝洁,董健健,韩永升,3
(1.安徽中医药大学研究生院,安徽 合肥 230012;2.安徽中医药大学神经病学研究所,安徽 合肥 230038;3.安徽省中西医结合医院,安徽 合肥 230031)
缺血性脑卒中主要是由血管阻塞导致大脑特定区域的血液供应减少而引发,其病理生理涉及一系列有害级联信号的激活,包括兴奋性毒性损伤、氧化和亚硝化应激、神经炎症等[1]。重组组织型静脉纤溶酶原激活剂阿替普酶(recombinant tissue type plasminogen activator,rt-PA)溶栓和机械取栓是当前治疗缺血性脑卒中的两大主要策略,但二者均有一定的局限性,临床获益者较少[2-3]。
电针是传统针刺与电流刺激的结合,其可通过多途径、多靶点有效治疗缺血性脑卒中[4-5]。课题组前期研究发现,电针通过上调脑组织内神经生长相关蛋白-43(growth associated protein-43,GAP-43)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、突触囊泡蛋白(synaptophysin,SYN)表达水平,下调勿动蛋白A(neurite outgrowth inhibitor-A,Nogo-A)表达水平,促进局灶性脑梗死大鼠神经和运动功能的恢复[6-8],对神经血管单元有保护作用[9],且该作用与激活Wnt/β-catenin信号通路密切相关[10]。“针刺血清”是受“中药血清学”的启发,为克服体内实验的局限性而提出的一种新的研究思路。“针刺血清”指的是将针刺处理后采集的血清作为效应物质加入另一个反应系统中,同体内或体外器官、组织、细胞或分子等靶目标接触,通过它们功能或形态学的改变,直接地观察针刺处理后产生的效应[11]。现为进一步验证电针对缺血性脑卒中的治疗作用以及可能的作用机制,本研究以前期发现为基础,通过糖氧剥夺/复氧(oxygen-glucose deprivation and reoxygenation,OGD/R)构建脑神经细胞的体外缺血模型,并将采集的“电针血清”作为效应物质加入体外培养的皮质神经细胞中,观察“电针血清”对体外神经细胞缺糖低氧损伤的作用及可能的作用机制,将体内研究与体外验证相结合,从宏观和微观层面揭示针刺治疗缺血性脑卒中的作用机制,为临床治疗提供新的理论依据。
1 材料
1.1 试剂 DMEM/F12培养基(批号 AG29643149):美国Hyclone公司;Neurobasal(批号 2239681)、胎牛血清(批号 2305262RP)、B-27 Supplement(50×)(批号 2060739):美国Gibco公司;阿糖胞苷(批号 4091021)、丙二醛(malondialdehyde,MDA)检测试剂盒(批号 BC0025)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(批号 BC0175):北京索莱宝科技有限公司;兔抗Wnt1多克隆抗体(批号 251822):成都正能生物;兔抗β连环蛋白(β-catenin)多克隆抗体(批号 8480)、兔抗神经细胞核抗原(neuronal nuclear protein,NeuN)多克隆抗体(批号 24307):美国CST公司;兔抗糖原合成酶激酶3β(glycogen synthase kinase,3β,GSK-3β)多克隆抗体(批号 ab32391):英国Abcam公司;辣根酶标记山羊抗兔IgG(H+L)(批号 ZB-2301):北京中杉金桥生物技术有限公司。
1.2 试剂配制 神经细胞种板液:DMEM/F12培养基+1%双抗+10% Gibco胎牛血清,完全神经细胞培养基:Neurobasal 49 mL+B-27添加剂(50×)1 mL+双抗250 μL+L-谷氨酸15 mg。
1.3 实验仪器 生物安全柜(BSC-1300 Ⅱ A2):苏州安泰空气技术有限公司;CO2培养箱(GOLD-SIM W200IR):美国SIM公司;荧光倒置相差显微镜(OLYMPUS CKX41):日本Olympus公司;解剖显微镜(XTZ-D型):上海光学仪器一厂;全波长酶标仪(Bio Tek Epoch2):美国Biotek公司;电泳仪(Powerpac Basic):美国伯乐公司;电针仪(G6805-2A):上海华谊医用仪器有限公司;一次性无菌针灸针(13 mm×0.18 mm):吴江云龙医疗器械有限公司。
2 方法
2.1 “电针血清”的制备 选择SPF级健康雄性SD大鼠36只,2~3月龄,体质量250~300 g,购自济南朋悦实验动物繁育有限公司[生产许可证号:SCXK(鲁)2019-0003]。大鼠于常规实验室动物房饲养,环境温度为24~26 ℃,相对湿度为50%~60%,保持通风,12 h光照,自由摄食、饮水,喂养7 d后进行实验。将大鼠随机分为对照组、模型组、电针组,每组12只。依据肖宗宇等电凝法[12]复制大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)大鼠模型。对照组仅打开颅骨不进行电凝,模型组于模型复制后常规饲养,电针组于模型复制后以电针刺激“百会”“水沟”、双侧“三阴交”、双侧“内关”穴,疏密波,2/100 Hz,2~4 V,留针30 min,连续7 d。7 d后采用10%水合氯醛(1 mL/kg)麻醉各组大鼠,无菌条件下腹主动脉采血,静置3 h,待血清充分析出后,3 000 r/min离心15 min,0.22 μm滤器过滤分装,56 ℃灭活30 min,-20 ℃保存备用。
2.2 原代皮质神经细胞的分离与培养 参考文献[13],将多聚赖氨酸工作液铺六孔板,PBS洗板备用。超净台内分离新生24 h内SD大鼠乳鼠皮质神经细胞,采用胰酶消化,神经细胞种板液终止消化,200目筛网过筛,滤液以800 r/min,离心5 min,弃上清,神经细胞种板液重悬细胞3次,分别以1 800、2 000、2 500 r/min离心5 min,弃上清;最后以(1×106~1×107)/mL密度重悬细胞并接种于6孔板内。待细胞贴壁后,采用完全神经细胞培养基半量换液,以阿糖胞苷抑制非皮质神经细胞的生长。每2~3 d用完全神经细胞培养基半量换液1次。7 d后,采用免疫荧光细胞化学法鉴定神经细胞。
2.3 实验分组及干预方法 将原代皮质神经细胞随机分为对照组、模型组、“电针血清”组。模型组先以含对照组大鼠血清的培养基培养24 h,再以用无糖、无血清培养基置换,并于5% CO2、1% O2、94% N2、37 ℃的培养箱中培养2 h,2 h后将培养基更换成无血清含糖培养基,并于5% CO2、37 ℃的培养箱中培养24 h,建立OGD/R模型。对照组先以含对照大鼠血清的培养基培养24 h,然后更换为无血清含糖培养基并置于5% CO2、37 ℃的培养箱中继续培养。“电针血清”组先以含“电针血清”的培养基培养24 h,再进行糖氧剥夺2 h,最后复糖复氧24 h。
2.4 观察指标及检测方法
2.4.1 “电针血清”浓度的确定 将原代皮质神经细胞分为对照组、“电针血清”组。对照组和“电针血清”组分别以无血清培养基,含5%、10%、15%、20%“电针血清”的培养基培养24 h,然后各组进行糖氧剥夺2 h后复糖复氧24 h处理。干预结束后,每组继续加入培养液容积10%的细胞计数试剂盒-8(cell counting kit-8,CCK-8)溶液,并置于37 ℃培养箱中孵育1.5 h。孵育结束后,各组分别吸取100 μL的培养液于96孔板中,同时设置空白组即仅加入100 μL PBS。采用酶标仪测定各组在450 nm处的吸光度(A),并计算各组神经细胞的生存率。神经细胞生存率=[A(“电针血清”组)-A(空白组)]/[A(对照组)-A(空白组)]。通过比较各组神经细胞的生存率确定“电针血清”干预的最适浓度。
2.4.2 MTT法检测各组神经细胞的存活率 将皮质神经细胞接种于96孔板内,待细胞贴壁后去除原培养液。依据不同干预方法处理后,MTT法检测各组神经细胞存活率。
2.4.3 TUNEL法检测神经细胞凋亡率 将皮质神经细胞接种于置有细胞爬片的6孔板内,待细胞长满80%~90%时,吸弃原培养液,并按照分组依据进行干预。干预结束后PBS清洗两遍,多聚甲醛室温固定20 min。严格按照TUNEL染色试剂盒说明书步骤操作,最后在荧光显微镜下观察摄片。使用Image J分析照片,采用Graphpad prism 9软件作图,神经细胞凋亡指数以TUNEL阳性神经细胞与所有神经细胞的比值表示。
2.4.4 乳酸脱氢酶(lactate dehydrogenase,LDH)漏出水平和SOD活性、MDA水平的检测 取各实验组培养液100 μL,依据LDH检测试剂盒说明书操作,在酶标仪450 nm波长处检测吸光度值;分别收集各组细胞,依据SOD检测试剂盒说明书操作,在酶标仪560 nm波长处检测吸光度值,根据公式计算出各组细胞SOD活性;依据MDA检测试剂盒说明书操作,在酶标仪450、532、600 nm波长处检测吸光度值,根据公式计算出各组细胞MDA含量。
2.4.5 Western blot法检测各组目的蛋白表达水平 收集各组细胞,加入PMSF和RIPA裂解液混合,冰浴摇床上裂解30 min,每10 min混匀一次。4 ℃、12 000 r/min离心30 min,取上清,加入蛋白上样缓冲液后,立即采用100 ℃水浴加热8 min,-80 ℃冰箱保存备用。以BCA-微孔酶标仪法检测各组蛋白样品浓度。以12%聚丙烯酰胺凝胶电泳分离蛋白,然后将蛋白转移到NC膜上。用含5%脱脂奶粉的PBST封闭液常温摇床封闭4 h或4 ℃摇床孵育过夜。用PBST于摇床洗涤3遍,与一抗抗体常温摇床孵育4 h或4 ℃摇床孵育过夜(β-actin 1∶1 000、Wnt1 1∶1 000、GSK-3β 1∶5 000、β-catenin 1∶1 000、NeuN 1∶1 000),PBST缓冲液洗涤3次,将NC膜与二抗(1∶10 000)在室温摇床孵育1.5 h。使用ECL化学发光试剂盒进行曝光,运用Image J软件分析条带灰度值,以目的蛋白与内参蛋白灰度值的比值作为该蛋白的表达量。
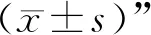
3 结果
3.1 “电针血清”对原代神经细胞OGD/R后生存率的影响 CCK-8实验结果显示,OGD/R后,15%“电针血清”组神经细胞的存活率最高,其值为(3.19±0.14)%,与其他浓度血清干预下的存活率比较,差异有统计学意义(P<0.05)。故以15%“电针血清”作为后续实验的体外干预浓度。见图1。

注:与其他各浓度“电针血清”组比较,*P<0.05
3.2 “电针血清”对OGD/R诱导神经细胞凋亡的抑制作用 OGD/R后神经细胞生存率显著降低,而“电针血清”干预后,神经细胞生存率显著升高(P<0.05)。TUNEL染色结果提示,对照组仅有少量神经细胞凋亡,模型组神经细胞凋亡数量显著增多,而“电针血清”组神经细胞凋亡数量显著减少(P<0.05)。结果提示“电针血清”对OGD/R诱导的神经细胞凋亡有显著的抑制作用。见图2。

注:A.对照组;B.模型组;C.“电针血清”组;蓝色荧光代表所有细胞核,绿色荧光代表TUNEL阳性核;与对照组比较,*P<0.05;与模型组比较,#P<0.05
3.3 “电针血清”减轻OGD/R后神经细胞的氧化应激损伤作用 与对照组比较,模型组SOD活性显著降低(P<0.05),MDA、LDH含量增多(P<0.05);与模型组比较,“电针血清”组SOD活性显著升高(P<0.05),MDA、LDH含量显著减少(P<0.05)。以上结果表明,OGD/R后神经细胞SOD活性下降,自由基增多,促进MDA产生和LDH漏出,引发神经细胞的氧化应激损伤,而“电针血清”干预后可起到逆转作用。见图3。

注:A.对照组;B.模型组;C.“电针血清”组;与对照组比较,*P<0.05;与模型组比较,#P<0.05
3.4 “电针血清”对Wnt/β-catenin信号通路的作用 与对照组比较,模型组Wnt-1、GSK-3β、β-catenin、NeuN蛋白表达水平显著降低(P<0.05),提示OGD/R诱导神经细胞损伤,且Wnt/β-catenin信号通路被抑制;与模型组比较,“电针血清”组Wnt-1、β-catenin、NeuN蛋白表达水平显著升高(P<0.05),GSK-3β表达水平显著降低(P<0.05),提示“电针血清”激活Wnt/β-catenin信号通路并减轻神经细胞损伤。见图4。

注:A.对照组;B.模型组;C.“电针血清”组;与对照组比较,*P<0.05;与模型组比较,#P<0.05
4 讨论
缺血性脑卒中引起脑组织损伤的分子机制复杂多样,涉及多个损伤级联反应的发生[14]。氧化应激是脑卒中重要的生理病理机制,也是脑缺血再灌注损伤触发级联反应的关键环节[15]。活性氧(reactive oxygen species,ROS)、活性氮(reactive nitrogen species,RNS)被证实是急性缺血性脑卒中组织损伤的重要递质[16]。MDA是ROS作用于脂质发生过氧化的终产物,也是反映氧化应激最常用的生物学指标[17]。脑卒中患者血浆MDA水平较健康人明显升高[18]。LDH广泛分布于各类细胞中,是稳定的胞浆酶,当细胞膜损伤时快速释放到细胞外,常被用来检测细胞损伤或细胞死亡[19]。本实验结果显示,与对照组比较,模型组SOD活性显著降低,LDH、MDA水平显著升高,细胞凋亡明显增多,提示OGD/R诱导神经细胞发生氧化应激损伤并引发细胞凋亡。
针刺对缺血性脑血管病有着良好的治疗效果,可通过改善脑血流、调节中枢神经系统兴奋性、减轻炎症反应、调控相关基因及蛋白的表达等多个途径保护血管和神经细胞[20]。以往对针刺效应的研究大多通过体内实验完成,并不能直观表明针刺临床有效性的作用机制。“针刺血清”概念的提出,促进了针刺体外实验的发展。当前“针刺血清”的研究范围涉及多个系统,具有延缓衰老、抗感染、抗癌等临床疗效[21]。本实验在课题组前期研究的基础上,将采集的“电针血清”加入体外皮质神经细胞内,以观察“电针血清”的效应。结果显示,“电针血清”组干预后神经细胞的氧化应激水平显著降低,神经细胞凋亡明显减少,提示电针干预后产生的效应物质具有抗氧化应激、抗凋亡的作用。相关研究[22-23]也发现,针刺在治疗缺血性脑卒中过程中参与调控氧化还原分子信号通路,激活固有抗氧化酶系统,抑制ROS的过度生成,修复ROS攻击的DNA、脂质和蛋白质,抑制ROS通路引起的细胞凋亡和自噬。“针刺血清”对多种体外神经细胞和神经胶质细胞均有积极影响,具有保护神经细胞、修复神经系统损伤的作用[24]。ROS蓄积和Ca2+超载是缺血再灌注损伤病理学中相互交织的两个主要因素,Ca2+超载可以通过多种机制引起ROS的增加,而ROS增多可以促进肌浆网中Ca2+的释放[25]。研究[26-28]表明,脑缺血后神经细胞内Ca2+浓度升高,“针刺血清”干预不仅能降低正常神经细胞内Ca2+浓度,同时能减少缺血区神经细胞内Ca2+含量。基于此,笔者推测“电针血清”的某种活性成分可能是通过缓解Ca2+超载,进而减轻神经细胞的氧化应激损伤。
Wnt/β-catenin信号通路是当前研究最多的经典Wnt通路,β-catenin是调控该通路的关键部分[29]。Wnt/β-catenin信号通路与中枢神经系统关系密切,是中枢神经系统血管化、血脑屏障形成和胚胎发育成熟的基础,脑卒中发生后出现Wnt/β-catenin信号通路的失调,激活该通路可促进缺血损伤后神经血管的修复[30]。NeuN是一种仅在神经细胞内表达的蛋白质,广泛用于神经细胞分化的免疫组织化学研究,常用来评估生理病理过程中神经细胞的功能状态[31]。本实验结果显示,模型组Wnt/β-catenin通路相关蛋白Wnt-1、GSK-3β、β-catenin、NeuN表达水平显著降低,提示OGD/R引起Wnt/β-catenin信号通路的失调和神经细胞损伤;而“电针血清”组Wnt-1、β-catenin、NeuN表达水平显著升高,GSK-3β表达水平显著降低,提示“电针血清”激活Wnt/β-catenin信号通路并减轻神经细胞损伤。该发现与课题组前期研究结果一致[10]。
综上所述,本实验以“针刺血清”的理论研究方法为基础,将电针治疗后所得的效应血清加入体外培养的原代皮质神经细胞内,排除体内复杂的生化影响,在体外单一环境下观察神经细胞的改变。实验结果表明,“电针血清”在一定程度上提高氧化应激相关生物学指标SOD的活性,降低MDA、LDH水平,减少神经细胞损伤,具有抗氧化、抗凋亡作用,且该作用与激活Wnt/β-catenin信号通路密切相关。本实验从体外微观角度证实了电针的治疗作用,但由于“电针血清”的有效成分复杂多样,其具体的效应物质和作用靶点仍需要进一步深入探究。
