食用槟榔中霉菌和酵母的测量不确定度评定
2022-02-23赵志友
袁 河,周 稳,包 骏,张 艳,赵志友
(湖南省槟榔加工与食用安全工程技术研究中心,湖南宾之郎食品科技有限公司检测中心,湖南 湘潭411100)
槟榔,是一种棕榈科槟榔属常绿乔木的果实,又称宾门、槟楠、大白槟、仁频、仁榔、洗瘴丹等。槟榔的种子、果皮、花皆可入药,是传统的中药材。槟榔虽然没有被列入药食同源名录,但人类嚼食槟榔的历史可追溯数千年。朱利明[1]在《寻味槟榔》一书中介绍道,世界上槟榔的年产量近100万t,嚼食人数超过10亿人,约占世界人口总数的15%。世界上槟榔的主要生产国依次为印度、中国、孟加拉国,其他重要生产国还有缅甸、泰国、越南、印度尼西亚和斯里兰卡。我国95%的槟榔来自海南。2017年海南省新栽种面积28.35 km2,累计栽种面积首次突破1 000 km2,达到1 025.3 km2。据《海南统计年鉴2018》[2],2017年海南省共产槟榔255 114 t,其中,琼海市产42 079 t,万宁市产41 063 t,琼中县产25 785 t,此三地产量排名前三。槟榔虽然可以用作药品,但大部分原料产品却不流向药材市场,而是用于简单加工制成商品槟榔来销售。从20世纪90年代至今,湖南槟榔已经从原来的作坊式发展到工业化、自动化,销售区域扩散到全国,年销售额数百亿,已然是一个不容忽视的食品行业。
湖南槟榔成品水分含量一般维持在23%~26%,但不属于高温杀菌食品,微生物风险较高。近年来随着行业逐渐成熟,微生物的控制情况向良好方向发展。随着槟榔行业对微生物控制的要求提高,微生物检测的准确性和可靠性越来越受到重视。槟榔产品水分较高,制作时不经过高温杀菌,且在检测取样制备样液时槟榔不经切割分散,其他食品微生物检测经验放在槟榔上可能存在较大的误差。然而,目前尚无槟榔微生物测量不确定度的分析报道。因此,本研究建立槟榔中霉菌和酵母定量检测测量不确定度评定的方法,以期为槟榔行业的微生物检测准确度提供参考。
1 材料与方法
1.1 材料
1.1.1 测试样品
测试样品均取自生产过程中经发籽工艺处理后的槟榔。
1.1.2 主要设备和材料
培养箱(28℃±1℃),天津市意博高科技实验有限公司;拍击式均质器及均质袋,青岛众瑞只能仪器有限公司;电子天平(感量0.1 g),奥豪斯(常州)仪器有限公司;恒温水浴箱(46℃±1℃),天津市泰斯特仪器有限公司。
1.1.3 培养基
质量分数为0.85%的生理盐水;孟加拉红琼脂,郑州益康化工产品有限公司。
1.2 实验步骤与计数方法
按文献[3]第一法执行。霉菌和酵母分开计数。
2 不确定度的来源分析及评定
2.1 数学模型的建立
霉菌和酵母的计数方法参照文献[3],其中,若只有一个稀释梯度的2个平板菌落数在10~150 CFU/g,则按式(1)计算。
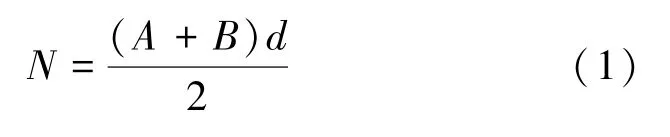
若有2个连续稀释梯度的平板上菌落数在10~150 CFU/g,则按式(2)计算。
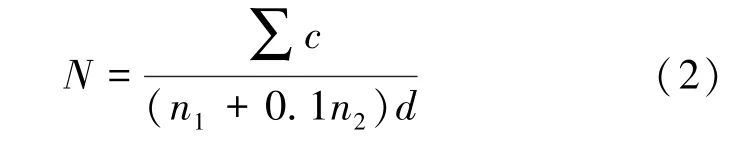
式中:N为样品中菌落数,其中,用NX表示霉菌计数,用NY表示酵母计数;A为平行实验中平板1的计数;B为平行实验中平板2的计数;∑c为平板(含适宜范围菌落数的平板)菌落数之和;n1为第一稀释度(低稀释倍数)平板个数;n2为第二稀释度(低稀释倍数)平板个数;d为稀释因子(第一稀释度)。
2.2 均匀性引入的不确定度
样品的不均匀性是带来不确定度的重要因素。本研究的样品均按照GB 4789.1—2016的规定[4],将样品充分混合后随机取样。因此,可认为样品是均匀的,在此忽略由取样的不均匀性带来的不确定性。
2.3 样品称量引入的不确定度
因为单颗槟榔质量较大,且为了避免交叉污染而不对其进行切片处理,所以称质量时难以精确到25.0 g。为了方便操作,允许取样在(25.0±1.0)g,这属于均匀分布,所以由样品称量引入的标准不确定度为
电子天平引起的不确定度:本实验所用的电子天平最大量程为1 000 g,允许误差为±0.1 g。根据JJF 1059.1—2012的规定[5],由数据修约、测量仪器最大允许误差或分辨力、参考数据的误差限、度盘或齿轮的回差、平衡指示器调零不准、测量仪器的滞后或摩擦效应导致的不确定度,通常假设为均匀分布,因此由电子天平引入的标准不确定度为
由样品称量引入的标准不确定度为

因此,相对标准不确定度为

2.4 样液制备引入的不确定度
样液制备需使用250 mL量筒量取225 mL无菌生理盐水加入称量好的25.0 g样品中。根据JJG 196—2006的规定[6],20℃时量入式量筒的容量允许差为±2.0 mL,属于B类评定。根据《化学分析中不确定度的评估指南》[7],此项属于三角分布,样液制备引入的不确定度为

因此,相对标准不确定度为

2.5 梯度稀释引入的不确定度
梯度稀释是指采用1 mL无菌吸头吸取不同稀释级溶液1 mL至9 mL无菌生理盐水的过程。这一过程中用1 mL移液器来移取1 mL不同稀释级溶液,用5 mL移液器来制备9 mL无菌生理盐水。根据JJG 646—2006的规定[8],当检定点为500 μL和1 000 μL时,1 mL移 液 器 的 容 量 允 许 误 差为±1.0%;当检定点为2 500 μL和5 000 μL时,5 mL移液器的容量允许误差分别为±0.5%和±0.6%,在此按±0.6%计。这属于B类评定。按三角分布取每吸取1 mL稀释溶液时引入的标准不确定度为

因此其相对标准不确定度为

每吸取9 mL生理盐水时引入的标准不确定度为

因此其相对标准不确定度为

本研究取第1~3个稀释度(10-1、10-2、10-3)进行实验和计数,稀释过程共进行了3次,则稀释过程引入的合成相对标准不确定度为
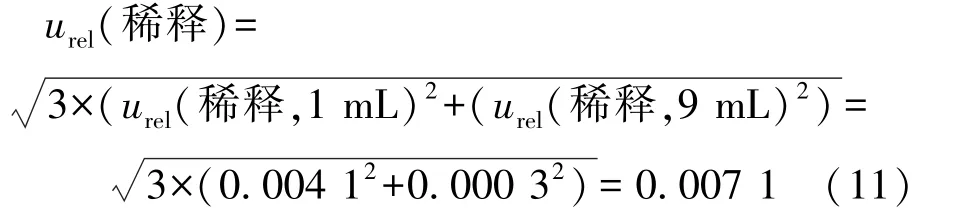
2.6 接种体积引入的不确定度
本研究选择3个梯度的混合均匀的样液,分别吸取1 mL样品匀液于2个无菌平皿内。因此其引入误差有6个样品。根据JJG 646—2006的规定[8],1 mL移液器的容量允许误差为±1%。按三角分布,因此,其引入的标准不确定度为
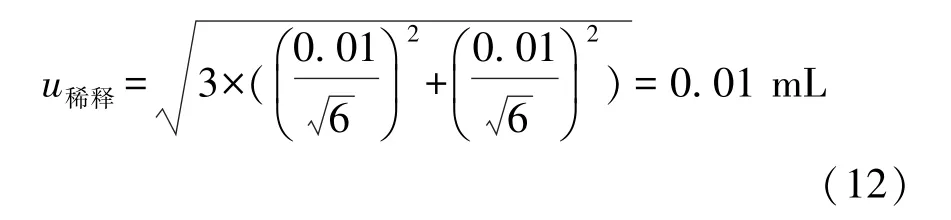
因此,相对标准不确定度为

2.7 重复性检测引入的不确定度
重复性检测过程不可避免地产生大量随机性误差,得到的检测数据往往呈近似正态分布。重复性检测是引入不确定度最重要的因素之一,在分析检测方法的不确定度时尤其需要注意。因为微生物的特性,微生物检测数据发散性大,不适合直接使用数据进行不确定度分析,而需要以微生物计数的对数值来分析不确定度。表1是重复性检测引入的不确定度属于A类评定,可以借助贝塞尔公式来计算检测结果对数值的样品标准偏差,从而进一步求得重复性检测引入的不确定度。霉菌和酵母总数的检测结果及残差平方的计算结果如表1所示。
2.7.1 重复性检测引入的霉菌的标准不确定度的计算
根据表1的检测及计算结果,霉菌计数的对数单次测量的标准偏差为
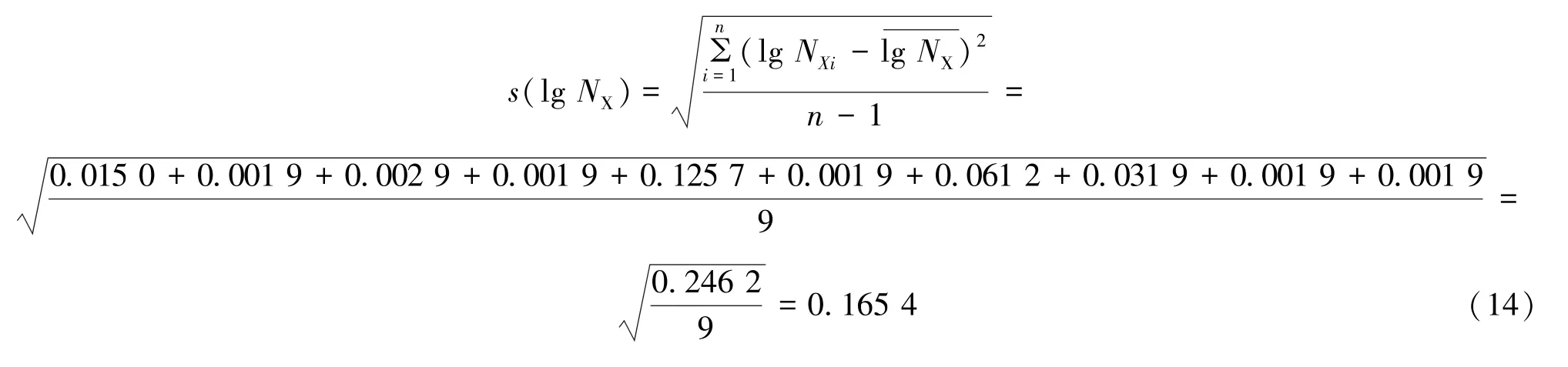
霉菌计数的对数单次测量的标准不确定度为

霉菌计数的对数单次测量的相对标准不确定度为

2.7.2 重复性检测引入的酵母的标准不确定度的计算
根据表1的检测及计算结果,酵母计数的对数单次测量的标准偏差为

酵母计数的对数单次测量的标准不确定度为
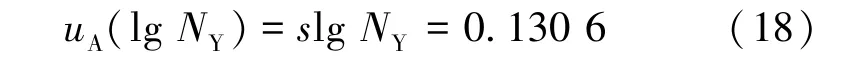
酵母计数的对数单次测量的相对标准不确定度为

2.8 槟榔中霉菌和酵母的不确定度评定
2.8.1 霉菌和酵母的合成标准不确定度
由于不同的标准不确定度分量具有不同的单位,因此需要计算不同标准不确定度分量的的相对标准不确定度来求得合成相对标准不确定度,再根据平均检测值即可求得整体的合成标准不确定度。
因此,霉菌的合成相对标准不确定度为

酵母的合成相对标准不确定度为:

则霉菌的合成标准不确定度为
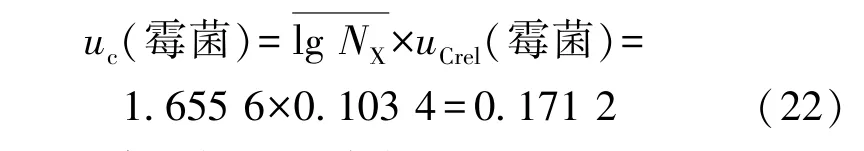
酵母的合成标准不确定度为
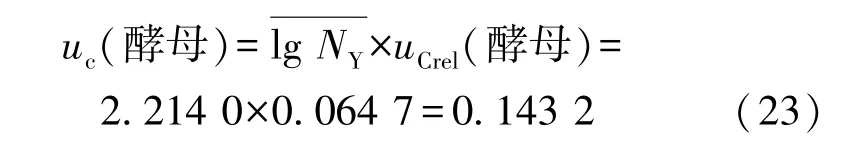
2.8.2 霉菌和酵母的扩展不确定度
根据标准不确定度的原理,标准不确定度给出测量结果所在的区间,只是被测量值可能出现的一部分,其可信程度不高(如正态分布只占68.27%),为了提高对测量结果所在区间评定的可信程度,通常提供给客户的应是特定包含概率下的扩展不确定度。据此告知用户检测和校准结果就在以报告值为中心的包含区间内,扩展不确定度由合成不确定度乘以适当的包含因子k得到[9]。
在本研究的重复检测中共检测了10个样品,根据GB 4789.15—2016的规定[3],每份检测3个梯度,每个梯度平行2份,表1中的检测值是已经过计算后的值。因此,取自由度v=9,检测值近似正态分布,取置信水平95%。根据JJF 1059.1—2012的规定[5],当估计值NY的数值和它的合成不确定度uc(NY)所表征的概率分布近似为正态分布时,且uc(NY)的有效自由度较大情况下,若k=2,则u=2uc所确定的区间的包含概率约为95%。在通常测量中,一般取k=2。因此,在此取k=2。
槟榔中霉菌检测的扩展不确定度为

槟榔中酵母检测的扩展不确定度为

2.9 结果报告
根据上述计算得到的扩展不确定度,可以计算在置信水平为95%的条件下,霉菌计数值的对数平均值的取值范围为(1.655 6-0.342 4)≤(1.655 6+0.342 4),即1.313 2≤≤1.998。取反对数,可得到检测结果NX的分布区间为20.568 4≤NX≤99.540 5。即该检测样品的霉菌估计值为20≤NX≤100 CFU/g。
3 讨论
分析数据可知,不同不确定度对检测结果影响大小可排列为urel(lgNX)>urel(lgNY)>urel(样品)>urel(接种)>urel(稀释)>urel(样液)。可见,样品的重复检测给检测结果的不确定度带来了最大的贡献。微生物检测结果发散性大是学界的普遍认知。一方面,微生物在样品中分布不均匀是造成检测结果有差异的重要原因[10]。另一方面,平板的菌落计数是引起检测结果有差异的另一重要原因[11]。郭丽艳[12]认为,霉菌在培养的过程当中,因反复观察而上下翻转平板会导致霉菌孢子扩散,形成次生小菌落,进而影响计数结果。此外,均质方式也会影响检测结果的测量不确定度。如使用旋转式刀片均质器,则可能会因为切断菌丝体而导致检测结果偏高[13]。因此,这种易引起误差的因素给检测值位于限量标准附近的产品是否合格带来了很大的随机性。为此,根据文献[14]要求,当测量不确定度影响与规范限的符合性时,检测报告需带有与被测量相同单位的测量不确定度或被测量相对形式的测量不确定度(百分比)。测量不确定度的引入给位于限量标准附近的产品带来了兼具科学性和安全性的判定依据。
此外,当前在一些研究霉菌和酵母的不确定度的报道中将霉菌和酵母统一计数,并不分开进行,这与GB 4789.15—2016中的规定[3]是相悖的。本研究也发现,霉菌和酵母在重复性检测中存在不同的测量不确定度分量,霉菌重复性检测的不确定度分量显然更高。霉菌的蔓延性以及孢子的易扩散性可能是使霉菌重复性检测的不确定度提高的重要原因。这说明,在霉菌与酵母的检测和测量不确定度评定中,均应该将霉菌与酵母分开计数。
4 结论
本研究评定了食用槟榔中霉菌和酵母总数的测量不确定度。结果表明,在置信水平为95%的条件下,该检测样品的霉菌估计值为20≤NX≤100 CFU/g;该检测样品的酵母估计值为85≤NY≤317 CFU/g。结果还表明,霉菌和酵母在重复性检测中的测量不确定度存在明显差异。这说明一些企业将霉菌和酵母统一计数的方式不可取,而应该对霉菌和酵母总数分别计数,并分别计算测量不确定度。本研究结果可为槟榔企业在内部质量控制中起到参考作用,既可以避免过分要求少菌无菌带来的高昂成本和技术困难,又可以切实降低微生物超标的风险。因此,在食品行业的微生物检测报告中引入不确定度可以使该报告兼具科学性和安全性的判定依据。
