诱导子CuSO4对金钗石斛原球茎产石斛碱的影响
2022-02-23朱星扬朱洁莹金磊磊陈集双
朱星扬,朱洁莹,钱 旭,贾 启,2,金磊磊,陈集双,2
(1.南京工业大学 生物与制药工程学院,江苏 南京211800;2.遵义医科大学 生物资源健康利用研究中心,贵州 遵义563000)
金钗石斛(Dendrobium nobile)是兰科石斛属多年生的草本植物,得名于其花的外观类似于古代妇女头上的佩饰——金钗[1]。金钗石斛是我国传统记载中入药最早的石斛,也是我国中医行业历代相传的名贵中草药,现已被收录于《中华人民共和国药典》[1]。根据《本草纲目》中记载其具有“强阴益精,厚肠胃,壮筋骨,补肾益力轻身延年”的作用,在《神农本草经》中也描述金钗石斛具有“益胃生津,滋阴清热”的功效[1]。金钗石斛的提取物主要具有抗肿瘤和抗诱变,抗白内障和抗炎,抗氧化和抗衰老,降血糖和血脂、保护神经系统等药理作用[2-6]。金钗石斛的化学成分主要有生物碱类、多糖类、酚类和倍半萜类等,其中生物碱类中的石斛碱是其特征成分[7-8]。
而目前被《中国药典》收录的共有5种石斛,其中金钗石斛中的生物碱含量最高[9],石斛碱是从金钗石斛茎中提取分离出的一种吡咯里西啶衍生物类生物碱,在铁皮石斛、黄草石斛和环草石斛等石斛中含量很低[10-11]。石斛碱具有止痛解热,降心率、降血压及解巴比妥中毒等作用。经研究证明,人工石斛碱合成步骤多,回收率低,因此目前主要是从植物中获取石斛碱[12]。
由于野生金钗石斛的资源匮乏,而有研究结果表明原球茎与野生植株的总生物碱的含量基本一致[13],这使得利用植物组织培养物来代替野生石斛资源已成为必然趋势[14-15]。目前,用于石斛组织培养的外植体主要有种子、茎段、叶片和幼根等[16-17],而对于金钗石斛组织培养的研究主要集中在种子萌发,原球茎诱导与培养的条件优化[18],种苗繁育与栽培等方面[19-20]。
诱导子胁迫会影响植物中组织次生代谢产物的累积。有研究发现,诱导子可调控生物的合成途径,从而起到增加植物次生代谢物产量的作用[21]。目前,提高金钗石斛石斛碱产量的主要方法有:1)通过改变栽培环境,利用菌根真菌共培养[22-23],2)调控不同的光质比例[24],3)施用不同的肥料提高金钗石斛的石斛碱含量[25]。在各种诱导子中,化学诱导剂(水杨酸、茉莉酸甲酯及金属离子等)已被用于许多植物[26],以增加生物活性化合物的积累[27]。研究发现:适量的水杨酸不仅能够诱导长春花幼苗中蛇根碱和水甘草碱的积累[28-29],也能够促进霍山石斛原球茎中生物碱的含量增加[30]。李芳[31]对在生长中的嫩叶用Cu2+处理后,发现喜树碱含量较对照组提高了67.4%。Yruela等[32]发现铜供应不足会改变植物新陈代谢的基本功能,阻碍光合系统电子传递。Assche等[33]发现过量的金属离子会影响酶的催化作用,从而影响植物的生长。
本课题组在建立金钗石斛原球茎液体悬浮培养体系后,通过改变诱导子CuSO4的添加时间、添加浓度、添加后的培养时间,比较分析其对金钗石斛原球茎生长以及石斛碱含量的影响,以期为今后利用金钗石斛原球茎为工业原料规模化生产石斛碱及发展石斛药用资源提供相应的理论基础和技术支持。
1 材料与方法
1.1 试验材料
1.1.1 样品
金钗石斛植株采自贵州省赤水市,待其开花后选择优良株系进行人工授粉,以收获的种荚为试验材料。
1.1.2 培养基
萌发培养基:1/2 MS培养基,蔗糖30 g/L,马铃薯30 g/L,萘乙酸(NAA)0.2 mg/L,琼脂5.5 g/L;pH 5.8。
固体增殖培养基:1/2 MS,蔗糖30 g/L,马铃薯30 g/L,6-苄基腺嘌呤(6-BA)1.5 mg/L,NAA 0.5 mg/L,琼脂5.5 g/L;pH 5.8。
液体增殖培养基:1/2 MS,蔗糖30 g/L,马铃薯30 g/L,6-BA 1.5 mg/L,NAA 0.5 mg/L;pH 5.8。
1.2 试验方法
1.2.1 种荚表面的消毒
先用去离子水将优良的未开裂的种荚冲刷30 min,然后置于灭菌后的超净工作台上,待表面消毒。将种荚置于体积分数75%乙醇中浸泡1 min,灭菌水冲洗3次;体积分数0.1%升汞浸泡12 min,灭菌水冲洗6次,期间不断晃动;再用无菌的滤纸吸去表面水分,获得无菌的种荚,待用。
1.2.2 种子的萌发
在无菌的牛皮纸上,用刀将无菌种荚的一端切开一个小口,再用镊子夹着种荚的另一端,将无菌的籽粒匀称撒落在萌发培养基上,培养4~6周后,可获得肉眼可见的浅黄色胚体。
1.2.3 原球茎继代增殖培养
接种种子萌发的小球状胚体到原球茎的增殖培养基上,培养5~7周,可得到石斛原球茎材料,扩繁备用。
1.2.4 金钗石斛原球茎的生长示意
金钗石斛原球茎的生长示意见图1。

图1 金钗石斛原球茎模式Fig.1 Pattern of the D.nobile protocorm
1.2.5 试验设计
将生长状态统一,颜色一致的金钗石斛原球茎按40 g/L接种量接种至50 mL液体培养基上。1)在第20天分别添加5个不同浓度CuSO4,浓度分别是0、0.25、0.50、0.75、1.00、1.25 mmol/L,继续培养20 d;2)在不同培养时间(10、20、30、40、50 d)添加0.25 mmol/L的诱导子CuSO4,继续培养20 d;3)在第20天时添加0.25 mmol/L的诱导子CuSO4后,培养不同时间(5、10、15、20、25、30 d)。每个处理组均设置3次重复,每次的重复量均为5瓶,测定原球茎的鲜质量、干质量及石斛碱的含量。
1.2.6 培养条件
温度(25±1)℃,光照强度1 500~2 000 lx,光照时间12 h/d。
1.3 测量指标和方法
1.3.1 原球茎鲜质量及干质量
培养结束后,将原球茎从固体瓶中取出,经蒸馏水冲洗3次后,用滤纸吸干表面水分,称鲜物质量。然后放入冷冻干燥机中冻干48 h,称干物质量。
原球茎增殖系数=(培养后新鲜原球茎的质量-接种时新鲜原球茎质量)/接种时新鲜原球茎的质量。
1.3.2 石斛碱的测定方法
参照2015版《中国药典》[34]的方法提取与检测样品中石斛碱的含量。
1)色谱条件
色谱柱为HP-5毛细管柱(柱长为30 m,内径为0.25 mm,膜厚度为0.25 μm),程序升温:初始温度为80℃,以10℃/min的速率升温至250℃,保持5 min;进样口温度为250℃,检测器温度为250℃。
2)萘内标溶液的制备
精密称定萘适量,加甲醇后制成25 μg/mL的溶液,作为内标溶液。
3)供试品溶液的制备
精密称定样品粉末,置于圆底烧瓶中,以1∶25(g/mL)的料液比精密加入体积分数0.05%的甲醇溶液补足减失的质量,摇匀,滤过。取过滤液2 mL和内标溶液1 mL于容量瓶,并定容至5 mL,摇匀,即得供试品溶液。
4)石斛碱对照品溶液的制备
精密称定石斛碱对照品适量,加甲醇制成1.6 mg/mL的溶液,作为对照品溶液。
5)校正因子的测定
精密量取对照品溶液2 mL,再加入内标溶液1 mL置于5 mL量瓶中,加甲醇至刻度,摇匀,吸取1 mL,注入气相色谱仪,计算校正因子F。
6)样品中石斛碱含量的计算

式中:A1为样品峰面积,A2、C2分别为样品中内标物的峰面积和质量浓度(μg/mL)。
1.4 数据统计分析
试验数据采用SPSS 24软件进行单因素分析,并检测各均值在0.05水平上是否具有差异显著性,用Origin 2017进行绘图。
2 结果与讨论
2.1 金钗石斛原球茎的诱导及其形成过程
通过体视显微镜对金钗石斛原球茎萌发过程进行了观察分析,结果见图2。由图2(a)可知:金钗石斛果荚被消毒剖开后,种子接入培养基时,种胚并未形成。由图2(b)可知:培养4 d时,种皮吸水膨胀,细长的种胚中少数细胞开始启动并持续分裂而形成分生组织,之后种胚形成,并逐渐膨大。由图2(c)可知:培养10 d左右,种胚膨大,分生组织细胞持续分裂,逐渐突破种皮。由图2(d)可知:培养16 d时,完全突破种皮,形成小球状胚体,形成微小的原球茎。

图2 金钗石斛原球茎的形成过程Fig.2 The development process of D.nobile protocorm
2.2 LC -MS定性测定金钗石斛中的石斛碱
通过LC -MS测定金钗石斛不同组织中石斛碱的成分,结果见图3。由图3(a)可知:在金钗石斛石斛碱标准品中测定了石斛碱的成分出峰时间及相对分子质量。由图3(b)和(c)可知:以石斛碱标准品作为参照,金钗石斛原球茎和金钗石斛鲜茎段中的石斛碱在相对定性的条件下,可以判断金钗石斛原球茎中存在石斛碱。
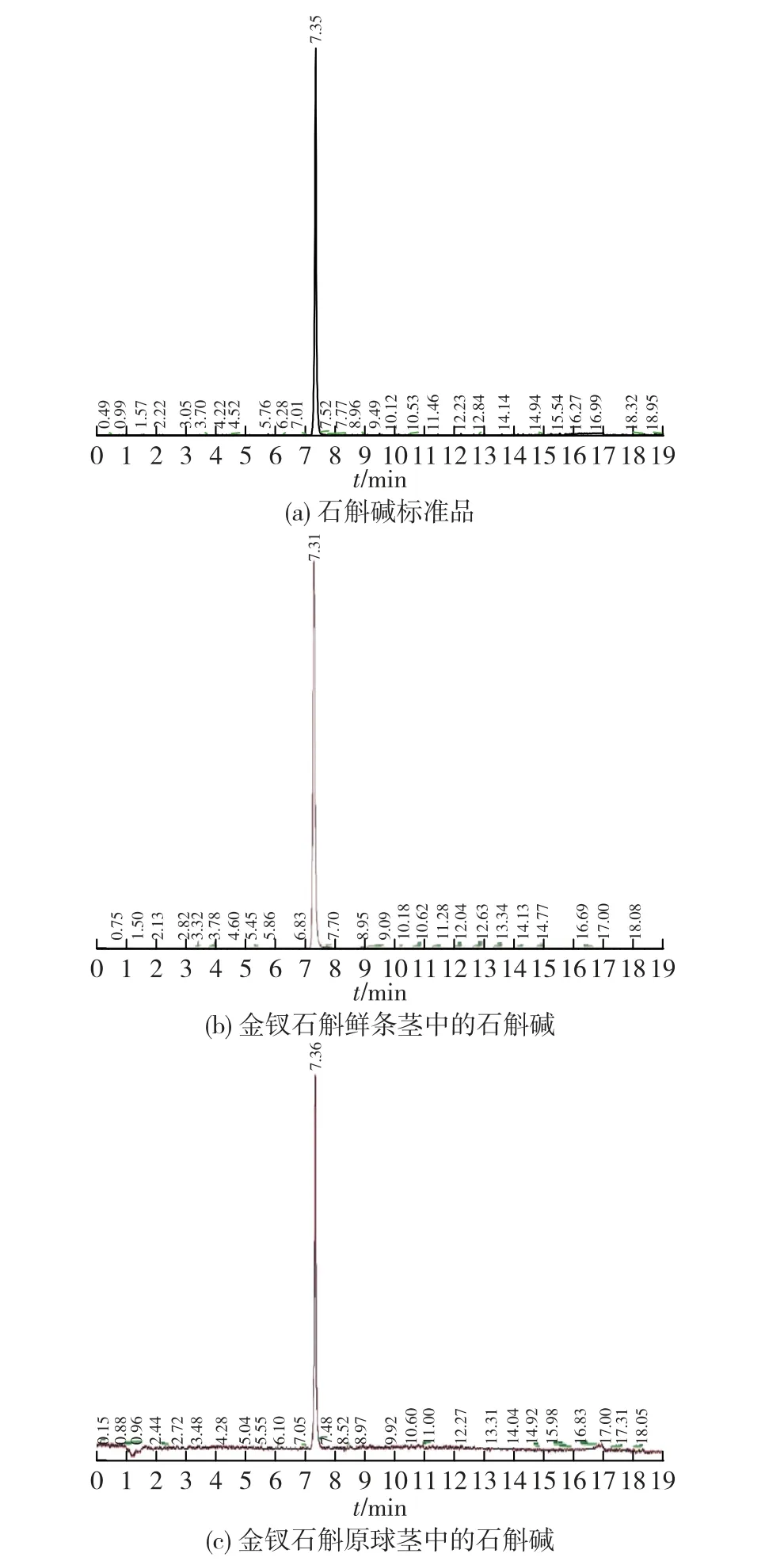
图3 LCMS测定金钗石斛不同部位中的石斛碱Fig.3 Dendrobine in different parts of D.nobile was determined by LC-MS
2.3 CuSO4于不同添加时间对金钗石斛原球茎生物量和石斛碱的影响
原球茎未处理组在不同培养时间生物量的变化见表1。从表1可以看出:未处理组的原球茎随着培养时间的增加,生物量也随之增加,25~30 d原球茎增殖系数的增殖速率最高,达到0.40。最适培养周期为40 d,此时原球茎生物量达到最高并趋于稳定。培养至50和60 d时,鲜质量趋于稳定,部分原球茎颜色变黄,且出现褐化死亡现象,干质量也随之减少。CuSO4于不同添加时间对原球茎生物量的影响见表2。从表2可以看出:金钗石斛原球茎培养至10~40 d时,鲜质量和干质量均不断增加。20~30 d时,鲜质量增加最为明显,增加了0.15 g,其原因可能是原球茎正处于对数生长期,生长速率高。于原球茎培养20 d时添加诱导子CuSO4,原球茎正处于对数生长初期,诱导子CuSO4胁迫原球茎产生了应激防御物质,致使原球茎产生代谢产物,干物质量增加。在原球茎培养30~40 d时添加诱导子CuSO4,原球茎处于对数生长末期,原球茎增殖系数较20 d增大明显。说明原球茎对诱导子CuSO4引起的胁迫作用有一定的抵抗能力,诱导子CuSO4胁迫作用不明显,干质量无明显变化。于不同时间添加诱导子CuSO4对原球茎生物量的积累有一定的影响。

表1 培养时间对未处理组原球茎生物量的影响Table 1 Effect of culture time on biomass of protocorm culture in untreated group

表2 CuSO4于不同添加时间对原球茎生物量的影响Table 2 Effect of different addition time of CuSO4 on protocorm biomass
图4 为CuSO4于不同添加时间对原球茎石斛碱含量的影响。由图4可知:在培养时间为10~20 d时,添加诱导子CuSO4,石斛碱的产量迅速增加,最高可达29.65 μg/g。可能是由于原球茎在培养初期,诱导子CuSO4抑制了原球茎的快速生长,使部分原球茎出现褐化死亡,迫使原球茎产生次生代谢产物石斛碱。当培养时间为20~40 d时,原球茎快速增殖生长,石斛碱的产量呈下降趋势。其原因可能是在该期间内,原球茎增殖系数增长较快,表明其新陈代谢活力较为旺盛,对诱导子CuSO4具有一定的抵制作用,降低了诱导子CuSO4对原球茎产石斛碱的刺激作用。
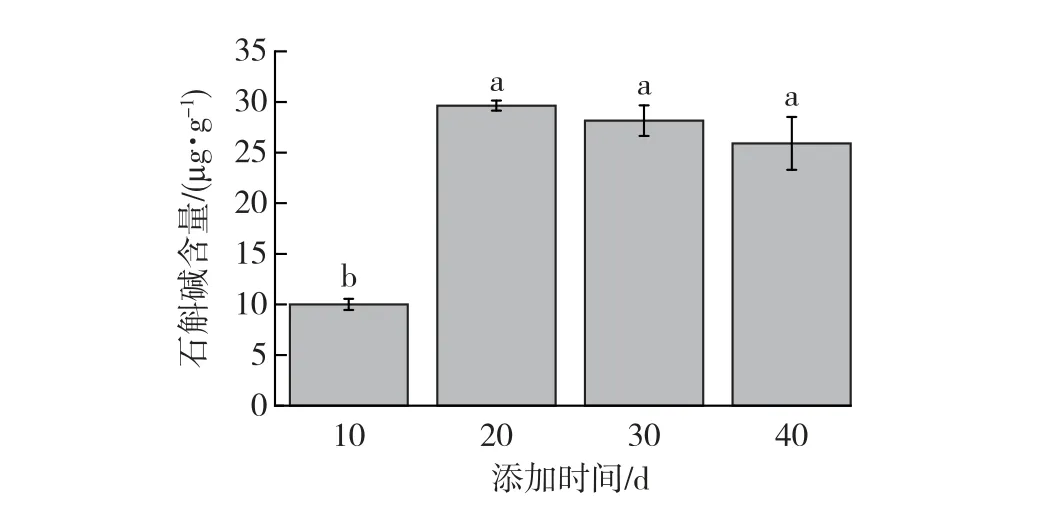
图4 CuSO4于不同添加时间对原球茎石斛碱含量的影响Fig.4 Effect of different addition time of CuSO4 on the dendrobine content in protocorm
2.4 不同CuSO4添加浓度对金钗石斛原球茎生物量和石斛碱的影响
不同CuSO4添加浓度对原球茎生物量的影响见表3。由表3可知:在金钗石斛原球茎培养过程中,添加不同浓度的诱导子CuSO4会对金钗石斛原球茎有一定的影响。当浓度为0.25 mmol/L时,原球茎鲜质量最高为(2.72±0.09)g,增殖系数达到0.36,表明适宜浓度的Cu2+有利于原球茎的生长与增殖,原球茎通过复杂的机制调控Cu2+的转运和吸收,形成动态平衡,从而提高原球茎的代谢水平。同时,干质量也达到最大量为(2.72±0.02)g,表明适宜浓度的Cu2+参与原球茎的代谢调控有助于代谢产物的积累。当CuSO4浓度继续增加时,鲜质量和干质量均呈下降趋势,其原因可能是诱导子浓度过高,导致原球茎的死亡,存活的原球茎繁殖率也较低,不利于次生代谢产物的产生。综上所述,CuSO4浓度为0.25~0.50 mmol/L时,干质量在误差范围内趋于稳定,石斛碱含量变化明显。表明诱导子CuSO4对原球茎胁迫产生代谢产物作用不明显,影响着石斛碱的合成代谢。浓度继续增加时,干质量呈降低趋势,表明诱导子CuSO4适宜浓度约为0.25~0.50 mmol/L。且Cu2+浓度过低,会导致原球茎颜色变黄,生长状态不佳。通过对石斛碱的产量比较发现,当添加CuSO4浓度为0.25 mmol/L时,较适合金钗石斛原球茎生物量的累积。

表3 不同CuSO4添加浓度对原球茎生物量的影响Table 3 Effect of different concentrations of CuSO4 on protocorm biomass
不同CuSO4添加浓度对原球茎石斛碱含量的影响见图5。由图5可知:随着诱导子CuSO4浓度的增加,石斛碱含量呈现先下降后上升的趋势。当CuSO4浓度为0.25 mmol/L时,石斛碱含量最多,达到35.10 μg/g。当浓度继续增加时,原球茎大部分呈现褐化死亡状态,导致石斛碱产量呈下降趋势。且浓度过高时,原球茎一方面减少了对Cu2+的吸收,同时Cu2+向胞外转运能力增强[35]。

图5 不同CuSO4添加浓度对原球茎石斛碱含量的影响Fig.5 Effect of different concentrations of CuSO4 on the dendrobine content
2.5 添加CuSO4后的不同培养时间对金钗石斛原球茎生物量和石斛碱的影响
CuSO4添加后不同培养时间对原球茎生物量的影响见表4。由表4可知:当培养时间为5~15 d时,鲜质量先减少后增加,其原因可能是适宜浓度的CuSO4刺激了原球茎的快速生长;当浓度继续增加时,原球茎产生防御机制,向胞外转运Cu2+,Cu2+浓度过低会影响植物生长[35]。当培养时间为15~30 d时,鲜质量呈下降趋势。其原因可能是诱导子CuSO4产生了抑制作用,刺激了金钗石斛原球茎的生长。随着时间的延长,抑制作用更加明显,甚至会造成原球茎的死亡。当培养时间为5 d时,干质量最大为(0.28±0.01)g,当培养时间至25 d时,干质量减少明显,为(0.22±0.01)g。添加诱导子CuSO4后,不同的培养时间,对金钗石斛原球茎生物量的累积均有一定影响,这与胡蕾等[36]的研究结果一致。
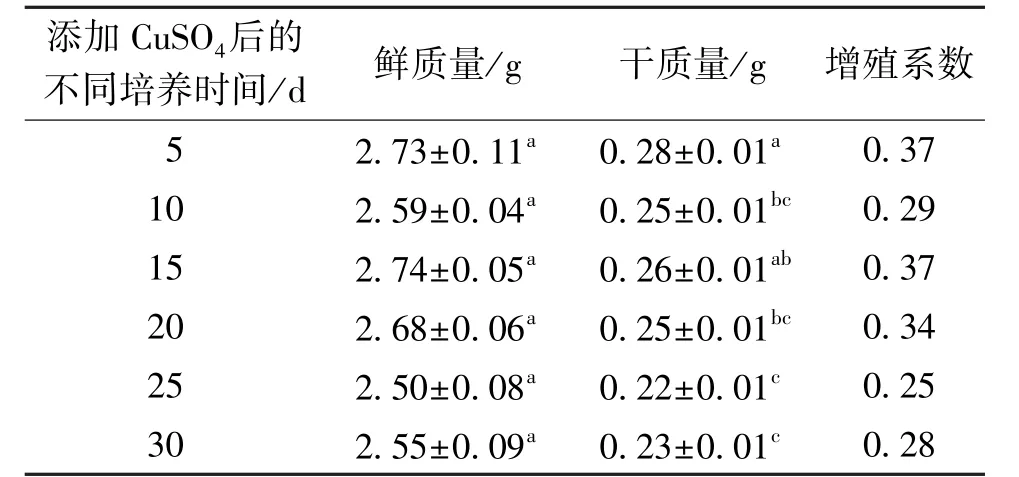
表4 添加CuSO4后不同培养时间对原球茎生物量的影响Table 4 Effect of different culture time on protocorm biomass after CuSO4 addition
添加CuSO4后不同培养时间对原球茎石斛碱含量的影响见图6。由图6可知:加入诱导子CuSO4后,培养5~15 d时,石斛碱含量在减少,可能是由于诱导子CuSO4的刺激作用在逐渐减弱,原球茎处于适应期,面临诱导子CuSO4的抑制作用产生了次生代谢产物。当培养至20 d时,石斛碱含量最大,达29.37 μg/g,继续培养,石斛碱含量呈下降趋势。可能是因为原球茎经过了适应期,处于对数生长期,生物量得到了一定的累积,在诱导子CuSO4的刺激下,激活了更多的防御机制[37],能够在维持自身生长的同时产生最大产量的次生代谢产物。培养至20~30 d,生物量有所下降,石斛碱含量也呈现下降趋势,可能是诱导子CuSO4抑制作用使部分原球茎产生了褐化死亡导致的。

图6 添加CuSO4后不同培养时间对原球茎石斛碱含量的影响Fig.6 Effect of different culture time on the dendrobine content in the protocorm after CuSO4 addition
3 结论
本研究表明诱导子CuSO4对原球茎的生长有一定的抑制作用,但可以通过提高原球茎中石斛碱的产量,即添加诱导子CuSO4后,金钗石斛原球茎的生物量、石斛碱产量及生理状态都会产生影响。当诱导子CuSO4浓度为0.25 mmol/L时,原球茎的生物量达到最高,可为石斛碱的生产提供组培材料。在液体悬浮培养下,金钗石斛原球茎加入诱导子CuSO4的最适条件:原球茎培养20 d加入0.25 mmol/L CuSO4,继续培养20 d。本研究所得结果为多因素胁迫原球茎提供了一定的数据及理论基础。
