LncRNA NKILA对肿瘤恶性生物学行为的影响及机制
2022-02-23赵俞乔刘广麟王海存高欣姜兴明刘浪
赵俞乔,刘广麟,王海存,高欣,姜兴明,刘浪
0 引言
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度介于200 bp~100 kb间的非编码RNA,主要由RNA聚合酶Ⅱ转录,并经过共修饰、RNA折叠等步骤合成。LncRNA可以在表观遗传、转录以及转录后等多个水平参与各种病理生理过程,并且lncRNA对肿瘤增殖、转移侵袭、上皮间质转化以及耐药等方面的重要作用已得到研究证实;然而,lncRNA与肿瘤相关炎性反应的关系尚不明确[1-3]。核转录因子κB(nuclear factor-kappaB,NF-κB)是联系肿瘤与炎性反应的关键因子,2015年Liu等在乳腺癌中发现与NF-κB相互作用的lncRNA并将其命名为NKILA(NFkappaB interacting lncRNA)。NKILA是一个长度为2 570 nt的无内含子转录本,定位于人类染色体20q13.31。除少数具有编码多肽潜能的开放阅读框(open reading frames,ORF)外,NKILA没有长于300 nt的典型蛋白质编码ORF。近年研究结果表明,NKILA不仅能参与骨关节炎、糖尿病性心肌病、败血症性肾损伤等疾病的病理过程,还可以增强心肌蛋白的表达水平从而预防心肌缺血[4-7]。此外,NKILA在多种恶性肿瘤中异常表达,能够在细胞分化、增殖、迁移侵袭以及凋亡等方面发挥调控作用,见表1;同时NKILA的表达水平与肿瘤患者的临床病理特征密切相关,可能作为肿瘤诊断的依据及患者预后的影响因素。本文就恶性肿瘤中NKILA的生物学作用及机制作一综述。

表1 NKILA在肿瘤中的功能作用Table 1 Function of NKILA in cancers
1 NKILA与肿瘤
1.1 NKILA与女性生殖系统肿瘤
尽管诊断和治疗的水平在不断进步,但乳腺癌和宫颈癌患者的预后仍不容乐观。诸多研究均证实NKILA在乳腺癌中异常低表达[8-13],过表达NKILA可抑制肿瘤细胞的增殖和侵袭转移并且促进细胞凋亡;肿瘤异种移植实验中,外源性沉默NKILA会增强肿瘤细胞在肝、肺中的转移。Kaplan-Meier生存曲线分析结果表明NKILA的低表达与乳腺癌癌肿转移及患者不良预后密切相关[9-11]。Wang等[14]利用实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction,qRT-PCR)检测发现NKILA在宫颈癌肿瘤组织和肿瘤细胞中呈异常低表达,上调NKILA表达后宫颈癌肿瘤细胞的增殖、迁移和侵袭能力受到抑制。宫颈鳞状细胞癌(cervical squamous cell carcinoma,CSCC)患者血清中NKILA的表达相较于健康对照组显著降低,并且NKILA表达水平检测可作为CSCC的诊断依据(95%CI:0.8273~0.9762,P<0.0001);细胞学实验中过表达NKILA能够显著抑制CSCC肿瘤细胞的增殖并诱导细胞发生凋亡[15]。
1.2 NKILA与呼吸系统肿瘤
鼻咽癌、喉癌、肺癌都是常见的呼吸系统肿瘤且均具有较高的复发率[16]。实验研究中通过qRT-PCR检测发现:NKILA在鼻咽癌、喉癌、肺癌组织和肿瘤细胞中的表达均明显降低[17-21]。对以上呼吸系统肿瘤患者的临床病理学数据进行分析发现:NKILA表达水平与癌肿大小、TNM分期、淋巴结侵犯及远处转移密切相关,并且高表达组NKILA患者的整体生存时间、无病生存期以及局部无复发生存期均优于低表达组患者。利用shRNA(short hairpin RNA)或siRNA(small interfering RNA)转染肿瘤细胞来外源性沉默NKILA的表达后,肿瘤细胞的增殖和侵袭转移能力得到提高,同时细胞凋亡受到明显抑制。裸鼠异种移植实验中,外源性沉默NKILA同样能够促使体内肿瘤的生长和远处转移。此外,过表达NKILA能够降低喉癌细胞对X射线的抗性。
1.3 NKILA与消化系统肿瘤
NKILA在食管鳞状细胞癌、结直肠癌(colorectal cancer,C R C)、肝细胞癌(hepatocellular carcinoma,HCC)肿瘤组织和肿瘤细胞中呈现不同程度的异常低表达[22-28]。对上述三类肿瘤患者临床病理学数据进行统计学研究发现:NKILA的表达水平与癌肿大小、分化程度、TNM分期和血管侵犯密切相关;NKILA低表达组患者的总生存率和无进展生存率均低于高表达组,并且NKILA表达水平可以作为上述肿瘤患者预后的独立危险因素。在结直肠癌的研究中还发现NKILA对于CRC早期诊断具有较高的敏感度和特异性,并且优于CEA和CA19-9的诊断效能[25]。下调NKILA的表达能够在体外细胞实验中提高食管鳞状细胞癌细胞(KYSE30、KYSE180、Eca109、Eca9706)、肝癌细胞(SMMC-7721、HCCLM3)及直肠癌细胞(SW837、HR8348)的增殖和侵袭能力,同时在裸鼠体内肺转移瘤实验中增加食管鳞状细胞癌和肝细胞癌肺转移结节的大小和数量。Yu等[27]的实验还证实:过表达NKILA可以增强黄岑素对HCC细胞增殖、侵袭转移的抑制作用,并且能够显著提高HCC细胞的药物敏感度。
1.4 NKILA与其他肿瘤
骨肉瘤组织和肿瘤细胞中NKILA的表达水平明显低于相应癌旁组织和正常细胞,并且NKILA的异常表达与肿瘤大小、病理分期和淋巴结转移显著相关;用NKILA-siRNA转染KNKS/NP细胞后,肿瘤细胞的增殖、侵袭和迁移能力得以增强[29]。Bian等[30]的实验研究证实NKILA在黑色素瘤中表达下调,过表达的NKILA能够抑制黑色素瘤细胞的增殖与侵袭转移能力;同时NKILA可作为黑色素瘤诊断的生物标志物(AUC=0.875)。此外,视网膜母细胞瘤、舌鳞状细胞癌和口腔鳞状细胞癌中NKILA同样扮演了抑癌因子的角色,对肿瘤细胞的增殖、侵袭和转移具有负性调控作用[31-33]。
2 肿瘤中NKILA的作用机制
NF-κB是一个转录因子家族,在炎性反应、免疫、细胞增殖和分化中起着关键作用,同时也是联系肿瘤与炎性反应的重要纽带。NF-κB家族主要成员为p65/p50亚单位形成的NF-κB1二聚体蛋白,该蛋白被激活后启动核转位,在细胞核中发挥其生物学作用。NF-κB抑制剂(inhibitor of NFκB,IκB)被认为是NF-κB信号转导通路的主要制动器,能够与细胞质中的NF-κB特异性结合形成复合物;而IκB可以被IκB激酶(IKK)磷酸化,导致IκB降解并释放和活化NF-κB。研究发现乳腺癌细胞中NF-κB可以与NKILA启动子区域结合来激活其转录活性[8]。NKILA具有三个稳定发夹结构:
hairpin A(nt 322-359)、hairpin B(nt 395-418)和hairpin C(nt 1121-1216),分别起到抑制p65核转位、结合NF-κB/IκB复合物形成和遮蔽IκBα磷酸化位点的作用,从而协同抑制NF-κB通路的活化;并且NKILA也能够在炎性激活的乳腺上皮细胞中作为负性调节因子阻止NF-κB的过度激活。在鼻咽癌、喉癌、直肠癌、黑色素瘤中,过表达的NKILA均能够抑制炎性刺激因子(TNFα等)诱导的NF-κB通路活化,降低p-IκBα蛋白表达水平的同时滞留p65于胞质内,从而抑制肿瘤的恶性生物学行为[17-18,25,30]。同时这一信号通路也在喉癌细胞的X射线辐射抗性以及肝细胞癌细胞对黄芩素的敏感度中发挥作用[18,28]。
上皮间充质转化(epithelial-mesenchymal transition,EMT)是肿瘤细胞常见的形态学转变,在此过程中编码上皮细胞特异性蛋白(E-cadherin、Occludins)基因的转录受到抑制,并被具有更强连接灵活性的蛋白(N-cadherin)取代,同时角蛋白细胞骨架转化为Vimentin从而导致细胞丧失黏附力并增加运动性,这在肿瘤的进展和转移中起着重要作用。过表达NKILA可以在诸多肿瘤中降低N-cadherin和Vimentin的表达,同时上调E-cadherin的表达水平[14]。进一步研究证实NKILA还可以通过NF-κB通路对其他EMT关键基因进行调控从而影响上皮间质转化进程。Zhang等[29]研究发现低表达的NKILA在骨肉瘤中上调NF-κB下游基因Snail的表达;Snail进一步诱导松解上皮细胞之间的黏着连接,并且还可能与紧密连接的破坏有关。食管鳞状细胞癌中沉默NKILA能够激活包括CCND1(cyclin D1)、TWIST1(twist family bHLH transcription factor 1)、MMP9(X-linked inhibitor of apoptosis)和XIAP(X-linked inhibitor of apoptosis)在内的NF-κB下游靶基因,上述靶基因均在肿瘤的生长和转移中起着至关重要的作用[24]。Luo等[9]通过实验证实:NKILA的过表达可以显著降低人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)上清液中IL-6(interleukin 6)、VEGFA(vascular endothelial growth factor A)以及VEGFR(kinase insert domain receptor)的蛋白水平,从而抑制HUVEC细胞的血管新生能力。在舌鳞状细胞癌和肝细胞癌中,NKILA分别对NF-κB/Slug和NF-κB/Twist轴进行调控从而发挥其抑癌作用[27,32]。除NF-κB相关信号通路外,IL-11(interleukin 11)和EZH2(enhancer of zeste 2 polycomb repressive complex 2 subunit)也可作为NKILA的直接靶标介导其在EMT进程中的作用[11,21]。
转化生长因子β(transforming growth factor beta,TGF-β)经典信号途径中,TGF-β与TGF受体结合后将SMAD复合物转位进入细胞核,从而诱导一系列EMT调控基因的转录。在肿瘤的早期阶段,TGF-β经典途径具有相对较高的活性抑制肿瘤发生,而随着TGF-β途径的核心因子和肿瘤抑制臂(tumor-suppressive arm)的转变逐渐发挥促肿瘤作用。越来越多的证据表明:TGF-β诱导的EMT在多种类型肿瘤中均依赖于NF-κB信号通路[12]。Lu等[20]研究发现NKILA被TGF-β诱导上调表达,并且在非小细胞肺癌的早期阶段NKILA具有更高的表达水平,符合TGF-β在肿瘤中的双重作用。进一步研究证实高表达的NKILA可以抑制EMT进程,这一作用是通过调控NF-κB下游靶基因Snail表达而实现的;该研究团队还在食管鳞状细胞癌中发现:由TGF-β诱导而表达提高的NKILA对NF-κB的另一下游基因MMP14(matrix metallopeptidase 14)同样具有调控作用[23]。
此外,NKILA还可以通过非NF-κB途径与其他ncRNA或信号通路相互作用行使其功能。在高转移性乳腺癌细胞中,高表达的miR-103和miR-107可以通过定向去甲腺苷酸化途径降解NKILA的poly A尾来缩短NKILA的半衰期,从而使更多NF-κB得到激活[8]。Wang等[15]研究发现通过转染过表达载体上调NKILA在CSCC细胞中的表达可以降低miR-21水平,而过表达miR-21能够部分逆转NKILA对于肿瘤细胞增殖和迁移侵袭的促进作用。Lyu等[31]实验证实:视网膜母细胞瘤中低表达水平的NKILA可以在一定程度上抑制另一种促癌性lncRNA XIST(X inactive specific transcript)的恶性生物学作用。神经胶质瘤细胞中异常上调表达的NKILA能够提高HIF-1α(hypoxiainducible factor-1α)及其他缺氧途径关键蛋白(VEGFA、GLUT1、p53、LDHA)的表达,从而刺激Warburg效应和血管生成;20(S)-Rg3(Ginsenoside-Rg3)可以抑制NKILA表达从而部分逆转其促癌作用[34]。
3 总结与展望
NF-κB的活化是多种肿瘤的普遍特征,其作为关键因子在肿瘤细胞中调控众多相关基因的表达和功能。LncRNA NKILA的发现,成功地建立了lncRNA与NF-κB间的联系,为肿瘤生物学行为的调控机制提供全新的理论依据和研究方向,见图1。目前关于NKILA作用机制研究尚处在早期阶段,如TGF-β与NF-κB协同调控NKILA的具体机制尚不明确,NKILA与肿瘤患者治疗后反应的关系也需进一步实验观察。相信随着研究的不断深入,NKILA能够成为肿瘤诊断和治疗的新靶点。
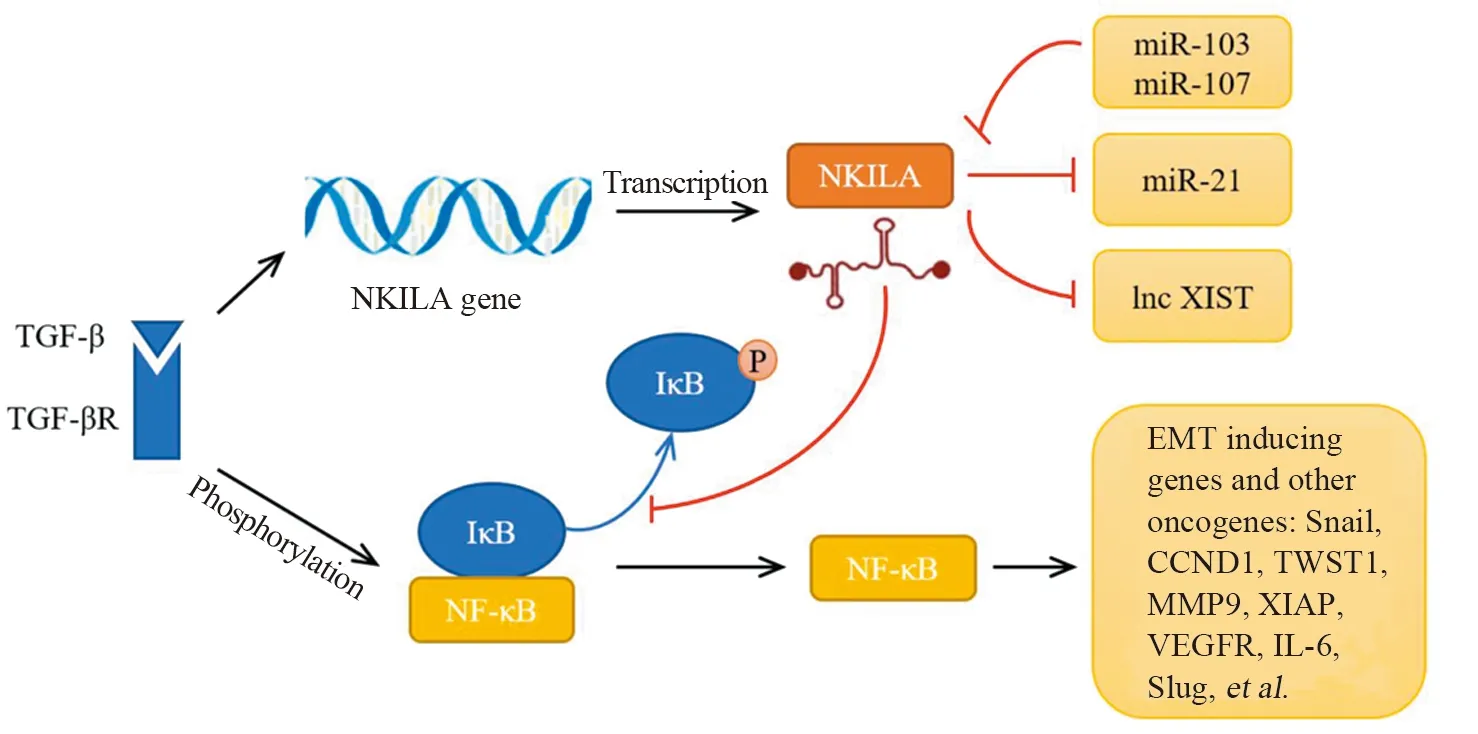
图1 NKILA在肿瘤中的作用机制Figure 1 Mechanisms of NKILA in cancers
