MiR-218-5p通过靶向抑制TDP1表达促进鱼藤酮诱导的胃癌细胞凋亡
2022-02-23王园园吕小红
王园园,吕小红
0 引言
微小核糖核酸(microRNAs,miRNAs)是一种短的内源性非编码RNA,通过介导翻译抑制或mRNA降解来调控基因表达[1]。以miRNAs作为标志物在癌症研究和治疗中发挥重要的作用,关于癌症miRNAs标志物挖掘的研究工作也为癌症治疗提供了宝贵的资源[2]。胃癌是常见恶性肿瘤之一,其临床治疗方法需不断突破,临床疗效也有待提高[3]。由于缺少合适的生物标志物,大多数胃癌患者被诊断时已为晚期。miRNAs可以作为胃癌诊断和预后的潜在生物标志物[4]。研究发现,miR-218-5p在胃癌组织和细胞中表达下调,且与肿瘤预后有关,具有成为胃癌新治疗靶点和预后标志物的潜在价值[5]。miR-218-5p在胃癌发生发展过程发挥重要的抑制作用,但具体作用机制尚未完全阐明,因此,探究miR-218在胃癌中的靶基因及其机制,对于胃癌的治疗研究具有重大意义。酪氨酰-DNA磷酸二酯酶1(tyrosyl DNA phosphodiesterase 1,TDP1)是细胞核和线粒体DNA损伤修复的关键因子,在癌症中呈高表达水平,在肿瘤发生发展过程中发挥驱动作用[6-8]。根据预测结果,miR-218-5p与TDP1存在靶向调控关系,因此,推测miR-218-5p可能通过靶向TDP1调控胃癌细胞线粒体DNA损伤修复过程,进而影响胃癌的发展,故本文对此进行验证,旨在了解miR-218-5p在胃癌中的作用机制,以期为胃癌有效治疗新策略的研发提供思路。
1 材料与方法
1.1 细胞系、主要试剂及仪器
人正常胃黏膜上皮细胞GES-1由中国科学院上海细胞生物学研究所提供;胃癌细胞系SGC-7901、HGC-27、MGC-803和BGC-823均购自美国ATCC细胞库。主要试剂:miR-218-5p模拟物(mimic)和其阴性对照(negative control,NC)由上海吉玛基因生物科技有限公司设计合成;DMEM培养基购自美国Hyclone公司;荧光素酶报告基因检测试剂盒购自美国Promega公司;胎牛血清、鱼藤酮购自美国Sigma公司;TRIzol、Lipofectamine 2000TM购自美国Invitrogen公司;反转录试剂盒购自日本TaKaRa公司;SYBR Green PCR试剂盒购自美国KAPA Biosystems公司;AnnexinV-FITC/PI凋亡检测试剂盒购自美国BD公司;细胞质和线粒体蛋白质提取试剂盒购自上海生工生物工程有限公司;PVDF膜、化学发光试剂购自美国Millipore公司;兔抗TDP1、Bax、Bcl-2、Cyt-c多克隆抗体均购自英国Abcam公司。主要仪器:倒置显微镜购自德国Leica公司;实时荧光定量PCR仪购自美国Bio-Rad公司;流式细胞仪购自艾森生物(杭州)有限公司;全自动化学发光分析仪购自上海天能科技有限公司。
1.2 细胞培养
从液氮罐中取出冻存的GES-1、SGC-7901、HGC-27、MGC-803和BGC-823细胞,复苏后接种于含10%胎牛血清的DMEM培养基中,置于37℃、5%CO2恒温培养箱中培养。待80%细胞贴壁生长时,进行传代处理。
1.3 RT-PCR检测miR-218-5p和TDP1表达水平
收集对数生长期细胞,TRIzol试剂盒提取各细胞总RNA,反转录试剂盒合成cDNA。再以cDNA为模板进行PCR反应,反应条件:95℃变性10 s,60℃退火25 s,72℃延伸30 s,共39个循环。引物序列如下:miR-218-5p-F:5’-ATGTAGCGTGC GACCGTGGAC-3’,miR-218-5p-R:5’-CAGGCTGACGCACTCTGTGCT-3’;TDP1-F:5’-TCTTCCAGTTCTTAGCCTCCTCTGC-3’,TDP1-R:5’-TGGCCTGGATCTCACTCTGGAGGC-3’;U6-F:5’-GGCCTCTCGAACTTGCGTGTC-3’,U6-R:5’-CCATCGGAAGCTCGTATACGA-3’;GAPDH-F:5’-CCACTCCTCCACCTTTG-3’,GAPDH-R:5’-CACCACCCTGTTGCTGT-3’。采用2-△△Ct法对数据进行定量分析。
1.4 双荧光素酶报告基因验证miR-218-5p与TDP1的靶向关系
根据网站TargetScan(www.targetscan.org)预测结果,miR-218-5p与TDP1之间存在靶向关系,进一步采用荧光素酶报告基因验证该关系,具体实验过程如下:根据网站预测miR-218-5p与TDP1的结合片段,进行PCR扩增,并插入至荧光素酶载体中,构建TDP1野生质粒。采用基因突变技术将结合片段进行突变处理,构建TDP1突变质粒。将miR-218-5p-mimic、miR-218-5p-NC和野生质粒或突变质粒使用Lipofectamine 2000TM混合后,共转染至筛选的胃癌细胞中。转染48 h后,检测荧光素酶活性。
1.5 构建TDP1过表达载体
根据TDP1基因序列设计合成含GFP的TDP1过表达慢病毒载体(Lv-TDP1)和阴性对照空载体(Lv-NC),由上海吉凯基因化学技术有限公司完成,病毒滴度为1×108TU/ml。
1.6 细胞损伤模型构建及分组
采用含有终浓度为0、0.2、0.4、0.6、0.8、1.0和1.2 µmol/L鱼藤酮的培养基培养胃癌细胞24 h,并对细胞活力进行检测,筛选出鱼藤酮诱导胃癌细胞损伤的最佳干预浓度为1.0 µmol/L。将消化处理后的细胞分为对照组、损伤组、miR-218-5p-NC组、miR-218-5p-mimic组、Lv-NC组、Lv-TDP1组和miR-218-5p-mimic+Lv-TDP1组,除对照组不作处理外,其他组细胞均采用1 µmol/L鱼藤酮诱导细胞损伤,干预24 h后进行后续检测。
1.7 流式细胞术检测细胞周期
消化处理各组细胞,制备单细胞悬液,收集至流式细胞术检测专用管中。1 000 r/min离心5 min,弃上清液,加入300 µl含10%胎牛血清的PBS溶液重悬细胞沉淀,再加入700 µl无水乙醇,-20℃固定24 h。3 000 r/min离心30 s,弃上清液,1 ml PBS洗涤2次。加入400 µl PI(50 µg/ml)避光染核10 min,流式细胞仪检测细胞周期占比。
1.8 流式细胞术检测细胞凋亡
PBS洗涤贴壁细胞,消化处理后收集至离心管中,1 000 r/min离心5 min,弃上清液,PBS重悬。取1×105个重悬细胞,1 000 r/min离心5 min,1 ml PBS悬浮细胞。1 000 r/min离心5 min,加入200 µl Binding buffer重悬细胞,分别加入10 µl Annexin V-FITC和PI,混匀后避光孵育30 min。加入300 µl Binding buffer,流式细胞仪检测细胞凋亡率。
1.9 Western blot检测蛋白表达
提取细胞质或线粒体蛋白,定量后,以20 µg蛋白上样量经SDS-PAGE电泳。湿转法将蛋白转移至PVDF膜上,5%脱脂奶粉封闭2 h。加入一抗稀释液(TDP1、Bcl-2稀释比1:2 000,Bax、Cyt-c稀释比1:1 000),室温孵育1 h,PBS清洗3次,加入经辣根过氧化酶标记的二抗,室温孵育1 h,PBS清洗3次。滴加化学发光试剂显影,凝胶成像系统拍照,采用TANON GIS读取条带灰度值。
1.10 统计学方法
采用SPSS19.0软件进行分析,细胞中miR-218-5p和TDP1 mRNA表达水平、双荧光素酶活性、周期及凋亡占比、TDP1、Bcl-2和Bax蛋白表达水平均以(x±s)表示,符合正态分布,两独立样本间比较采用t检验,多组间比较采用单因素方差分析。P<0.01表示差异有统计学意义。
2 结果
2.1 胃癌细胞中miR-218-5p与TDP1表达相关性
结果显示,miR-218-5p在胃癌细胞中的表达水平低于正常细胞(F=25.806,P=0.000),而TDP1表达水平却显著高于正常细胞(F=55.251,P=0.0 0 0),两者呈负相关(R2=0.9 5 8,P=0.0212),见图1。本研究选择在四种胃癌细胞中miR-218-5p表达水平最高。TDP1表达水平低的SGC-7901细胞作为后续实验的细胞材料。

图1 miR-218-5p与TDP1在胃癌细胞中的表达及相关性Figure 1 Expression of miR-218-5p and TDP1 in gastric cancer cells and their correlation
2.2 miR-218-5p与TDP1靶向关系验证
双荧光素酶报告基因验证结果显示,共转染miR-218-5p-mimic和TDP1野生质粒的细胞中荧光素酶活性显著降低(t=6.612,P=0.003),见图2。

图2 miR-218-5p与TDP1的靶向关系Figure 2 Targeting relationship between microRNA-218-5p and TDP1
2.3 miR-218-5p及TDP1对SGC-7901细胞周期的影响
流式细胞术检测结果显示,相较于对照组,损伤组G1期细胞数量增多(t=5.795,P=0.004);与损伤组相比,Lv-TDP1过表达组G1期细胞数量减少(t=3.405,P=0.027),而miR-218-5pmimic +Lv-TDP1组G1期细胞数量增多(t=5.577,P=0.005),miR-218-5p-mimic组进一步增多(t=14.201,P=0.000),见图3。

图3 miR-218-5p及TDP1对SGC-7901细胞周期的影响Figure 3 Effects of microRNA-218-5p and TDP1 on cell cycle of SGC-7901 cells
2.4 miR-218-5p及TDP1对SGC-7901细胞凋亡的影响
细胞凋亡检测结果显示,与对照组比较,损伤组、miR-218-5p-NC和Lv-NC组细胞凋亡率升高(F=21.133,P=0.000);与损伤组比较,Lv-TDP1组凋亡率降低(t=2.911,P=0.044),而miR-218-5p-mimic+Lv-TDP1组凋亡率升高(t=3.013,P=0.039),miR-218-5p-mimic组凋亡率进一步升高(t=5.371,P=0.006),见图4。
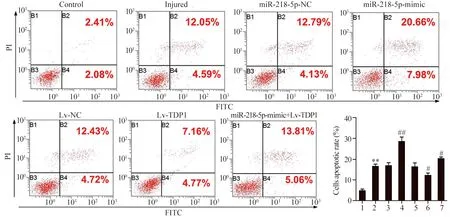
图4 miR-218-5p及TDP1对SGC-7901细胞凋亡的影响Figure 4 Effects of microRNA-218-5p and TDP1 on apoptotic rate of SGC-7901 cells
2.5 miR-218-5p对SGC-7901细胞线粒体TDP1及细胞中Bax和Cyt-c蛋白表达的影响
Western blot结果显示,与对照组比较,损伤组线粒体TDP1蛋白水平显著升高(t=11.416,P=0.000),细胞中Bax与Cyt-c蛋白表达水平也显著升高(t=7.339,P=0.002;t=6.987,P=0.002);与损伤组比较,Lv-TDP1组线粒体TDP1水平显著升高(t=4.734,P=0.009),Bax及Cyt-c蛋白表达水平显著降低(t=4.775,P=0.009;t=3.363,P=0.028),而miR-218-5p-mimic+Lv-TDP1组和miR-218-5pmimic组与Lv-TDP1组趋势相反,线粒体TDP1水平显著降低(F=208.357,P=0.000),Bax及Cyt-c蛋白表达显著升高(F=29.328,P=0.001;F=29.109,P=0.001),见图5。

图5 miR-218-5p及TDP1对SGC-7901细胞线粒体TDP1及细胞中Bax和Cyt-c蛋白表达的影响Figure 5 Effects of microRNA-218-5p and TDP1 on expression of TDP1 in mitochondria and Bax and Cyt-c proteins in SGC-7901 cells
3 讨论
胃癌是一种高发病率和高死亡率的肿瘤,传统的化疗和生物制剂的预后均较差[9]。我国近二十年的胃癌发病率和死亡率虽然呈现出下降趋势[10],但疾病负担仍然十分沉重,严重危害着我国居民的健康,仍是我国癌症防治的重点。miR-218-5p在多种肿瘤中发挥抑制因子作用,影响肿瘤细胞侵袭和转移[11-12]。研究发现,miR-218在胃癌组织中低表达,其表达水平降低与胃癌患者的临床分期、淋巴结转移以及预后不良有关,而且miR-218可抑制胃癌细胞的增殖,抑制肿瘤的生长和转移[13]。Kim等[14]研究结果也显示,miR-218在胃癌细胞及组织中异常表达,可能是一种新的胃癌治疗靶点。miR-218-5p在胃癌中作为治疗靶点的潜力也已被初步探讨[5],Lin等[15]研究结果显示miR-218-5p模拟物可抑制胃癌细胞的转移。在本实验结果中,miR-218-5p在四种胃癌细胞中均呈现低表达,结合上述文献的研究结果,提示miR-218-5p与胃癌之间存在密切关系。
本研究中,miR-218-5p和TDP1在四种胃癌细胞中的表达呈负相关,双荧光素酶报告基因亦验证两者间存在靶向关系。拓扑异构酶1(Top1)在基因复制和转录过程中调节DNA拓扑状态,当Top1无法从DNA链上解离时可导致DNA断裂,而TDP1可修复由Top1介导的染色体断裂,从而修复细胞核及线粒体中的DNA损伤[7,16]。TDP1是一种细胞核和线粒体蛋白,研究发现,当细胞发生氧化应激(过氧化氢或鱼藤酮诱导)损伤时,TDP1易位转移至线粒体中,维持线粒体DNA的完整性,支持线粒体功能[17]。线粒体基因不稳定在胃癌的发生中起着重要作用,参与其发病机制,可通过两种途径引起细胞癌变:一是引起核基因组的不稳定;二是线粒体氧化压力的增加导致线粒体酶表达异常和凋亡途径的激活影响细胞的生物学特征,使其发生恶变[18]。Bax存在于线粒体外,当其接收到凋亡信号时易位至线粒体,改变线粒体膜电位及其通透性,促进线粒体中Cyt-c的释放,从而激活下游级联反应,诱导线粒体内源性凋亡途径[19]。本次研究采用鱼藤酮诱导胃癌细胞SGC-7901发生氧化损伤,当miR-218-5p表达升高时,细胞G1期阻滞加剧,细胞凋亡水平升高,且细胞中Bax和Cyt-c表达上调,而线粒体中TDP1表达降低;当TDP1表达升高时,缓解细胞G1期阻滞,凋亡率降低,线粒体中TDP1水平升高,而Bax和Cyt-c表达下调,因此,推测miR-218-5p可能通过抑制线粒体TDP1水平,促使细胞线粒体功能受损,从而触发细胞线粒体内源性凋亡途径。
综上所述,本研究显示过表达miR-218-5p或抑制TDP1表达可促进鱼藤酮诱导胃癌细胞SGC-7901发生凋亡,其作用机制可能与miR-218-5p靶向抑制TDP1介导的线粒体DNA损伤修复及功能维持、激活线粒体内源性凋亡途径相关。
