中国和美国UDI法规框架与实施分析
2022-02-23王新茹马雪皎张培茗
王 丽,李 强,王新茹,夏 兵,马雪皎,黎 聪,张培茗*
(1.河南省药品评价中心,郑州 450008;2.河南省食品药品审评查验中心,郑州 450008;3.上海健康医学院医疗器械学院,上海 201318)
0 引言
医疗器械唯一标识(unique device identification,UDI)是目前国际医疗器械监管研究的热点,采用UDI对医疗器械进行标注能够在全生命周期快速准确识别医疗器械,对提高医疗器械全链条管理效率、降低管理成本、减少医疗差错等方面都具有重要意义。国际医疗器械监管机构论坛(International Medical Device Regulators Forum,IMDRF)在2013年和2019年分别发布了《UDI指南》和《UDI应用指南》等文件,UDI成为全球医疗器械监管认可的监管工具。美国进行了多年UDI的前期研究,于2013年由美国食品药品监督管理局(Food and Drug Administration,FDA)发布《UDI最终规则》。欧盟、韩国和沙特阿拉伯等也相继发布UDI相关的法规和指南性文件,日本、阿根廷和土耳其等国也陆续开展了UDI相关工作。2017年欧盟发布的医疗器械法规(medical device regulation,MDR)也明确加入了UDI的要求。国际上在医疗器械监管过程中推行UDI已成为必然趋势,各国都展开了与UDI相关的研究,但医疗器械的复杂性、多样性等特点给UDI的实施带来了巨大的挑战。
各国已经实施的UDI系统基本符合IMDRF发布的指南文件要求。UDI系统由UDI、UDI载体和UDI数据库3个部分组成,UDI由产品标识(device identity,DI)和生产标识(products identity,PI)2个部分组成[1],在技术原理上没有大的差别。但各国在UDI法规框架、发码机构、数据库和实施方式等方面有较大的差异。因此,本文探讨中国和美国在UDI法规框架和实施中出现的问题并进行分析,为我国后续更深入开展UDI工作提供建设性意见。
1 中国和美国UDI的对比分析
1.1 法规框架
1.1.1 中国
2021年6月1日,《医疗器械监督管理条例》(国务院令第739号)(以下简称《条例》)开始实施,其中增加UDI的要求,确立了UDI的法律地位,要求医疗器械产品上市要满足UDI要求[2]。2019年5月,国务院办公厅印发《深化医药卫生体系体制改革2019年重点工作任务的通知》,提出UDI系统规则,探索实施高值耗材注册、采购、使用等环节规范编码的衔接应用。同年7月,国务院办公厅印发的《治理高值医用耗材改革方案》中明确提出制定UDI系统规则。同年8月,国家药品监督管理局(以下简称“国家药监局”)正式发布《医疗器械唯一标识系统规则》(以下简称《规则》),《规则》以规范性文件的方式发放,一共18条,分为总则、UDI、UDI数据载体、UDI数据库和附则5个部分[3],旨在以法规方式明确UDI系统框架、定义、组成和适用范围,明确各方利益主体的职责和义务。从2018年开始,国家药监局先后发布YY/T 1630—2018《医疗器械唯一标识基本要求》、YY/T 1631—2019《医疗器械唯一标识基础术语》、YY/T 1752—2020《医疗器械唯一标识数据库基本数据集》和YY/T 1753—2020《医疗器械唯一标识数据库填报指南》4项行业推荐性标准,这些标准的发布对UDI法规起到重要支撑作用。至此,确立了顶层法规《条例》下的UDI系统框架,我国UDI法规体系框架基本建立。
1.1.2 美国
2004年,FDA颁布法规要求在药品标签上使用条形码,但因当时没有与药品编码系统类似的标准和UDI系统而暂时放弃在医疗器械上使用相应的UDI规则。2007年,FDA补充法案(FDA amendments act,FDAAA)修订联邦法案519条款,加入f部分,明确FDA实施UDI的法律基础。2012年,FDA安全与创新法案(FDA safety and innovation act,FDASIA)修订联邦法案519条款f部分,加入了UDI系统实施时的法律框架。2013年发布UDI最终法规,并在法规发布时开放了全球唯一器械标识数据库(Globle Unique Device Identification Database,GUDID)上传功能,在2015年5月GUDID对公众开放。美国计划在2022年实现UDI的全面实施。FDA发布UDI最终规则之后,陆续发布一系列指南性文件,用于指导企业实施UDI[4]。指南性文件包括UDI系统、小企业依从性指南、UDI系统常见问题辑等(见表1)[5-8]。
中美两国都从法律角度规范UDI系统框架,确立UDI的法律地位,明确UDI系统各项要求,以及各方利益主体的职责与义务,并后续发布一系列指南用于对各方进行指导,以便更好地发展和推进UDI实施工作。由于美国实施UDI多年,其配套指南性文件更多,也根据企业的差别、产品的差别等特殊情况在不断增加和更新指南性文件,为UDI的实施奠定了扎实的基础。
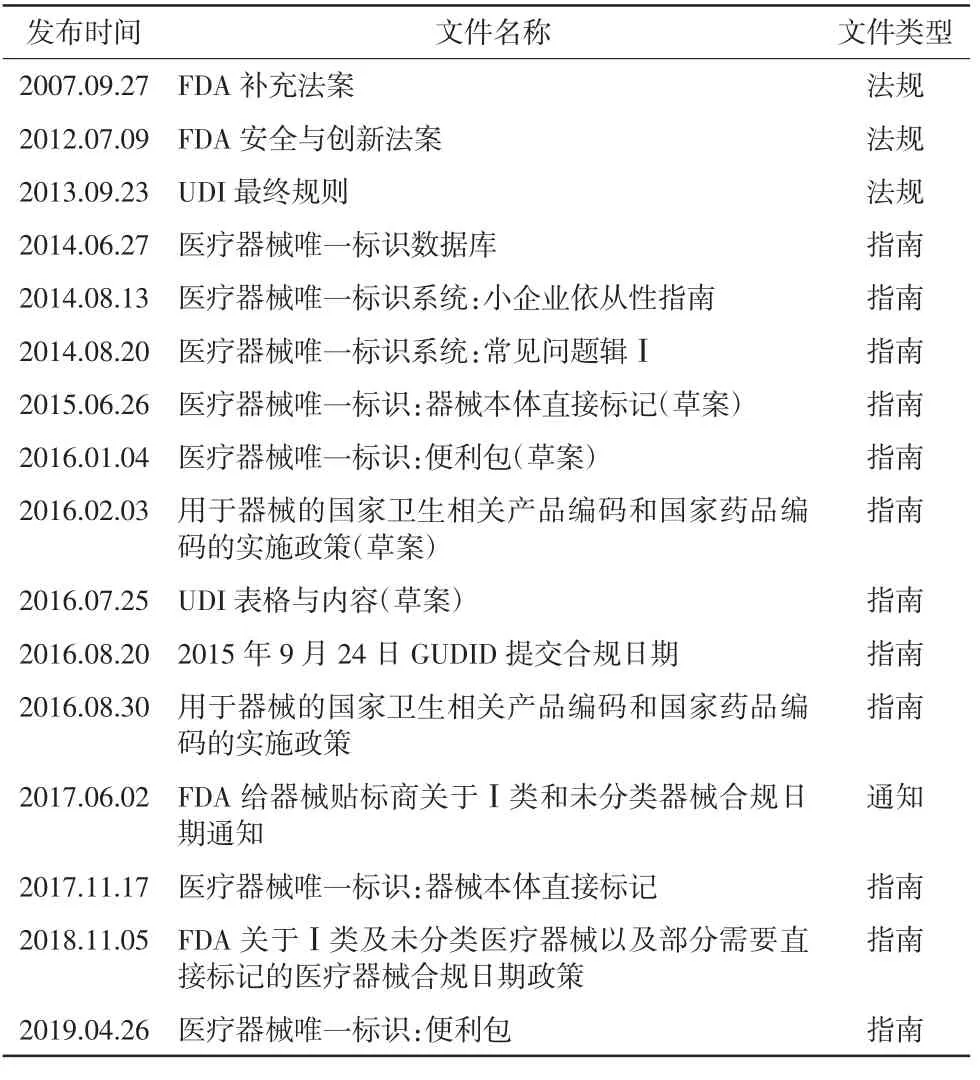
表1 FDA公布的UDI指南
1.2 发码机构
1.2.1 中国
我国国家药监局发布的《医疗器械唯一标识系统规则》中第十条指出,发码机构应为中国境内的法人机构,具备完善的管理制度和运行体系,确保按照其标准创建的UDI的唯一性,并符合国家数据安全要求。发码机构应当向注册人/备案人提供执行其标准的流程并指导实施,还应将其编码标准上传至UDI数据库并动态维护,每年1月31日前发码机构应当向国家药监局提交按照其标准创建的唯一标识上一年度的报告。与此同时,国家鼓励发码机构采用相关的国际标准创立唯一标识运行体系[3]。我国目前认可的3家发码机构为中国物品编码中心、中关村工信二维码技术研究院(Zhongguancun Industry and Information Research Institute of Two-Dimensional Code Technology,ZIIOT)和阿里健康技术(中国)有限公司。中国物品编码中心成立于1988年,隶属于国家市场监督管理总局,是统一组织、协调、管理我国商品条码、物品编码与自动识别技术的专门机构,也是国际物品编码组织在中国的分支结构[9]。ZIIOT成立于2014年,是专注于二维码技术研究和标准制定的科研服务机构,2018年ZIIOT获得了国际标准化组织、欧洲标准委员会、国际自动识别与移动技术协会三大国际组织的共同认可,成为国际代码发行机构,发行代码为“MA”[9]。阿里健康技术(中国)有限公司在2015年8月建立了网上追溯平台“码上放心”,向企业提供产品全生命周期追溯服务[9]。3家发码机构各有特色,可供医疗器械生产企业进行选择。
1.2.2 美国
FDA在《UDI最终规则》中对发码机构的定义是:由FDA认可、管理发行UDI系统的组织。UDI必须由FDA或FDA认证的发码机构通过其标准进行编码使用。FDA在《UDI最终规则》第830部分的子章节C分别对发码机构的要求、认证申请的过程、主体责任、终止或退出发码机构进行了阐述。
FDA在《UDI最终规则》第830部分的子章节C明确了UDI发码机构要求:
(1)资格。私人或国家机构都可以申请发码机构认证。
(2)认证标准。当机构运作的系统满足以下要求时,FDA即可认证其成为发码机构:①在分销和使用时可以充分识别医疗器械;②符合国际标准ISO/IEC 15459-2、ISO/IEC 15469-4和ISO/IEC 15459-6;③仅使用来自ISO/IEC 646的不变字符集中的字符和数字;④对所有使用者使用一致、公平、合理的条款和条件;⑤将防止发码机构与试图使用可能妨碍申请人独立运作公平中立标识系统UDI的贴标商之间的利益冲突[10]。
FDA在《UDI最终规则》中明确发码机构的要求:若出现特殊或者极端情况,FDA有权作为发码机构进行医疗器械发码工作,目的是避免造成市场混乱。同时FDA也明确了发码机构的退出机制。
美国授权的3家发码机构分别为国际物品编码组织(Globe Standard 1,GS1)、国际血库自动化委员会(International Council for Commonality in Blood Banking Automation,ICCBBA)和健康行业商业交流委员会(Health Industry Business Communications Council,HIBCC),各发码机构根据各标准的不同,运行各UDI分配系统。发码机构认证初始期限为3 a,发码机构的认证还会定期更新,7 a为一个周期[6,11]。
中美两国都引入第三方机构作为发码机构,并由各国相关监管单位对发码机构进行认可。不同的是,我国在《规则》中没有明确发码机构的退出机制,若出现发码机构因自身或特殊原因需要退出市场的情况,可能会造成市场混乱。因此,发码机构的变化是否会对已使用相应编码的企业和监管部门造成影响,对于此问题的解决,可考虑制定相关政策,避免造成损失和影响。
1.3 数据库
1.3.1 中国
医疗器械唯一标识数据库(Unique Device Identification Database,UDID)是UDI系统必不可少的一部分。2019年,UDID上线运行,向企业开放产品标识和数据申报等功能。目前,数据库可以通过查询、下载、应用程序接口(application programming interface,API)对接3种方式对医疗器械全生命周期各方进行共享服务。UDID主要涉及唯一标识数据库基本相关数据子集、注册人/备案人联系信息子集、唯一标识发码机构信息相关子集、唯一标识发码机构联系人的相关数据。其中,唯一标识数据库基本相关数据子集包含42个核心元素,可为产品标识基本信息、包装信息、操作储存信息、临床使用尺寸信息及企业联系信息。截至2021年6月,UDID已有56万多条数据[12]。
1.3.2 美国
美国作为最早实施UDI系统的国家,其数据库称为GUDID。GUDID的主要功能模块分为4个部分:GUDID账号申请模块、数据填报模块、公众查询模块、在线咨询模块,只有企业和发码机构注册GUDID账号才有权限进入GUDID。2015年,为了方便公众免费查询、下载UDI信息,FDA与美国国立医学图书馆建立了AcessGUDID。随着数据数量的增加,FDA后续增加了数据质量问题的模块,截至2021年6月,GUDID已有290多万条数据[13]。
1.4 实施方式
1.4.1 中国
2019年8月,国家药监局、国家卫生健康委办公厅发布《关于成立医疗器械唯一标识系统试点工作部门协作工作小组的通知》。同年9月,国家药监局发布《关于做好第一批试验医疗器械唯一标识工作相关事项的通知》,对第一批UDI实施的品种范围、进度安排、工作要求等做了明确要求,我国UDI试点工作正式进入实践阶段。国家药监局、国家卫生健康委和国家医保局在2020年9月30日联合印发《关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》,将UDI试点工作从2020年10月1日延长至2020年12月31日,首批试点的9个大类69个品种的高风险医疗器械2021年1月1日起实施[14]。我国各省份也在积极推进UDI试点工作,例如,上海市探索医疗器械全生命周期的UDI试点;天津市药品监督管理局联合天津市卫生健康委、天津市医保局在全域内开展UDI试点工作,探索UDI“三联医动”新局面。
1.4.2 美国
美国专门成立UDI工作组,监管美国境内实施过程并解决问题,保证UDI在美国顺利实施。美国刚开始规划7 a内分阶段实施UDI,从最高风险的医疗器械开始实施,因医疗器械实施后的复杂性,美国FDA提出,决定延迟2 a,因此UDI实施时间长达9 a。2014年9月24日,三类医疗器械以及根据《公共卫生服务法》(public health service act)(以下简称“PHS法案”)许可的医疗标签和包装必须带有UDI[15]。2015年9月24日,用于植入式、生命支持和生命维护的医疗器械标签和包装,必须带有UDI并符合日期格式的要求;用于生命支持和维持的可重复使用的医疗器械在使用前要进行再处理,因此必须进行永久性UDI标识;用于生命支持或维持器械的独立软件必须标识UDI[15]。直至2020年9月24日,一类和未被分类的医疗器械,其标签和包装必须带有UDI[5]。
美国根据既定规划年限进行分批实施UDI,我国在实施方式上,结合美国实施方式等经验并根据我国地域特色,实施UDI系统工作。同时,各省因地制宜地开展试点工作并与其省内侧重点相结合,探索UDI系统的新局面。
1.5 中国和美国UDI系统对比
中国和美国的UDI系统总体框架是相似的,但在具体实施过程中又存在较大差异,美国UDI系统实施的法规层级较高,具体条款比较细致。中国在UDI系统实施过程中考虑得更加全面,综合考虑了不同环节的需求。具体对比见表2。

表2 中美两国UDI系统对比
2 UDI实施过程中存在的问题和建议
2.1 存在的问题
2.1.1 中国
医疗器械具有多样性、复杂性和风险性的特点,建设UDI系统是一项长期而复杂的工作,在系统建设方面还需要各方的配合与支持。我国UDI试点工作还在初期阶段,2020年1月1日起,第一批9大类69种三类医疗器械应符合UDI法规要求,其标签和包装应具有UDI信息。在试点工作中,部分企业对《规则》内容理解不够深入,《规则》是UDI实施的基础,企业应掌握规则,设计并符合标准的医疗器械,做到标识能正确读取和解析。在供应链条上,扫码技术存在一定差异,各地发展水平不一,二维码的扫码应用还需完善,因此会导致识别的效率性差别[16]。目前,只有少部分生产企业对部分器械进行赋码,在流通环节和使用环节对医疗器械管理模式的转换需要花费时间、人力物力成本以及增加工作量。在医疗器械全生命周期的推进过程中,生产企业与流通企业的对接也是一项巨大的挑战,流通企业对接上、下游企业和医院在信息化、精细化的管理方面难度较高[17-18]。
2.1.2 美国
美国探索UDI体系用了近20 a时间,从法律角度规范UDI系统框架后,发布了指南性文件,用于对医疗器械各方进行指导,这些文件都发挥了重要作用。由于器械的复杂性和风险性特征,在实施UDI过程中发现的问题主要关于数据质量与维护、企业填报数据不规范、企业生产规模及产品与企业合规性等。为解决在实施中发现的问题,FDA发布相应的指导原则以及开展培训等活动,保证整个系统的良好运行。综合上述原因,FDA将UDI全面实施的时间推迟了2 a。
2.2 建议
(1)在法规方面,《规则》中可增加发码机构的退出机制,避免后续因发码机构退出导致对UDI系统产生较大的影响。
(2)在试点过程中,我国可根据实施UDI进程发布相应的指导规则,加强企业培训,让各方都能准确及时地学习和掌握相关政策。
(3)汲取美国在实施过程中数据质量、产品和企业合规性等方面的不足之处,监管部门应加强与医疗器械全生命周期各方的沟通交流,从而提高UDID中的数据质量,以便更好地推进UDI的全面实施。
3 结语
UDI已成为一个全球的议题,是医疗器械监管的重要转变之一,未来会在监管中发挥重要作用。我国UDI工作还处于初期阶段,全部第三类医疗器械即将开始实施UDI,后续会有更多产品加入到实施目录中。我国各省因地制宜,将UDI建设与各省特色相结合,推动UDI系统建设发展。后续试点工作中,我国可借鉴美国的实施经验,更多关注共性问题,UDID中数据的质量、数据填报和小型企业实施的合规性等问题,并进行指导。UDI建设是一项长期的系统工程,涉及面广,不能一蹴而就,需要循序渐进地实施。
