基于UPLC-MS/MS代谢组学技术分析不同栽培模式下铁皮石斛类黄酮化合物差异性
2022-02-23金传高任仙樱潘晓军吴志刚姜程曦
李 帆,金传高,任仙樱,费 璇,赵 祺,潘晓军,吴志刚*,姜程曦
基于UPLC-MS/MS代谢组学技术分析不同栽培模式下铁皮石斛类黄酮化合物差异性
李 帆1, 2,金传高3#,任仙樱2, 4,费 璇2,赵 祺2, 4,潘晓军2,吴志刚2*,姜程曦1, 4*
1. 温州大学生命科学研究院,浙江 温州 325035 2. 温州医科大学药学院,浙江 温州 325035 3. 浙江高鼻子生物科技有限公司,浙江 乐清 325615 4. 安徽省九华山佛教医药研究所,安徽 池州 247100
研究不同栽培模式下铁皮石斛中类黄酮化合物积累的差异,为铁皮石斛种植方式创新提供依据。运用超高效液相色谱串联质谱(UPLC-MS/MS)广泛靶向技术对3种栽培模式(大棚栽培、林下活树附生和岩壁附生栽培)下的铁皮石斛类黄酮物质进行检测,使用主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析法(orthogonal partial least squares-discriminant analysis,OPLS-DA)鉴定差异代谢物。共鉴定202个类黄酮化合物,主要以黄酮(76个)和黄酮醇(60个)化合物为主,其中花青素物质矢车菊素-3--葡萄糖苷-7,3′-di--(6′′--芥子酰葡萄糖苷)为首次在铁皮石斛中被检测到;OPLS-DA筛选43个差异化合物,其中大棚组与林下组、大棚组与岩壁组间均具有23个差异物,林下组与岩壁组则具有27个差异物,差异物质对表征不同栽培模式的样品贡献率明显。林下活树附生和岩壁附生栽培明显提升黄酮、类黄酮化合物的生物合成水平,保障了药材质量,研究结果为新型栽培模式的推广提供了理论基础。
铁皮石斛;UPLC-MS/MS;类黄酮;代谢组学;栽培模式
铁皮石斛Kimura et Migo.为石斛属多年生草本植物,入选“影响世界的中国植物”,被誉为中华“九大仙草”之首,为我国名贵中药[1-2]。铁皮石斛地上茎可加工成铁皮枫斗,《神农本草经》列为上品,味甘,主伤中、下气,补五脏虚劳、羸弱,强阴、厚肠胃、轻身延年之功效[3]。药理研究表明,铁皮石斛在提高人体免疫能力、抗衰老、抗肿瘤、改善糖尿病症状和萎缩性胃炎等方面具有显著的疗效[4-6]。
浙江是我国铁皮石斛的道地产区之一,铁皮石斛已被列入“新浙八味”。自2000年以来产区在品种选育、组织培养、栽培措施等关键技术方面取得突破性的进展[7-9],促进了石斛产业快速的发展。特别是,近年来以林下活树附生、岩壁附生等近野生栽培技术悄然兴起,成为铁皮石斛的新型的栽培模式,从而逐步使铁皮石斛种植由大棚向森林回归。然后,不同的栽培方式的光、温、湿度等环境因素千差万别,一定程度也会对铁皮石斛生长、有效成分积累造成影响。已有研究表明,光质和低温显著铁皮石斛种苗的发育、次生代谢产物的调控,但研究主要集中在氨基酸、多糖、生物碱等成分[10-11]。类黄酮是铁皮石斛一类重要的活性成分,具有抗氧化、降血糖、降低胆固醇、保护心血管系统等药理活性[12]。光、温等环境胁迫是诱导植物类黄酮化合物生长合成的重要环境因素之一[13]。因而,推测不同栽培模式下因其环境差异性可能会对类黄酮的生物合成造成一定影响,从而影响铁皮石斛的品质,而有关这方面未见报道。
鉴于类黄酮物质重要的药用价值,本实验采用超高效液相色谱串联质谱(UPLC-MS/MS)结合植物广泛靶向代谢组学技术整体表征3种栽培模式下铁皮石斛类黄酮化合物差异性,利用主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析法(orthogonal partial least squares-discriminant analysis,OPLS-DA)等多元统计手段鉴定主导这种差异性的标志性的代谢物,发掘潜在的规律,以为改进铁皮石斛种植模式及提供高质量产品奠定基础。
1 仪器与材料
超高效液相色谱(UFLC SHIMADZU CBM30,日本岛津公司),4500 QTRAP型高分辨串联质谱(美国应用生物系统公司)。主要试剂包括甲醇(LC-MS级,美国Merk公司)、乙腈(LC-MS级,美国Merk公司),水为超纯水(Milli-Q SP Regent Water system,美国),MM 400型研磨仪(德国莱驰公司)。
本课题组于2017年4月使用同一批种苗,在雁荡山石斛谷基地(E121.06°、N28.39°)布置了大棚、林下活树附生和岩壁栽培实验。实验材料于2019年11月采集该实验条件的样品,由温州医科大学吴志刚副研究员鉴定为铁皮石斛Kimura et Migo.鲜条。每个样品取自5株不同植株的鲜条,液氮下研碎,均匀混合。不同栽培模式均4次生物学重复,共12个样品。此外,3种栽培模式样品等量混合构成质控样本,共3个重复,用于检测仪器的重复性和精确度。所用样品放置−80 ℃超低温冰箱备用。
2 方法
2.1 样品制备
铁皮石斛样品经真空冷冻干燥后,研磨仪(30 Hz,1.5 min)研磨至粉末状;称取100 mg的粉末,溶解于1.0 mL的70%甲醇水溶液中;溶解后的样品4 ℃冰箱过夜,期间涡旋3次,以提高提取率;离心(转速10 000×,10 min)后,上清液用微孔滤膜(0.22 µm)滤过后进样。
2.2 色谱和质谱采集条件
色谱柱:ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 µm),十八烷基键合硅胶为填充剂。流动相为0.04%乙酸超纯水(A)-乙腈(含0.04%的乙酸(B),洗脱梯度:0~11.0 min,5%~95% B;11.0~12.0 min,95% B;12.1~15.0 min,5% B。体积流量0.4 mL/min,柱温40 ℃,进样量5 µL。
采用正负离子模式检测模式,雾化气体为高纯度氮气(N2),电喷雾离子源(ESI)温度550 ℃,离子化电压5500 V,帘气(curtain gas,CUR)207 kPa,辅助电压60 kPa。按参考文献[15]方法优化去簇电压和碰撞能。质量扫描范围/100~1200,扫描时间0.2 s。
2.3 数据处理
MultiaQuant软件对色谱峰的进行积分和校正,每个色谱峰的峰面积代表对应物质的相对含量,导出数据矩阵。利用三重四级杆质谱的多反应监测模式(MRM)将获得的二级质谱数据与数据库进行比对,对化合物进行定性、定量分析。使用数据库包括迈维公司自建MWDB、MassBank(http://www. massbank.jp/)、HMDB(http://www.hmdb.ca/)和METLIN(http://metlin.scripps.edu/index.php)等数据库。R软件ropls包对数据矩阵进行PCA和OPLS-DA分析,鉴定差异性代谢产物。使用R软件pheatmap包进行聚类分析(hierarchical cluster analysis,HCA),以表征不同样本代谢物的积累模式。
3 结果与分析
3.1 铁皮石斛类黄酮化合物的鉴定
UPLC-MS/MS首先以正、负离子模式对混样质控QC样品进行检测,质控样本TIC曲线重叠性高、质谱峰保留时间和强度一致,表明所建方法可靠、仪器稳定性较好(图1-A)。所获得的代谢物高分辨二级质谱数据经与公共数据库比对,共鉴定202个类黄酮化合物,其中黄酮化合物76个、黄酮醇60个、黄酮碳糖苷21个、二氢黄酮16个、黄烷醇类10个,此外还包含少量异黄酮、二氢黄酮醇、原花青素和花青素等物质。其中,花青素物质矢车菊素-3--葡萄糖苷- 7,3′-di--(6′′--芥子酰葡萄糖苷)首次在铁皮石斛中被报道。大棚、林下及岩壁附生栽培的样品的UPLC-MS/MS基峰离子流图如图1-B~D所示,直观显示不同栽培模式下类黄酮化合物的存在较为明显的差异。

A-混样质控样品 B-大棚种植样品 C-林下活树附生种植样品 D-岩壁附生种植样品,下同
3.2 PCA和代谢物积累模式分析
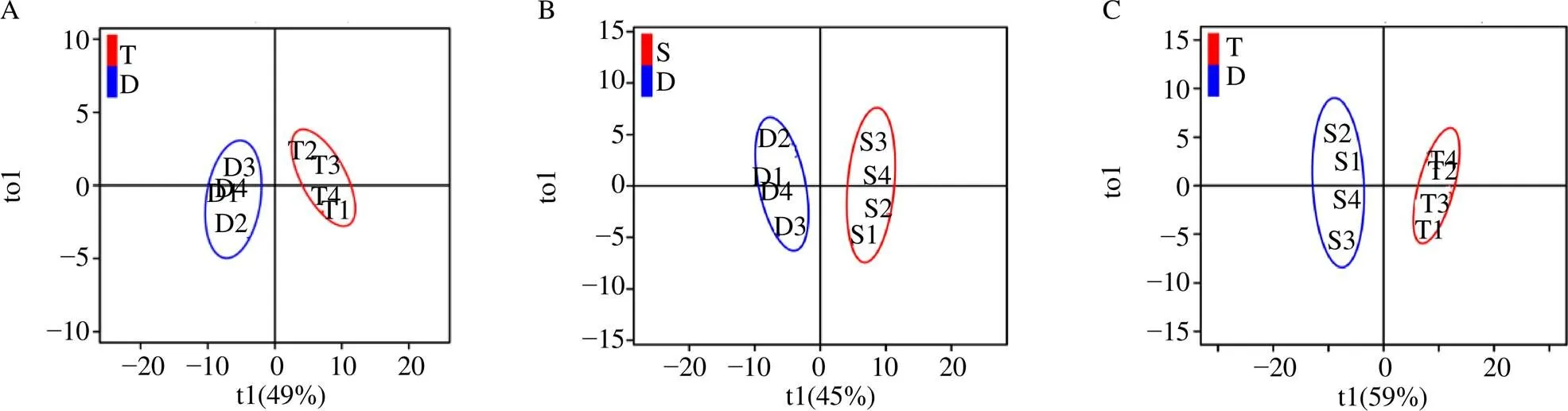
代谢组数据经标准化处理后进行PCA分析,前2个主成分特征值>1,模型累积解释率R为0.64。一般认为R大于0.5,表示模型可靠,值越大越能反映样本间的差异。PCA得分见图2,表明各组样本分布于不同区域,所建立方法可良好表征不同栽培模式下代谢物的差异性。变量载荷图显示几种物质位于坐标边缘(图2-B),表明这些物质在组间样本中差异明显(有较大/较小的极端值等),它们对排序空间和样本差异的贡献较大,可能是重要的标志性代谢物。例如,矢车菊素-3--葡萄糖苷- 7,3′-di--(6′′--芥子酰葡萄糖苷)(Lmtp003544)、原花青素B1(mws0836)、金圣草黄素--葡萄糖醛酸--己糖苷(pmb0587)、金圣草黄素-C-己糖苷(pmb0689)、番石榴苷(mws4183)、多花紫藤苷(Lmdp003994)等。此外,聚类分析显示(图2-C),不同组间代谢物积累模式存在明显的差异,同一组的样本代谢物积累趋势较为一致且高度聚合一支。

A-样品PCA得分图 B-代谢物质载荷图 C-代谢物聚类模式热图 S-岩壁种植样品 T-林下活树附生种植样品 D-大棚种植样品,表1同
3.3 不同栽培模式下差异代谢物的鉴定
OPLS-DA为分类监督模式识别方法,可降低样本组内差异,能更加准确表征样本组间特征。为进一步挖掘不同栽培模式下铁皮石斛差异性,鉴定潜在的差异类黄酮物质,分别对3种栽培模式组间代谢数据进行OPLS-DA分析。
根据OPLS-DA模型的变量重要性投影(variable importance in project,VIP)鉴定差异代谢物,标准为VIP>1且单维检验<0.05(差异倍数值fold change>2),共鉴定43个差异物质(表1)。表1分析发现,大棚组与林下组共存在23个差异物质,其中7个物质在林下组上调高积累;大棚组与岩壁组也具23个差异物,其中21个在岩壁组上调积累;林下组与岩壁组则存在27个差异物,且均在岩壁组上调积累。值得注意是,3组间差异代谢物共同认定1个标志性物质—矢车菊素-3--葡萄糖苷- 7,3′-di--(6′′--芥子酰葡萄糖苷),暗示该物质在表征3种栽培模式下的代谢物中的贡献率最大,与PCA结果相互佐证。进一步以VIP>3筛选发现:大棚与林下组间,芦丁、芹菜素-6,8--二葡萄糖苷及根皮素差异变化大;大棚与岩壁组间,柚皮素、紫铆素及6-羟基山柰酚-7,6--二葡萄糖苷差异变化大;而在林下与岩壁组中,芦丁、异金丝桃苷及6-羟基山柰酚-7--葡萄糖苷变化最大。综合评价,上述物质对于表征不同栽培模式下铁皮石斛代谢物的差异性贡献较大。
OPLS-DA模型优化表明大棚组与林下组的2、2、2值,分别为0.665、0.955、0.802;大棚组与崖壁组2、2、2值,分别为0.644、0.979、0.902;林下组与岩壁组2、2、2,分别为0.789、0.973、0.932。OPLS-DA得分图如图3所示,表明所建立的模型对组间样品具有良好的区分度,相同组内样品高度聚合一类。OPLS-DA排列验证(=200)实验表明,3组模型的原始R和Q均大于Y置换后的相应的值,暗示3组模型未过度拟合,可用于后续代谢物的鉴定。
3.4 差异代谢物代谢通路分析
为深入解析差异代谢物参与的代谢路径,对43个差异代谢物进行KEGG代谢途径注释(图4),发现大部分化合物富集到ko00944(黄酮和黄酮醇生物合成)、ko00941(类黄酮生物物合成)2个代谢途径中,1个化合物被注释到ko00942(花青素生物合成)途径。进一步分析发现,与大棚种植模式相比,林下和岩壁组中上述代谢通路被明显上调,次生代谢产物合成被显著提升,尤其以岩壁种植为高。例如柚皮素、圣草酚、紫山叶素等黄酮类前体物质在林下组和岩壁组中含量增加明显,分别较之大棚组提升了3.6倍和4.9倍、10.6倍和11.1倍、9.3倍和18.0倍。花青素代谢路径中的矢车菊素-3--葡萄糖苷- 7,3′-di--(6′′--芥子酰葡萄糖苷)在林下组和岩壁组中的含量较之大棚组分别增加了6.8、26.6倍,暗示此物质很可能是近野生栽培过程中铁皮石斛茎皮紫色表型形成的主要物质基础。
表1 不同栽培模式下铁皮石斛类黄酮差异代谢物
Table 1 Information of different flavonoes and flavonoids detected in D. officinale from different planting modes
中文名英文名D vs TD vs ST vs S log2_FCVIPLog2_FCVIPLog2_FCVIP 4,2′,4′,6′-四羟基查耳酮4,2′,4′,6′-tetrahydroxychalcone1.57 2.95 1.52 2.35 −− 柚皮素naringenin1.85 2.59 2.30 3.08 −− 圣草酚eriodictyol3.41 2.61 3.48 2.21 −− 槲皮素-O-芸香苷-己糖quercetin-O-rutinoside-hexose−−2.51 1.41 4.52 1.30 槲皮素-3-O-葡萄糖苷-7-O-鼠李糖苷quercetin-3-O-glucoside-7-O-rhamnoside−2.01 1.55 −−2.77 1.89 槲皮素-O-阿魏酰戊糖苷quercetin-O-feruloyl-pentoside−2.10 1.48 −−2.78 1.64 槲皮素-3-O-鼠李糖基半乳糖苷quercetin-3-O-rhanosylgalactoside−2.03 1.57 −−2.83 1.91 槲皮素-3-O-葡萄糖苷quercetin-3-O-glucoside−−2.81 1.65 2.72 1.41 槲皮素-3-O-洋槐糖苷quercetin-3-O-robinobioside−1.73 1.64 −−2.59 2.17 槲皮素-O-葡萄糖苷quercetin-O-glucoside−−2.49 1.55 3.16 1.42 槲皮素-3-O-β-D-葡萄糖苷quercetin 3-O-β-D-glucoside−2.70 2.61 −−3.41 2.91 甲基槲皮素葡萄糖-鼠李糖methylquercetin glu-rha−−1.57 1.68 3.17 1.74 异金丝桃苷isohyperoside−2.28 2.93 −−2.88 3.23 金丝桃苷hyperin−−2.54 2.01 3.19 1.87 橙皮苷hesperidin−1.73 2.83 −−2.70 3.73 橙皮素-5-O-葡萄糖苷hesperetin5-O-glucoside−−2.85 1.82 2.78 1.56 橙皮素-O-丙二酰基己糖苷hesperetin O-malonylhexoside−1.44 1.22 −2.25 1.24 −− 绣线菊苷spiraeoside−− 2.64 1.60 2.61 1.39 异鼠李素-3-O-芸香糖苷isorhamnetin-3-O-rutinoside −− 1.64 2.13 2.90 2.14 芹菜素-8-C-α-L-阿拉伯糖苷apigenin 8-C-α-L-arabinopyranoside−− 3.76 1.01 −− 芹菜素-6,8-C-二葡萄糖苷apigenin 6,8-C-diglucoside−1.18 4.24 −−−− 矢车菊素-3-O-葡萄糖-7,3′-di-O-(6′′-O-芥子酰葡萄糖苷)cyanidin-3-O-glucoside-7,3′-di-O-[6′′-O-si-pylglucoside]4.74 2.79 2.76 1.24 1.98 1.98 紫杉叶素taxifolin−−4.16 1.16 −− 芦丁rutin−1.62 4.68 −−2.42 6.08 短叶松素pinobanksin 1.96 2.61 2.31 2.97 −− 香叶木素-7-O-半乳糖苷diosmetin-7-O-galactoside−1.39 1.15 −1.89 1.33 −− 根皮素phloretin3.03 3.19 2.79 2.66 −− 金圣草黄素-6,8-二-C-葡萄糖苷chrysoeriol-6,8-di-C-glucoside−2.74 2.46 −−1.91 1.18 紫铆素butin 1.89 2.76 2.37 3.32 −− 木犀草素 8-C-己糖苷-O-己糖苷luteolin 8-C-hexosyl-O-hexoside−2.11 1.70 −−2.80 1.89 木犀草素-7-O-β-D-芸香糖苷luteolin-7-O-β-D-rutinoside−1.27 2.29 −−−− 木犀草素-6-C-2-葡萄糖醛酸葡萄糖苷luteolin-6-C-2-glucuronylglucoside−2.44 1.21 −−−− 木犀草素-7-O-芸香糖苷luteolin-7-O-rutinoside−−−−4.24 1.29 6-羟基木犀草素 5-葡萄糖苷6-hydroxyluteolin 5-glucoside−−2.91 1.65 −− 牡荆素-2-O-D-吡喃葡萄糖苷vitexin-2-O-D-glucopyranoside−1.34 1.84 −−−− 山柰酚-3-O-新橙皮糖苷kaempferol-3-O-neohesperidoside−−−−4.02 2.11 山柰酚-3-O-洋槐糖苷kaempferol-3-O-robinobioside (biorobin)−−−−4.06 1.63 山柰酚-3-O-芸香糖苷kaempferol-3-O-rutinoside−−−−3.87 1.60 山柰酚-3-O-β-D-(6′′-O-(E)-p-香豆酰)kaempferol-3-O-β-D-(6′′-O-(E)-p-coumaroyl) −−−−4.09 2.14 6-羟基山柰酚-7-O-葡萄糖苷6-hydroxykaempferol-7-O-glucoside−−−−2.38 3.05 6-羟基山柰酚-3,6-O-二葡萄糖苷6-hydroxykaempferol-3,6-O-diglucoside−−8.88 1.10 −− 6-羟基山柰酚-7,6-O-二葡萄糖苷6-hydroxykaempferol-7,6-O-diglucoside−−4.41 3.45 3.85 2.88 6-羟基山柰酚-3,7,6-O-三葡萄糖苷6-hydroxykaempferol-3,7,6-O-triglycoside−−4.93 1.85 2.33 1.45
A-林下附生种植相比大棚种植 B-岩壁附生种植相比大棚种植 C-岩壁附生种植林下附生种植

红颜色字体物质代表鉴定的差异物质;代谢物热图表示在不同栽培模式中的积累模式,蓝色表示低水平,黄色表示高水平
4 讨论
植物代谢组学具有“高维、海量”的特点,结合多元统计分析方法可多维度揭示植物体在响应不同环境下的代谢产物变化模式,从而解释其生命本质问题[15]。UPLC-MS/MS广泛靶向技术结合了非靶向和靶向代谢组学的优点,基于代谢组自建、公共数据库和多反应监测模型,可定性、定量且高覆盖地检测样品中代谢物的含量[16]。本实验利用广泛靶向组学技术,对来自3种栽培模式的12个铁皮石斛样品共检测到202个黄酮类物质,其中大部分以黄酮(76个)、黄酮醇(60个)为主。不同栽培措施明显改变了铁皮石斛体内黄酮类物质积累模式(图3-C),林下和岩壁附生种植较大棚种植明显提升了黄酮或类黄酮代谢通路(ko00944、ko00941)次生代谢产物合成水平(图4)。比较发现,柚皮素、圣草酚、紫山叶素等类黄酮合成通路中关键前体物质在林下和岩壁栽培组中均明显上调积累,尤以岩壁附生栽培最高。多项研究表明,紫外线是促使植物合成黄酮类化合物的重要的胁迫环境之一[13]。例如,UV-A诱导大豆、及等基因的特异表达,且增强了大豆异黄酮、柚皮素等物质在大豆中的积累[17]。因而,分析认为林下活树附生和岩壁附生等近野生栽培方式因无遮荫措施,相比大棚栽培,其高UV强度很可能是造成铁皮石斛高积累黄酮类物质重要因素。深入的原因,仍需通过关联基因表达组数据予以验证。
此外,UV、低温等逆境胁迫也是诱导植物花青素合成重要因子[18-19]。生产上,林下活树附生和岩壁附生等近野生栽培方式往往促使铁皮石斛茎皮形成紫色表型,且茎水溶液呈淡至深紫色,而大棚栽培铁皮石斛水溶液往往呈深绿色。矢车菊素糖苷配体化合物是花青素中的主要成员,是植物细胞内呈现紫色的主要色素之一。本研究中,广泛靶向技术检测到唯一个花青苷物质—矢车菊素-3--葡萄糖苷-7,3′- di--(6′′--芥子酰葡萄糖苷)(Lmtp003544),该物质在表征三种栽培模式下的代谢物差异性的贡献率最大(图2-A,表1)。比较发现,相比大棚栽培的铁皮石斛,近野生栽培方式Lmtp003544相对含量至少提升6.8倍,岩壁附生栽培甚至提升了26.6倍,暗示该物质极有可能是紫色表型形成的标志性成分。因而,未来以该指标作为不同来源铁皮石斛的质量控制方法具有很好的可行性,将为药材等级的划分提供重要技术支撑。当前,近野生栽培的铁皮石斛市场价格是大棚栽培的10~15倍。本研究首次在理论上揭示了近野生栽培能大大提升了类黄酮物质的积累。鉴于该类化合物的重要的医药保健价值,建议生产上大力推广林下附生与岩壁附生栽培模式,以提高铁皮石斛的品质和产业价值。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 295.
[2] 李以格, 杨杭, 姜琪梦, 等. 珍稀药用植物铁皮石斛的组学及功能基因研究进展 [J]. 生命科学, 2019, 31(9): 959-967.
[3] 颜美秋, 陈素红, 吕圭源. 石斛“厚肠胃”相关功效药理学研究及应用进展 [J]. 中草药, 2016, 47(21): 3918-3924.
[4] 孙乐, 陈晓梅, 吴崇明, 等. 铁皮石斛多糖药理活性研究进展 [J]. 药学学报, 2020, 55(10): 2322-2329.
[5] 奚航献, 刘晨, 刘京晶, 等. 铁皮石斛化学成分、药理作用及其质量标志物 (Q-marker) 的预测分析 [J]. 中草药, 2020, 51(11): 3097-3109.
[6] 李毓扬, 吕承豪, 吴广, 等. 铁皮石斛干预代谢综合征的作用分子机制研究进展 [J]. 中国中药杂志, 2019, 44(23): 5102-5108.
[7] 陈晓梅, 田丽霞, 单婷婷, 等. 铁皮石斛种质资源和遗传育种研究进展 [J]. 药学学报, 2018, 53(9): 1493-1503.
[8] 斯金平, 陈梓云, 刘京晶, 等. 铁皮石斛悬崖附生栽培技术研究 [J]. 中国中药杂志, 2015, 40(12): 2289-2292.
[9] 斯金平, 王琦, 刘仲健, 等. 铁皮石斛产业化关键科学与技术的突破 [J]. 中国中药杂志, 2017, 42(12): 2223-2227.
[10] 王珂珂. 不同栽培模式下铁皮石斛药用价值的比较研究 [D]. 福州: 福建农林大学, 2016.
[11] Yuan Y D, Tang X G, Jia Z H,. The effects of ecological factors on the main medicinal components ofunder different cultivation modes [J]., 2020, 11(1): 94.
[12] 吕朝耕, 李佳兴, 蒋靖怡, 等. 浙产铁皮石斛不同生长期石斛酚、有机酸和黄酮类成分积累变化 [J]. 中华中医药杂志, 2019, 34(5): 1989-1992.
[13] 潘俊倩, 佟曦然, 郭宝林. 光对植物黄酮类化合物的影响研究进展 [J]. 中国中药杂志, 2016, 41(21): 3897-3903.
[14] Chen W, Gong L, Guo Z L,. A novel integrated method for large-scale detection, identification, and quantification of widely targeted metabolites: Application in the study of rice metabolomics [J]., 2013, 6(6): 1769-1780.
[15] Villate A, San Nicolas M, Gallastegi M,. Review: Metabolomics as a prediction tool for plants performance under environmental stress [J]., 2021, 303: 110789.
[16] Wei R, Li G D, Seymour A B. High-throughput and multiplexed LC/MS/MRM method for targeted metabolomics [J]., 2010, 82(13): 5527-5533.
[17] Lim Y J, Lyu J I, Kwon S J,. Effects of UV-A radiation on organ-specific accumulation and gene expression of isoflavones and flavonols in soybean sprout [J]., 2021, 339: 128080.
[18] Landi M, Tattini M, Gould K S. Multiple functional roles of anthocyanins in plant-environment interactions [J]., 2015, 119: 4-17.
[19] 王峰, 王秀杰, 赵胜男, 等. 光对园艺植物花青素生物合成的调控作用 [J]. 中国农业科学, 2020, 53(23): 4904-4917.
UPLC-MS/MS metabonomics technology revealing difference of flavonoids inunder different planting modes
LI Fan1, 2, JIN Chuan-gao3, REN Xian-ying2, 4, FEI Xuan2, ZHAO Qi2, 4, PAN Xiao-jun2, WU Zhi-gang2, JIANG Cheng-xi1, 4
1. Institute of Life Sciences, Wenzhou University, Wenzhou 325035, China 2. School of Pharmacy, Wenzhou Medical University, Wenzhou 325035, China 3. Zhejiang Gaobizi Biological Technology Co., Ltd., Leqing 325615, China 4. Jiuhuashan Buddhist Medicine Research Institute, Chizhou 247100, China
To reveal the difference of flavonoid components inunder different planting modes, in order to provide a basis for the innovation of planting mode.The extensive target metabonomics tool via UPLC-MS/MS workflow was used to detect the flavonoids instem samples produced from three planting modes (including greenhouse, living tree epiphysis planting, and cliff epiphytic planting). Principal component analysis (PCA) and orthogonal partial least squares-discriminant analysis (OPLS-DA) were performed to identify differential metabolites.A total of 202 compounds were identified, mainly including flavonoids (76) and flavonols (60). A novel anthocyanin, cyanidin-3-- glucoside-7,3′-di--(6′′--Si-pylglucoside) was first detected instem samples. OPLS-DA identified 43 differential compounds, among which 23 flavonoids were found between greenhouse planting and living tree epiphysis planting mode, as well as greenhouse planting and cliff epiphytic planting mode. Additionally, there were 27 differential flavonoids between living tree epiphysis planting and cliff epiphytic planting modes. Overall, the difference of samples from different plant modes was well explained by these differential flavonoids.The living tree epiphysis and cliff epiphytic planting modes significantly unregulated the flavonoids biosynthetic pathway relative to greenhouse planting, thus improving the quality of medicinal materials. This result provides a scientific basis for the promotion of novel planting modes withinproduction.
Kimura et Migo.;UPLC-MS/MS; flavonoids; metabonomics; planting mode
R286.2
A
0253 - 2670(2022)04 - 1156 - 07
10.7501/j.issn.0253-2670.2022.04.024
2021-09-06
温州医科大学人才项目(89220027);浙江省重点实验室项目(2021E10013);安徽济人药业有限公司课题(KJHX2009);合肥市未来药物开发有限公司(KJHX2008);云南大理药业股份有限公司课题(KJHX1603)
李 帆,硕士研究生,主要从事中药生物技术研究。E-mail: 1471750585@qq.com
姜程曦,教授,主要从事中药生物技术研究。E-mail: jiangchengxi@126.com
吴志刚,副研究员,主要从事药用植物次生代谢产物研究。E-mail: wuzhigang177@126.com
#共同第一作者:金传高,工程师,从事铁皮石斛技术开发研究。E-mail: 850254737@qq.com
[责任编辑 时圣明]
